海蜇养殖港塭微型浮游动物的摄食和生产力研究*
2011-01-08田相利董双林冯建祥孙侦龙宫海宁
张 凯,田相利**,董双林,冯建祥,孙侦龙,宫海宁
(1.中国海洋大学海水养殖教育部重点实验室,山东青岛266003;2.大连海洋大学生命科学与技术学院,辽宁大连116023)
海蜇养殖港塭微型浮游动物的摄食和生产力研究*
张 凯1,田相利1**,董双林1,冯建祥1,孙侦龙1,宫海宁2
(1.中国海洋大学海水养殖教育部重点实验室,山东青岛266003;2.大连海洋大学生命科学与技术学院,辽宁大连116023)
通过对山东省靖海湾海蜇养殖港塭定期采样,采用稀释法研究该海蜇养殖港塭水体中浮游植物的生长率、微型浮游动物对浮游植物的摄食率、摄食压力以及微型浮游动物的生产力。研究结果表明,海蜇养殖港塭微型浮游动物组成比较简单,海蜇养殖期间微型浮游动物丰度低于海蜇捕捞结束期。其中,海蜇养殖期间微型浮游动物的优势种为根状拟铃虫(Tintinnopsis radix),为600~2 600 ind/L,而海蜇捕捞结束后优势种为根状拟铃虫、诺氏麻铃虫(Leprotintinnus nordquisti)和运动类铃虫(Codonellopsis mobilis),丰度分别为3 000~6 000、1 500~3 000、1 500~3 000 ind/L。研究期间,该港塭浮游植物生长率为0.05~1.03 d-1。微型浮游动物的摄食率为0.24~2.37 d-1,对浮游植物现存量的摄食压力为21.10%~90.61%,对潜在初级生产力的摄食压力为77.08%~583.68%,而微型浮游动物的次级生产力占初级生产力的22.92%~76.92%。本研究表明微型浮游动物在海蜇养殖港塭生态系统物质和能量流动中起着重要作用。
海蜇养殖港塭;微型浮游动物;摄食;稀释法;生产力
微型浮游动物(Microzooplankton)是指体长<200 μm的浮游动物[1],主要包括纤毛虫、鞭毛虫和一些小型浮游动物的幼体等,主要摄取水体中的微型浮游植物和异养细菌等为食。微型浮游动物是水生生态系统的重要组成部分之一,其在水生生态系统中的作用日益受到人们的重视。作为微食物网与经典食物链之间重要的营养中介,可以将物质、能量从微型生产者转移给更大的浮游动物[2]。同时,微型浮游动物在水体营养盐循环和再生方面也发挥着重要的作用[3]。
海蜇(Rhopilema esculentum)隶属于腔肠动物门、钵水母纲、根口水母目、根口水母科、海蜇属的无缘膜动物[4],主要以浮游动物为食,如桡足类、枝角类、介形类、涟虫类、端足类、纤毛虫类、贝类幼体等。海蜇是大型食用水母,脂肪含量极低,蛋白质和无机盐含量丰富,深受国内外消费者的青睐,经济价值较高。近年来,海蜇已成为我国重要的海水养殖经济种类之一,2006年全国总产量已达到23.17万t[5]。在海蜇的港塭养殖中,养殖过程不投喂饵料,其产量主要依靠港塭的天然饵料获得。因此,港塭水体中浮游动物的组成和数量及其生产力决定了海蜇的放养量和产量的高低。微型浮游动物是海蜇的直接食物来源之一,同时又被中型浮游动物所食,间接将能量传递到海蜇。所以微型浮游动物的生物量不仅直接影响海蜇产量,还在海蜇养殖港塭生态系统物质循环和能量流动中起着重要作用。
自Landry等[6]提出稀释法用于研究微型浮游动物摄食和生产力至今,已用这种方法在许多海区进行了微型浮游动物的摄食研究[7-8]。然而,以往的相关研究多集中于海湾、海峡或大洋等开放海域水体,关于海蜇养殖港塭微型浮游动物的摄食和次级生产力研究尚未见报道。靖海湾地处山东省东北部(36°86′N,122°13′E),是我国重要的海蜇养殖基地之一。本研究以靖海湾海蜇养殖港塭为研究区域,通过稀释法对海蜇养殖港塭微型浮游动物摄食及生产力进行了初步研究,以期了解微型浮游动物在海蜇养殖港塭中的生态作用,为海蜇养殖港塭生态系统物质循环和能量流动模型的建立提供基本数据和参数,最终为港塭海蜇养殖环境容量的确定提供理论依据。
1 材料和方法
1.1 实验时间与站位
实验于2009年8~10月在山东荣成靖海湾海蜇养殖港塭进行,港塭面积约为3.13×106m2,是由人工在海湾中筑坝围成,海蜇的放养量为90万尾。养殖过程中不投喂人工饵料,通过大换水,主要利用港塭天然生产力进行生产。港塭平均水深3 m左右,每天换水量为30%~40%。本研究设计了3个采样点,分别是靠近入水口的S1点、位于港塭中央的S5点和靠近出水口的S9点。采样港塭及采样点的位置如图1所示。每次取样时同时测定水体温度和盐度。营养盐的测定按照国家海洋调查规范进行[9]。
整个研究期间共进行了5次采样及测定工作,其中2009年8月6日~9月6日为海蜇养殖期,而9月24日~10月18日则为海蜇捕捞结束期。

图1 海蜇养殖港塭及采样点位置示意图Fig.1 Stations of sampling and experiment
1.2 叶绿素a的采样与测定
用5 L有机玻璃采水器采集水样,经WhatmanGF/F滤膜(Φ47 mm)过滤海水0.6~1 L,滤膜用10 mL90%丙酮避光萃取24~36 h,用UV1700型紫外可见分光光度计(日本岛津公司)测定其浓度。
1.3 微型浮游动物采样、固定与计数
采取表层水2 L,加入Lugol’s液20 mL固定,水样在阴凉处保存,先静止沉降48 h以上,用底端附有20μm的筛绢的吸管虹吸去除上清液,浓缩至30 mL,吸取0.1 mL置于浮游植物记数框中,OlympusCQ51显微镜下放大200倍进行微型浮游动物的鉴定与计数。
1.4 稀释法测定微型浮游动物的摄食压力
按文献[6]的方法,各实验点分别采表、中、底层水各20 L,混盛于60 L塑料桶中,充分混合后,取30 L用200μm筛绢过滤,以除去中型浮游动物;再取15 L用装有Whatman GF/F滤膜(Φ47 mm)的滤器过滤。将200μm筛绢过滤过的海水与GF/F滤膜过滤过的海水按一定比例混合,设4个稀释比例,分别为1∶0,3∶1,1∶1和1∶3,每个比例设2个平行样。每个比例取2份水样各500 mL,GF/F膜过滤,作为培养初始的Chla浓度和计算实际的稀释比例,余下的水样分装于2L的聚碳酸酯培养瓶中。将培养瓶放回取样点,培养24 h。培养结束后,每瓶采水500 mL,GF/F滤膜过滤,测定Chla的浓度。根据稀释法原理,用线性回归方程求得浮游植物的生长率k(d-1)和微型浮游动物的摄食率g(d-1)。微型浮游动物对浮游植物现存量和初级生产力的摄食压力(分别用Pi和PP表示),用下列公式求出(k为浮游植物的生长率,g为摄食率,t为培养时间)[10]:

1.5 微型浮游动物生产力的计算
根据文献[11]的公式计算
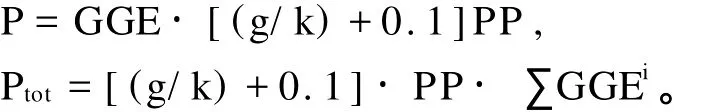
其中,P为微型浮游动物的次级生产力;Ptot为微型浮游动物群体总的生产力;i表示微型浮游动物间存在的营养级数;GGE为微型浮游动物总的生长效率,取其值为30%[12];g为微型浮游动物每天的摄食率;k为浮游植物每天的生长率;PP为浮游植物的初级生产力;而其中PP的计算方法如下[13]:
PP=k·Cm,
Cm=C0[e(k-g)t-1]/(k-g)t。
Cm为培养期间浮游植物的平均浓度,C0为浮游植物的初始浓度,t为稀释培养的时间(d)。
浮游植物的浓度用Chla浓度(μg/L)来表示。
2 结果
2.1 采样点的环境参数
各采样点的环境参数如表1。S1点水体叶绿素含量为6.28~15.02μg/L,S5点水体叶绿素含量为5.87~18.43μg/L,S9点水体叶绿素含量为5.19~15.02 μg/L。温度、盐度、p H、营养盐浓度各采样点之间变化不大。各采样点温度变化范围为16~28.5℃;盐度变化范围为28.00~30.32;p H变化范围为8.29~8.42。水体氨氮含量为21.75~36.00μg/L;硝态氮含量为10.23~49.75μg/L;活性磷含量为3.86~7.13μg/L。可以看出,在海蜇捕捞结束后,水体中叶绿素和营养盐浓度均随着水温的降低而显著下降。
2.2 微型浮游动物的数量与组成
微型浮游动物的数量与组成情况见表2。它的组成比较简单,在各采样点分布比较均匀,海蜇养殖期间微型浮游动物数量低于海蜇捕捞结束期。海蜇养殖期间微型浮游动物优势种为根状拟铃虫(Tintinnopsis radix),丰度为600~2 600 ind/L;海蜇捕捞结束后优势种为根状拟铃虫、诺氏麻铃虫(Leprotintinnus nordquisti)和运动类铃虫(Codonellopsis mobilis),丰度分别为3 000~6 000、1 500~3 000、1 500~3 000 ind/L。桡足类幼体数量较少,为4~18 ind/L。

表1 实验期间环境参数Table 1 Environmental parameters during the experiment

表2 稀释采样点微型浮游动物的丰度(ind/L)与组成Table 2 Abundance(ind/L)and types of the microzooplankton at the dilution incubation stations
2.3 稀释实验结果
稀释实验结果如图2和表3所示。8月21日S1、S5点实验失败,浮游植物的生长率k值为负值。S1点浮游植物的生长率k值为0.30~1.03 d-1;摄食率g为0.39~2.37 d-1,对浮游植物现存量的摄食压力为32.23%~90.61%,对潜在初级生产力的摄食压力为77.08%~313.61%。S5点浮游植物的生长率k值为0.21~0.88 d-1;摄食率g值为0.39~1.88 d-1,对浮游植物现存量的摄食压力为31.96%~84.71%,对潜在初级生产力的摄食压力为105.31%~222.94%。S9点浮游植物的生长率k值为0.05~0.90 d-1;摄食率g值为0.24~1.48 d-1,对浮游植物现存量的摄食压力为21.10%~77.28%,对潜在初级生产力的摄食压力为102.70%~583.68%。
2.4 微型浮游动物生产力
依照文献[11]的计算公式,S1点微型浮游动物生产力占浮游植物生产力的比例为22.92%~52.87%,S5点为35.66%~76.92%,S9点为34.33%~52.68%(见表3)。

图2 稀释实验回归方程Fig.2 Regression of the dilution experiment

表3 稀释实验的结果和微型浮游动物的次级生产力占初级生产力的百分比Table 3 Result of the dilution experiments and microzooplankton production as a percentage of daily primary production
3 讨论
3.1 海蜇养殖港塭叶绿素a的变动与浮游动物的丰度
叶绿素a含量随时间变化明显,从8月到9月逐渐升高,于9月6日达到最高,之后逐渐降低,这可能与水温、营养盐浓度和光照时间长短等随时间的变化有关。从平面分布来看,S1、S5、S9点叶绿素a含量有所差异。在海蜇养殖期间,位于港塭中央的S5点叶绿素a含量最高,而靠近入水口的S1点和靠近出水口的S9点叶绿素a含量相对较低,分析其原因,这与海蜇摄食和营养盐分布有关:由于外海区营养盐含量较低,导致海水中叶绿素a含量偏低,而进水口进来的是外海水,且水流速度较快,因此靠近进水口的S1点叶绿素a含量较低;相对于进水口,港塭中央水流速度较慢,浮游植物有充足的营养盐繁殖,同时海蜇的摄食控制了浮游动物的数量,因此位于港塭中央的S5点叶绿素a含量较高;而出水口水流速度较快,浮游植物的生长率低于微型浮游动物的摄食率,因此位于出水口的S9点叶绿素a含量也低于港塭中央。本研究结果与沈锦兰等报道的厦门杏林虾池叶绿素a分布结果不太一致[14],推测其原因可能与虾池因大量投饵产生的残饵和生物排泄物容易积累,使进水区至出水区营养盐含量逐渐升高,导致浮游植物生长率逐渐升高有关。
本研究发现海蜇养殖港塭微型浮游动物丰度在0~9 000 ind/L之间,同其它海区微型浮游动物丰度相比处于较高水平[15],可能与海蜇养殖港塭营养盐含量高于外海,浮游植物大量繁殖有关。而桡足类幼体丰度为4~18 ind/L,同张武昌等在渤海的结果相比处于较低水平[16],则可能与海蜇对桡足类的大量摄食有关。对比海蜇养殖期及捕捞结束期微型浮游动物丰度,可以看出,尽管存在着温度等方面的差异,海蜇养殖期中微型浮游动物丰度仍明显小于捕捞结束期,说明因海蜇对微型浮游动物摄食,对其控制作用显著。
对比研究期间海蜇养殖港塭叶绿素a浓度和微型浮游动物丰度的变动情况,可以发现二者有一定联系,但关联不紧密。分析其中的原因,可能在于两方面:一是水体中中型浮游动物对浮游植物摄食的影响,二是实验期间温度、营养盐变动对浮游植物生长繁殖的影响。
3.2 海蜇养殖港塭微型浮游动物的摄食压力
稀释实验有3点假设:1)现场浮游生物的生长呈指数关系;2)浮游植物生长率呈非密度制约,即浮游植物生长不会受营养盐的限制;3)微型浮游动物对浮游植物的摄食率呈非密度制约,即在不同稀释度下微型浮游动物摄食率不会发生变化[6]。然而,由于不同海区环境因子、浮游植物和微型浮游动物群落组成是有差异的,因此对以上3个假设的符合程度是不一样的。考虑到模拟方法与现场环境存在一定的差异,本研究的稀释实验是在现场水体中进行的,因此能真实地模拟现场环境,成功率较高。
在海蜇养殖期间,浮游植物的生长率为0.05~1.03 d-1,平均值为0.55 d-1;微型浮游动物的摄食率为0.24~2.37 d-1,平均值为1.06 d-1。海蜇捕捞结束后,浮游植物的生长率为0.21~0.90 d-1,平均值为0.39 d-1。微型浮游动物的摄食率为0.39~1.48 d-1,平均值为0.67 d-1。可以看出,海蜇养殖期间浮游植物生长率要高于海蜇捕捞结束期,这可能与海蜇养殖期间水温、营养盐浓度以及光照时间均高于海蜇捕捞结束期有关。而海蜇养殖期间微型浮游动物的摄食率明显高于海蜇捕捞结束期,则可能与海蜇养殖期水温高、微型浮游动物生物量大有关。
在整个研究期间,海蜇养殖港塭浮游植物的生长率为0.05~1.03 d-1,平均值为0.48 d-1;微型浮游动物的摄食率为0.24~2.37 d-1,平均值为0.88 d-1,可见该港塭具有低生产率、高周转率的特点,微型浮游动物的摄食控制了浮游植物的生长。该港塭微型浮游动物对浮游植物现存量摄食压力为21.10%~90.61%,对潜在初级生产力的摄食压力为77.08%~583.68%,平均值分别为51.50%和189.97%,与表4所列举的其它海区稀释实验数据相比,处于较高水平。这可能有2个原因:一是因为各采样点浮游植物生长率较低,而微型浮游动物的摄食率相对较高[8],例如8月6日S1、S9采样点浮游植物生长率都很低,而微型浮游动物的摄食率却相对比较高,所以微型浮游动物对浮游植物现存量和初级生产力的摄食压力很高,甚至出现了最大值。二是因为海蜇养殖港塭是半人工生态系统,受人为干扰较多,造成海蜇养殖港塭生态系统与自然海区相比存在一定的差异。该港塭微型浮游动物次级生产力占浮游植物初级生产力的比例范围为22.92%~76.92%,平均值为46.93%,与台湾海峡的数据比较一致[18],也充分说明了微型浮游动物在海蜇养殖港塭能量传递过程中起着重要作用。

表4 不同海区微型浮游动物对浮游植物的摄食压力Table 4 Results of microzooplankton grazing experiments conducted in various oceanic environments from studies employing the dilution technique
3.3 微型浮游动物在海蜇养殖港塭能流、物流中的作用
作为生态系统的重要组成部分,微型浮游动物具有重要的生态功能。微型浮游动物是浮游植物的主要摄食者,微型浮游动物对浮游植物具有潜在的强大的摄食压力。它可以消耗0%~75%的浮游植物现存量[17],对初级生产力的摄食压力甚至可以超过100%[7]。其次,大中型浮游动物摄食的颗粒较大,但水体中>20μm的浮游植物很少,<20μm的微型藻类占浮游植物现存量的绝大部分。研究表明,大中型浮游动物摄食的浮游植物不能满足其代谢的需要,还需要摄食其它的食物,而微型浮游动物则是大中型浮游动物的重要食物来源之一[26],微型浮游动物摄食微型浮游植物,自身却可能成为大中型浮游动物的食物,从而将大中型浮游动物不能利用的微型、超微型浮游生物输送到较高营养级,在生态系统的能量传递中起着重要的营养连接作用。虽然微型浮游动物在海洋生态系统中这种重要的生态作用已早为大家所认识,但以往相关的研究却主要集中在海湾、海峡或大洋等开放的自然海域,关于海蜇养殖港塭中微型浮游动物的摄食和生产力研究还少见报道。海蜇养殖港塭生态系统介于池塘和开放海区之间,属于受人为干扰的半人工生态系统。在这个生态系统中,海蜇是目的养殖动物,其产量主要通过港塭自身以及水交换进入的天然饵料获得。微型浮游动物是海蜇的直接食物来源之一,同时又被中型浮游动物所食,间接将能量传递到海蜇,因此微型浮游动物在这个系统中具有重要的生态作用。本研究表明,微型浮游动物对浮游植物现存量的摄食压力为21.10%~90.61%,对潜在初级生产力的摄食压力为77.08%~583.67%。同时,至少有22.92%~76.92%的初级生产转换为微型浮游动物自身的生产力,充分说明了微型浮游动物在海蜇养殖港塭生态系统中能量传递过程中扮演着重要的角色。不过,关于初级生产力通过这条途径传递至中型浮游动物以及海蜇的数量,则还取决于中型浮游动物和海蜇对小型浮游动物的摄食选择性及摄食压力,这是今后需要进一步加强研究的内容,从而正确认识该系统中能量、物流流动结构,为海蜇的科学养殖提供理论依据。
[1] Dussart B M.Les differentes categories de plankton[J].Hydrobiologia,1965,26:72-74.
[2] Gifford D J,Dag M J.The microzooplankton-mesozooplanktom link:consumption of the planktonic protozoa by the calanoidAcartia tonsaDana andNeocalanus plumchrusMurukawa[J].Mar Micro Food Webs,1991(5):161-177.
[3] 曾祥波,黄邦钦.台湾海峡微型浮游动物的摄食压力及其对营养盐再生的贡献[J].厦门大学学报:自然科学版,2007,46(2):231-235.
[4] 王真良.黄海区水母类的生态研究[J].黄渤海海洋,1996,14(1):41-50.
[5] 农业部渔业局.中国渔业统计年鉴[M].北京:中国农业出版社,2007.
[6] Landry M R,Hassett R P.Estimating the grazing impact of marine micro-zooplankton[J].Marine Biology,1982,67:283-288.
[7] 张武昌,王荣.海洋微型浮游动物对浮游植物和初级生产力的摄食压力[J].生态学报,2001,21(8):1360-1368.
[8] 孙军.春季赤潮频发期东海微型浮游动物摄食研究[J].应用生态学报,2003,14(7):1073-1080.
[9] 国家海洋局.海洋调查规范[M].北京:海洋出版社,1992.
[10] Verity P G,Stoecker D K,Sieracki M E,et al.Grazing growth and mortality of microzooplankton during the 1989 North Atlantic spring bloom at 47 N,18 W[J].Deep-Sea Res,1993,40:1793-1814.
[11] Landry M R,Calbet A.Microzooplankton production in the oceans[J].Journal of Marine Science,2004,61:501-507.
[12] Straile D.Gross growth effiencies of protozoan and metazoan zooplankton and their dependence on food concentration,predatorprey weight ratio,and taxonomic group[J].Limnology and Oceanography,1997,42:1375-1385.
[13] Landry M R,Constantinou J,Latasa M,et al.Biological response to iron fertilization in the eastern equatorial Pacific(Iron Ex II)III.dynamics of phytoplankton growth and microzooplankton grazing[J].Marine Ecology Progress Series,2000,201:57-72.
[14] 沈锦兰,林元烧,杨圣云,等.厦门杏林虾池夏冬季微型浮游动物对浮游植物的摄食压力[J].台湾海峡,2002,21(1):31-36.
[15] 张武昌,肖天,王荣.海洋微型浮游动物的丰度和生物量[J].生态学报,2001,21(11):1893-1908.
[16] 张武昌,王荣.渤海微型浮游动物及其对浮游植物的摄食压力[J].海洋与湖沼,2000,31(3):252-258.
[17] Zhang L,Sun J,Liu D,et al.Studies on growth rate and grazing mortality rate by microzooplankton of size-fractionated phytoplankton in spring and summer in the Jiaozhou Bay,China[J].Acta Oceanologlca Sinica,2005,24(2):85-101.
[18] 曾祥波,黄邦钦.台湾海峡南部夏季微型浮游动物对浮游植物的摄食压力及其生产力[J].台湾海峡,2006,25(1):1-9.
[19] 王学峰,李纯厚,贾晓平,等.大亚湾冬春季微型浮游动物摄食研究[J].海洋环境科学,2006,25(1):44-47.
[20] 苏强,黄良民.三亚湾珊瑚礁海区微型浮游动物种群组成和摄食研究[J].海洋通报,2008,27(2):28-36.
[21] Peter G,Verity P,Wassmann M E,et al.Grazing of phytoplankton by microzooplankton in the Barents Sea during early summer[J].Journal of Marine Systems,2002,38:109-123.
[22] Burkill P H,Edwards E S,Sleigh M A.Microzooplankton and their role in controlling phytoplankton growth in the marginal ice zone of the Bellingshausen Sea[J].Deep-Sea Research,1995,42:1277-1290.
[23] Verity P G,Stoecker D K,Sieracki M E,et al.Microzooplankton grazing of primary production in the equatorial Pacific[J].Deep-Sea Research II,1996,43(4-6):1227-1256.
[24] Murrell M C,Hollibaugh JT.Microzooplankton grazing in northern San Francisco Bay measured by the dilution method[J].Aquat Microb Ecol,1998,15:53-63.
[25] Froneman P W,Perissinotto R.Microzooplankton grazing and protozooplankton community structure in the South Atlantic and in the Atlantic sector of the Southern Ocean[J].Deep-Sea ResⅠ,1996b,43:703-761.
[26] Pierce R W,Turner J T.Ecology of planktonic ciliates in marine food webs[C].Review Aquatic Sciences,1992,6:139-181.
Preliminary Study on the Microzooplankton Grazing and Productivity in Jellyfish Pond in Jinghai Bay
ZHANG Kai1,TIAN Xiang-Li1,DONG Shuang-Lin1,FENGJian-Xiang1,SUN Zhen-Long1,GONG Hai-Ning2
(1.Key Laboratory of Mariculture,Ocean University of China,Qingdao 266003,China;2.College of Life Science and Technology,Dalian Ocean University,Dalian 116023,China)
The phytoplankton growth,the microzooplankton grazing rates,the grazing pressure on phytoplankton standing stocks and the grazing pressure on potential primary productivity were investigated by the dilution method in jellyfish pond in Jinghai Bay from August to October in 2009.The results showed that the microzooplankton were mainly composed ofTintinnopsis radixduring the culturing season,and its abundance was from 600 to 2600 ind/L.While the microzooplankton were mainly composed ofTintinnopsis radix,Leprotintinnus nordquistiandCodonellopsis mobilisafter the fishing season,and the abundance of them was from 1500 to 6000 ind/L.The growth rates of the phytoplankton varied from 0.05 to 1.03 d-1.The grazing mortality rates ranged from 0.24 to 2.37d-1.The grazing pressure of the microzooplankton on phytoplankton standing stocks and potential primary productivity varied from 21.10%to 90.61%and 77.08%to 583.68%,respectively.The secondary productivity of the microzooplankton as a percentage of daily primary productivity was 22.92%to 76.92%.These results indicated that the microzooplamkton played an important role in energy flux and material flow in the ecosystem of the jellyfish pond.
jellyfish pond;microzooplankton;grazing;dilution method;productivity
S967.4
A
1672-5174(2011)04-061-08
国家十一五科技支撑计划项目(2006BAD09A01,2006BAD09A06);国家高技术研究发展计划项目(2006AA10Z409)资助
2010-02-22;
2010-04-14
张 凯(1984-),男,硕士。E-mail:a2033236@163.com
**通讯作者:E-mail:xianglitian@ouc.edu.cn
责任编辑 于 卫
