芦荟大黄素在单壁碳纳米管修饰电极上的电化学行为及分析应用
2011-01-06段连生张蕾
段连生,张蕾
(湖北第二师范学院化学与生命科学系,湖北 武汉430205)
芦荟大黄素在单壁碳纳米管修饰电极上的电化学行为及分析应用
段连生,张蕾
(湖北第二师范学院化学与生命科学系,湖北 武汉430205)
研究芦荟大黄素(AE)在单壁碳纳米管修饰玻碳电极(SWNTs/GCE)上的电化学行为.结果表明SWNTs/GCE对 AE具有良好的电催化性能.在9.0×10-9~4.4×10-6mol·L-1范围内,其差分脉冲伏安法(DPV)峰电流与AE的浓度呈良好的线性关系,检测限为5.0×10-9mol·L-1,可用于药物制剂中AE的定量测定.
芦荟大黄素(AE);单壁碳纳米管;修饰玻碳电极;循环伏安法;差分脉冲伏安法
自从1991年Iijima[1]通过透射电镜(TEM)发现碳纳米管(CNTs)以来,由于其特殊的结构、机械、电子和化学性质[2],CNTs已经成为化学、物理以及材料领域研究的热点课题.CNTs的原子结构使其表现出金属或半导体的性质[3-5],因此其可作为电极的修饰材料用以加速电子传递反应的速率[6-7].研究表明,CNTs修饰电极可以加快一些重要生命物质包括细胞色素C[8]、过氧化氢[9]以及儿茶酚胺如多巴胺[10]、肾上腺素[11]和抗坏血酸[12]的电催化反应.
芦荟大黄素(AE)又称芦荟泻素,它广泛存在于百合科芦荟,豆科决明子,蓼科植物大黄中,具有抗菌、消炎、杀虫、抗癌、抗衰老等功效[13],芦荟大黄素的测定方法已报道的有:高效液相色谱法[14],薄层扫描法[15],分光光度法[16],极谱法[17],碳糊电极上的吸附催化伏安法[18].芦荟大黄素分子中的蒽醌结构具有电化学活性[19],在良好质子源体系中存在一个准可逆的双质子双电子转移过程[20],利用该电化学特性可实现对微量芦荟大黄素的测定.本文中研究了芦荟大黄素在修饰玻碳电极上的电化学性质,建立了其含量测定的差示脉冲伏安法,该方法灵敏度高,重现性好,可直接测定大黄素药材中芦荟大黄素含量.
1 实验部分
1.1 仪器与试剂电化学工作站CHI 660C(上海辰华仪器公司,中国上海),三电极系统:SWNTs修饰玻碳电极(SWNTs/GCE)或裸GCE为工作电极,铂丝电极为对电极,饱和甘汞电极为参比电极(SCE);超声波清洗仪(BRANSON2000,美国);320-S酸度/离子计(瑞士).
芦荟大黄素购于上海晶纯试剂有限公司(中国上海);阿坝马蹄黄掌叶大黄药材,市售.SWNTs购于中科院成都有机所(中国成都).使用前SWNTs按如下方法进行纯化处理:将SWNTs于3mol·L-1的HNO3中超声振荡1h,然后在110℃下的5mol·L-1的HCl中回流4h.经过酸处理后的SWNTs在静态空气中,350℃下焙烧2h后备用.取1.0mg纯化后的SWNTs加入到1.0mL的N,N-二甲基甲酰胺(DMF)中超声振荡得到1.0mg·mL-1的黑色悬浮液.其他试剂均为分析纯.实验用水均为二次去离子水.
1.2 SWNTs修饰电极的制备首先用金刚砂纸细磨GCE后,再用0.05μm粒度的α-Al2O3悬浮液在抛光布上抛光成镜面,然后依次在水、乙醇、水中超声波震荡清洗.将10μL分散在DMF中的SWNTs黑色悬浮液滴加在干净GCE上,在空气中放置12h使溶剂挥发,制备成了SWNTs/GCE.
采用1mmol·L-1的K3Fe(CN)6作为电化学探针分子,用循环伏安法在不同扫速下分别测量SWNTs修饰电极和裸电极的微观面积,对于可逆反应;ipa=2.69×105n3/2AC0DR1/2υ1/2[21],方程式中:ipa为氧化峰电流,n为电子转移数,A为电极面积,DR为扩散系数,C0为溶液中电活性物质的浓度,υ为扫描速度.已知K3Fe(CN)6的n=1,DR=5.90×10-5cm2·s-1(0.1mol·L-1KCl),由ipa和υ1/2关系曲线的斜率计算出裸玻碳电极和SWNTs/GCE的表观面积分别为0.050 3cm2,0.214cm2,修饰后的电极表面积大约增加了3倍.
1.3 样品的提取将阿坝马蹄黄掌叶大黄素药材洗净后,在室温下干燥并且用搅拌机将其研细,按照文献[22]方法提取:取大黄药材细粉约0.1g,精密称定,置于25mL量瓶中,加入15mL甲醇,浸泡24h,加甲醇定容至25mL,超声处理10min,滤过,取一定量的提取液,加水定容至1 000mL,作为芦荟大黄素(游离型)样品测试液.
2 结果与讨论
2.1 芦荟大黄素在SWNTs/GCE上的循环伏安行为图1为不同电极上在含有1.0×10-5mol·L-1(图1a,c)或不含(图1b)AE的循环伏安曲线.在裸玻碳电极上AE出现一对可逆的氧化还原峰(图1a),氧化峰电位(Epa)和还原峰电位(Epc)分别为-0.508V 和-0.542V,峰电位之差ΔEp为34 mV.在PBS(pH=6.0)的空白溶液中,SWNTs/GCE没出现任何氧化还原峰(图1b),但其背景电流远大于裸玻碳电极,这是SWNTs修饰到电极表面,有效地增加了电极的表面积所致.当空白底液中加入1.0×10-5mol·L-1AE后,出现一对明显可逆的氧化还原峰(图1c),氧化峰电位为-0.466V,还原峰电位为-0.532V,ΔEp为66mV,氧化峰电流(ipa)与还原峰电流(ipc)之比约为1,修饰后的电极峰电流大约增大4.6倍,大于电极面积增加的3倍数,这表明SWNTs修饰电极不仅增大了电极的有效表面积,而且对AE的氧化还原具有电催化作用.这可能是由于碳纳米管的纳米尺寸,以及在碳纳米管表面的电子结构和拓扑缺陷所致,可以加速芦荟大黄素与电极表面之间电子的传递,从而显著增加了氧化还原峰电流,提高了芦荟大黄素电化学测定检测限.

图1 芦荟大黄素在不同电极上循环伏安对比图
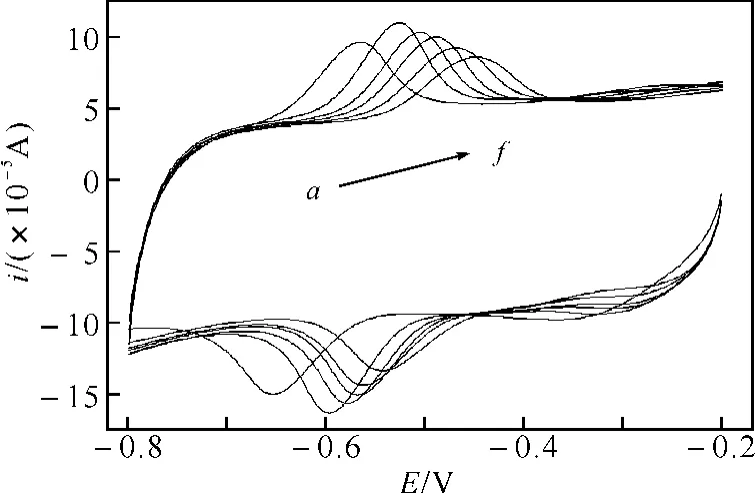
图2 芦荟大黄素在不同pH值条件下的循环伏安曲线
2.2 pH值的影响图2所示,pH在4.0~7.0范围内,随着pH的增加,峰电流先增大后减小.在pH=6.0时,峰电流达到最大值,因此,实验中选择pH=6.0为最佳pH.
2.3 扫速的影响图3A所示,在扫速范围0.05~0.40V·s-1内,随着扫速的增加,AE的氧化峰和还原峰电流均逐渐增大.图3B所示,峰电流与扫描速率呈良好的线性关系,线性回归方程分别为:ipa=3.04×10-5+3.65×10-4υ,r=0.993;ipc=-2.85×10-5-4.92×10-4υ,r=0.996(ip:A,υ:V·s-1),表明 AE在SWNTs修饰电极上的氧化还原是一个吸附控制过程.

图3 芦荟大黄素不同扫速下的循环伏安图
2.4 富集电位和富集时间的影响AE在SWNTs/GCE上的电化学反应是一个吸附控制过程,采用DPV对其的定量检测时,富集电位和富集时间将会对其电化学响应有较大影响.图4A所示,当富集电位从-0.20V变化到-0.60V时,峰电流逐渐增大,在-0.45V时峰电流达到最大值,此后峰电流开始减小,因此-0.45V被选为最佳的富集电位.在-0.45V的最佳富集电位下,当AE浓度为1.0×10-5mol·L-1时,随着富集时间的增加,峰电流逐渐增大,在富集时间达到150s后峰电流几乎不再增大,图4B所示.这可能是由于富集一定时间后AE在SWNTs/GCE上达到吸附平衡,故实验中选择富集时间为150s.
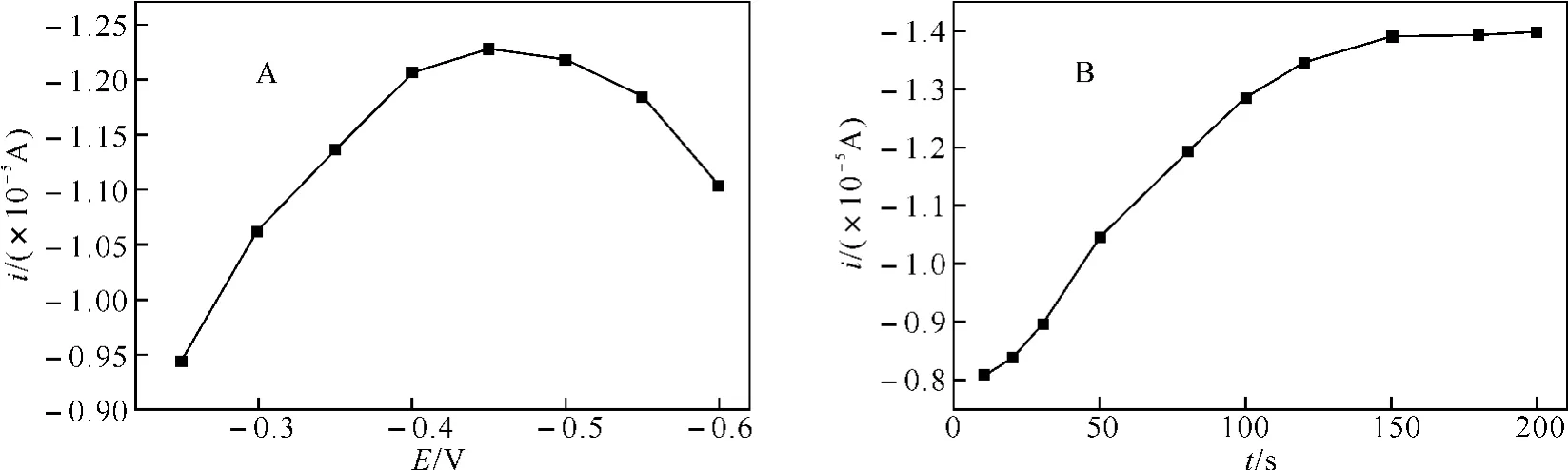
图4 芦荟大黄素在SWNTs/GCE电极上峰电流与富集电位和富集时间的关系
2.5 线性范围与检测限,电极的重现性和稳定性图5所示,在最佳实验条件下,采用DPV法进行测试,结果表明,在9.0×10-9~4.4×10-6mol·L-1浓度范围内,还原峰电流与芦荟大黄素浓度呈良好的线性关系,其线性回归方程为:ipc(×10-4A)=2.045×10-5+54.29C(×10-6mol·L-1),线性相关系数r=0.998(n=16),检测限为5.0×10-9mol·L-1(S/N=3).
采用DPV研究了SWNTs/GCE的重现性和稳定性.在0.1mol·L-1的PBS(pH=6.0)溶液中,对浓度为1.0×10-5mol·L-1的芦荟大黄素,用同一支修饰电极连续测定6次,还原峰电流的相对标准偏差为3.7%.将修饰电极放置于冰箱中保存,2周后测定上述溶液,响应峰电流变为原电流的87.1%.实验结果表明该SWNTs/GCE修饰电极具有很好的重现性及稳定性.
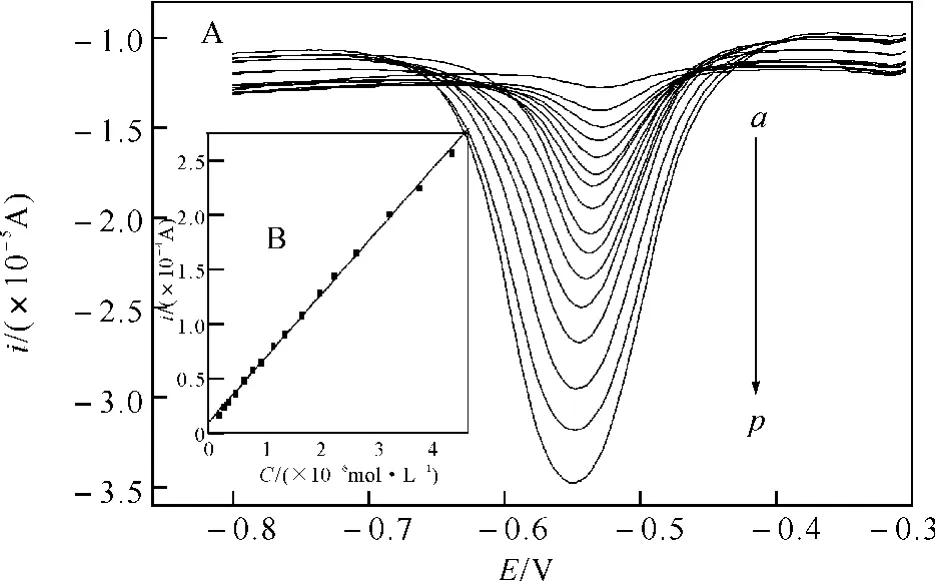
图5 不同浓度芦荟大黄素的DPV曲线及线性关系
2.6 实际样品的测定及方法回收率采用此方法测定了本文中2.3所提取测试液中大黄素药材芦荟大黄素的含量,测得其平均结果为(1.37±0.08)mg·g-1(n=6),与高效液相色谱法[22]测定的(1.26±0.06)mg·g-1的结果相一致.采用加标回收法对AE测试样品进行测定,回收率在94.0%~102.6%之间(表1).表明该方法可用于实际样品的测定.
2.7 干扰实验对浓度为1.0×10-6mol·L-1的芦荟大黄素溶液进行干扰试验,实验结果表明:200倍常见阳离子 K+、Na+、NH4+、Ca、Mg2+和常见阴离子F-、Cl-、Ac-、SO42-、NO3-;100倍的Zn2+、Mn2+、Cu2+、Si4+和50倍的多巴胺(DA),抗坏血酸(AA),尿酸(UA)以及10倍的芦荟甙对测定均无干扰.

表1 芦荟大黄素样品的加标回收测定
3 结论
本文中选取SWNTs为修饰材料,制备了SWNTs修饰玻碳电极(SWNTs/GCE),研究了AE在该修饰电极上的电化学行为.结果表明SWNTs对AE的氧化还原具有良好的电催化效应.在最佳的实验条件下,采用DPV直接测定芦荟大黄素含量,检测限可达5.0×10-9mol·L-1.该方法简便、快速、灵敏度高,是一种灵敏度很高的痕量分析方法.
[1]Iijima S.Helical microtubles of graphictic carbon[J].Nature,1991,354(3):56-58.
[2]Ajayan P M.Nanotubes from carbon[J].Chem Rev,1999,99(7):1787-1799.
[3]Odom T W,Huang J L,Kim P,et al.Atomic structure and electronic properties of single-walled carbon nanotubes[J].Nature,1998,391(6662):62-64.
[4]Tekleab D,Czerw R,Carroll D L,et al.Electronic structure of kinded multiwalled carbon nanotubes[J].Appl Phys Lett,2000,76(24):3594-3596.
[5]Jang J W,Lee D K,Lee C E,et al.Metallic conductivity in bamboo-shaped multiwalled carbon nanotubes[J].Solid State Commun,2002,122(11):619-622.
[6]Nugent J M,Santhanam K S V,Rubio A,et al.Fast electron transfer kinetics on multi-walled carbon nanotube microbundle electrodes[J].Nano Lett,2001,1(2):87-91.
[7]Davis J J,Cole R J S,Hill H A O.Protein electrochemistry at carbon nanotube electrode[J].J Electroanal.Chem,1997,440(1/2):279-282.
[8]Nugent J M,Santhanam K S V,Rubio A,et al.Fast electron transfer kinetics on multiwalled carbon nanotube microbundle Electrodes[J].Nano Lett,2001,1(2):87-91.
[9]Luo H,Shi Z,Li N,et al.Investigation of the electrochemical and electrocatalytic behavior of single-wall carbon nanotube film on a glassy carbon electrode[J].Anal Chem,2001,73(5):915-920.
[10]Wang J,Li M,Shi Z,et al.Direct electrochemistry of cytochrome c at a glassy carbon electrode modified with single-wall carbon nanotubes[J].Anal Chem,2002,74(9):1993-1997.
[11]Musameh M,Wang J,Merkoci A,et al.Low-potential stable NADH detection at carbon nanotube-modified glassy carbon electrodes[J].Electrochem Commun,2002,4(10):743-746.
[12]Davis J J,Coles R J,Hill H A O.Protein electrochemistry at carbon nanotube electrode[J].J Electroanal Chem,1997,440(1/2):279-282.
[13]Lee H Z,Hsu S L,Liu M C,et al.Effects and me chanis msofaloee modinoncell deathinhum anlun gs quamous cell carcinoma[J].Eur J Pharmacol,2001,23:287-295.
[14]郭华,侯冬岩,回瑞华,等.RP-HPLC法同时测定芦荟汁中芦荟苷和芦荟大黄素的含量[J].生命科学仪器,2006,4(4):32-33.
[15]邓郁琼,覃文.薄层扫描法测定芦荟口服液中的芦荟大黄素[J].食品科学,1999,20(10):57-59.
[16]齐登福.荧光光度法测定中药芦荟大黄素[J].山东工程学院学报,2002,16(2):5-8.
[17]邹洪,袁倬斌.芦荟大黄素的电化学研究[J].分析测试学报,1997,16(6):61-63.
[18]黎拒难,高朋,李湘玲.芦荟大黄素在碳糊电极上的吸附催化伏安法研究[J].中国科学(B辑),2005,35(1):38-43.
[19]邹洪,袁倬斌.芦荟大黄素的电化学研究[J].分析测试学报,1997,16(6):61-631.
[20]林新华,黄丽英,陈伟,等.芦荟大黄素1.5阶微分阳极溶出伏安法测定及电化学性质研究[J].电化学,2001,7(4):487-493.
[21]Bard A J,Fanlkner L R.Electrochemical methods funda-mentals and applications.New York:Wiley,1980,258-259.
[22]张丹,蒋心惠.反相高效液相色谱法测定大黄药材中游离及结合型蒽醌类衍生物的含量[J].分析化学研究简报,2003,31(4):459-462.
Electrochemical behavior and analytical application of aloe-emodin to the bare glassy carbon electrode coated single-walled carbon nanotubes
DUAN Liansheng,ZHANG Lei
(Department of Chemistry and Life Science,Hubei University of Education,Wuhan 430205,China)
The electrochemical behaviors of aloe-emodin at Single-walled carbon nanotube modified bare glassy carbon electrode(SWNTs/GCE)had been investigated.The results showed that the SWNTs/GCE exhibited efficiently catalytic ability for aloe-emodin.The differential pluse voltammetry currents were linear with the concentration of aloe-emodin in the range of 9.0×10-9-4.4×10-6mol·L-1,and the detection limit was calculated to be 5.0×10-9mol·L-1.It could be used for the determination of aloe-emodin in pharmaceutical preparations.
aloe-emodin(AE);single-walled carbon nanotube;modified glassy carbon electrode;cyclic voltammetry;differential pluse voltammetry
O657.1
A
1000-2375(2011)04-0516-05
2011-04-20
湖北省教育厅重点科技项目(D20113004)资助
段连生(1964-),男,副教授,E-mail:dls027@sina.com
(责任编辑 胡小洋)
