水杉木材DNA提取及条形码分子鉴定
2011-01-06杨星宇杨路路余志伟杨建明
杨星宇,杨路路,余志伟,杨建明
(湖北大学生命科学学院,湖北 武汉430062)
水杉木材DNA提取及条形码分子鉴定
杨星宇,杨路路,余志伟,杨建明
(湖北大学生命科学学院,湖北 武汉430062)
通过对水杉不同年限及不同部位的木材DNA提取及片段扩增实验,结果显示改良后的CTAB(十六烷基三甲基溴化铵)法、SDS(sodium dodecyl sulfate)法及高盐低pH法均可以用于水杉木材DNA的提取,经过纯化后的木材DNA可以进行片段扩增.在提取木材DNA过程中,边材比心材更适合,所提取的DNA数量和质量更有保障;试验显示水杉木材DNA分子大多为23kbp.运用DNA条形码筛选分析、序列特征分析、遗传距离秩和检验、barcoding gap检验,进行木材DNA分子系列物种鉴定,结果表明序列ITS2、trnL-F比较适合其DNA条形码技术要求,可以作为水杉木材鉴定序列.
水杉;木材DNA提取;PCR;DNA条形码;十六烷基三甲基溴化铵
一直以来,木材的经典鉴定工作都是建立在木材形态学和解剖学的基础上,而由于在分类学中近缘物种的木材结构非常相似,这给木材的物种准确鉴定带来一些困难;如果木材可以用DNA分子检测手段进行鉴定,那么这不仅对木材种类识别非常有用,对考古学和古植物学等其他方面的应用也十分有意义.利用分子水平进行木材鉴定的报道目前尚不多见,这是因为木材DNA提取较困难.通常情况下,我们所说的木材指的是树木的次生木质部,它包括边材、心材、边材是贴近树皮较新的次生木质部部分,既有生活细胞(射线和薄壁细胞),又有死细胞(导管和纤维细胞),具有疏导和储藏作用;心材是次生木质部的内层,即早期的次生木质部,靠树干内较深的中心部分,养料和水份不容易进入,组织细胞多已衰老死亡;心材中射线组织或许也有生活细胞,但随着其与形成层距离的增加,其细胞内部结构已发生了许多变化,绝大多数细胞中没有发现细胞器或细胞核,因此边材、心材构成上的细胞差异,直接导致了不同部位的DNA含量不同,相应可以进行有效扩增的DNA片段长度也有所差异,心材中DNA分子片段长度较边材中的分子片段长度要短.对于生活树木的次生木质部而言,DNA在边材或心材中的提取相对来说都是比较容易的,但是,对于已砍伐加工的木材进行DNA提取相对就较困难,已加工的木材多数情况下树皮和边材部分已经失去,所利用的往往是心材部分,故而所含的DNA含量很少.虽然通常所言木材射线细胞、木薄壁细胞等都是生活细胞,从理论上讲提取DNA是完全可以进行的,但由于木材种类不同,所含次生代谢干扰物质不同,所以能成功有效提取DNA片段,也非易事.选择我国特有树种水杉作材料,一是因为该物种已有一些分子水平工作,可方便我们进行分子比对,二是还有一些炭化木、化石木等待我们去探索,方法技术上若突破,木材鉴定就会更多一手段,更多一项可信数据,准确鉴定种属就更多一些把握.
1 材料与方法
1.1 材料湖北大学校园栽培水杉(MetasequoiaglyptrobidesHu et Cheng),新鲜幼嫩芽叶、形成层木材;水杉的现生木材(2010年采自湖北大学校园);常温下保存半年的水杉木材(2009年采于湖北大学校园);常温下保存1年的水杉木材(2009年初采于湖北大学校园);常温下保存6年的水杉木材2份(2004年采于武汉市东湖医院,2004年采于荆州市万城);水杉阴沉木3份(1999年于湖北利川小河挖掘,常温保存于实验室).
1.2 仪器设备研磨器、水浴锅、通风厨、离心机、PCR仪(Eppondorf公司)、恒温振荡器(培英公司)、操净台(苏州净化设备厂)、精密电子天平、电泳仪(北京六一厂)、电泳槽(北京六一厂)、精密移液器(Eppondorf公司:2.5、20、100、1 000μL)、微波炉(美的)、分光光度计.
1.3 试剂配制CTAB、EDTA-Na2、NaCl、Tris碱、SDS、无水乙酸钠、PVP2000、浓 HCl、β-巯基乙醇、酒精、异丙醇、氯仿、异戊醇、醋酸钾、氢氧化钠、琼脂粉、6×Loading buffer、BM2000Markers.CTAB提取液(2%CTAB、0.1mol/L Tris-HCl(pH8.0)、0.02mol/L EDTA (pH8.0)、1.4mol/L NaCl;SDS提取液(0.1mol/L Tris-HCl(pH8.0)、0.05mol/L EDTA (pH8.0)、0.5mol/L NaCl、1.5%SDS);高盐低pH 法缓冲液(0.1mol/L NaAc、0.05mol/L EDTA (pH8.0)、0.5mol/L NaCl、2.5%PVP、3%SDS)[1-3].
1.4 水杉DNA的提取提取方法如下.
①在所需量的CTAB抽提液中加入2-疏基乙醇,使终浓度达2%(体积比)的CTAB提取液.将此溶液加热至65℃[3].
②将剪碎的水杉芽叶在液氮(-196℃)中充分研磨成细粉,取大约100mg此细粉于1.5mL离心管中,迅速加入6μL使终浓度为100μg/mL的蛋白酶K和500μL预热的CTAB提取液,上下颠倒混匀,于65℃温育30min,不时颠倒混匀.
③加等体积的苯酚,上下颠倒混匀,于4℃,8 000r/min离心6min,回收上相.
④加等体积的苯酚,上下颠倒混匀,于4℃,7 500r/min离心6min,回收上相.
⑤加等体积的氯仿/异戊醇(V/V24∶1),上下颠倒混匀,于4℃,7 000r/min离心6min,回收上相.
⑥加0.6倍体积的4℃预冷的异丙醇,上下颠倒混匀可见絮状沉淀,于4℃,2 000r/min离心12min.
⑦吸去上清液,加500μL 80%乙醇洗涤沉淀物,于4℃,2 000r/min离心5min.
⑧吸去上清液,晾干,加50μL TE溶解DNA.
优化后水杉的芽叶细胞、形成层细胞、射线细胞的DNA提取方法的不同点见表1.
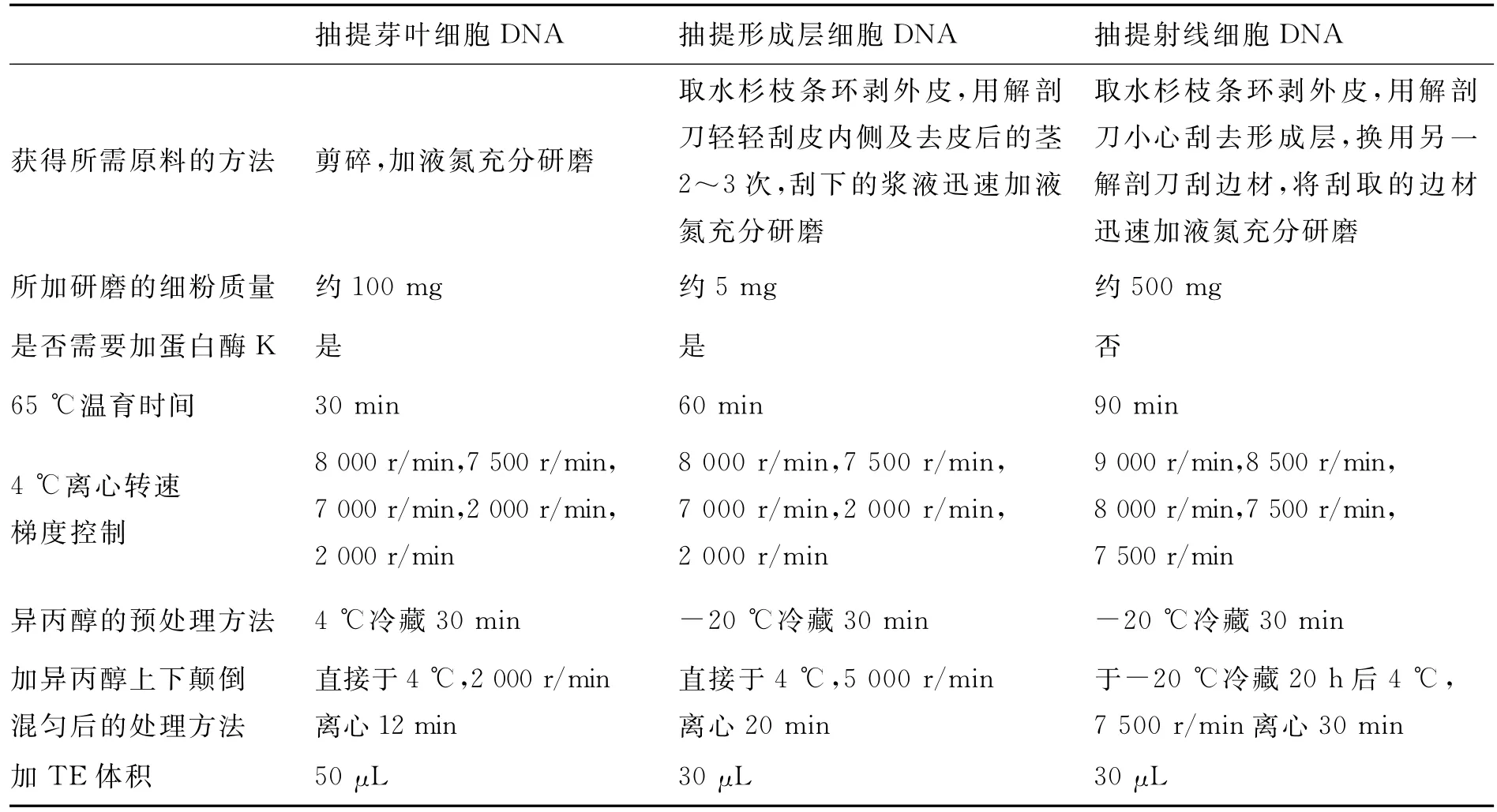
表1 水杉芽叶细胞、形成层细胞、射线细胞的DNA提取
1.5 水杉木材DNA片段PCR扩增及测序鉴定rbcL、MatK、TrnL-F、TrnL intro、ITS是植物系统学研究中常用到的DNA序列,且片段长度从1 000~300bp不等,有利于对不同片段长度扩增情况的分析,同时,这些片段也是当今植物条形码运用中,鉴定效果较好的片段;近年来,ITS2用于植物条形码分析较多,且对中药材的鉴别效率很高[4],故在PCR扩增中,我们加入ITS2序列.以上序列引物见表2.
1.5.1 PCR扩增 分别以各供试材料基因组DNA为模板,用上述引物、Taq DNA聚合酶进行PCR扩增,反应体系(25μL):约10ng模板 DNA,50ng/μL引物1μL;1UTaq聚合酶;10×Taq buffer 2.5μL,25mmol/L MgCl21.5μL和10×dNTPs 10mmol/L各0.625μL,用纯水补充至25μL.反应程序:94℃预变性5min;94 ℃ 30s、55℃ 1min、72℃1min,循环35次;72℃延伸10min.
1.5.2 数据处理
a)对测序原始序列进行处理和修改.首先切除杂乱碱基,用Vector NTISulte6软件的ContigexPress对序列进行拼接,最后,将序列在NCBI中进行BLAST搜索,进行鉴定.
b)将结果和已经登录NCBI的序列进行相似性比对,确定序列正确性;并将序列导入MEGA4.1软件进行多重序列比对,比对结果进行人工校对和调整,再进行序列分析及遗传距离的计算.
1.6 水杉木材DNA的浓度和纯度检测在紫外分光光度计上测定所提取的DNA样品OD260、OD280及它们的比值,检测所提取的 DNA纯度,DNA浓度(μg/mL)=(A260nm×稀释倍数)/(0.020×L);式中:A260nm为260nm波长处光吸收读数;L为比色皿的厚度,一般为1或0.5cm;0.020为每mL溶液中含1μg DNA钠盐时的光吸收,经0.8%琼脂糖凝胶在1×TAE缓冲系统下电泳,检验DNA提取情况.同时使用琼脂糖凝胶电泳检测DNA的量,用1.0%琼脂糖凝胶电泳,EB染色,经紫外荧光显示,观察DNA条带,将DNA的量与Marker谱带的强度进行比较(BM2000DNA Markers,点样5μL,亮度为50ng).

表2 引物序列
2 实验与分析
2.1 水杉木材不同部位的DNA提取及片段扩增取木材边材、心材部位的木材碎屑,进行DNA提取和比较,结果显示,在现生木材中,边材中有微弱的基因组DNA的条带,心材中DNA降解呈弥散状态;采自2004年的木材边材和心材中DNA都降解呈弥散状态(见图1).
同时,将不同部位取得的DNA进行ITS、rbcL、TrnL-F、ITS2、TrnL intro 5个片段的扩增,现生木材边材、心材中DNA虽有明显降解,但依然可以扩增出上述5个片段,2004年保存至今的木材,边材可以扩增出以上5个片段,但心材只能扩增出约750bp以下的片段(见图2).
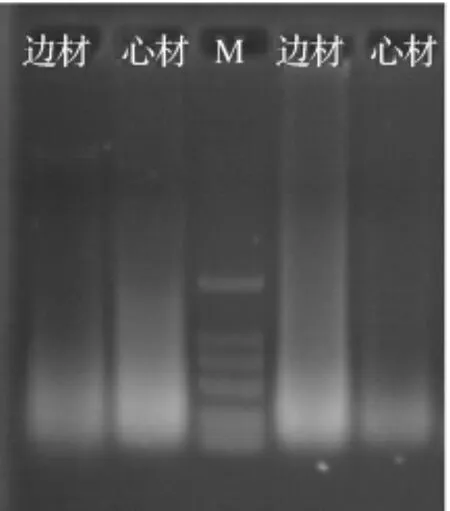
图1 不同部位DNA提取
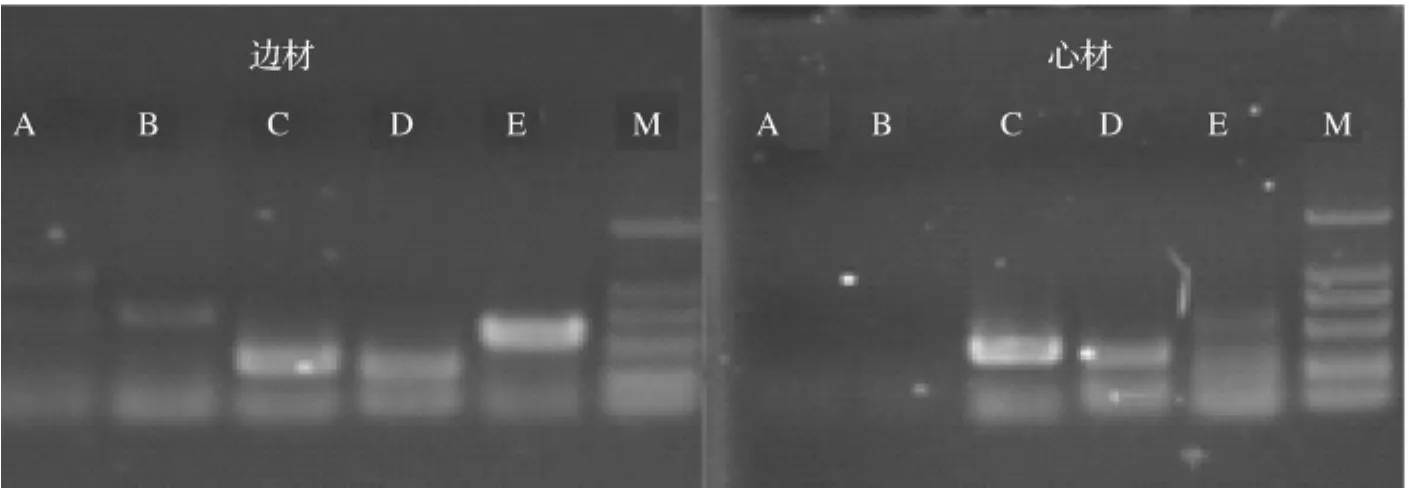
图2 保存6年木材DNA扩增
2.2 水杉不同部位获得DNA的浓度和纯度水杉3个部位获得的DNA浓度见表3,电泳结果见图3.

表3 水杉芽叶、形成层、射线细胞的DNA浓度

图3 水杉DNA电泳图
2.3 水杉木材不同保存年限不同DNA提取方法比较及片段扩增随着保存时间的延长,木材中DNA发生逐步的降解.通过对不同保存年限的水杉木材进行了3种不同方法DNA提取,结果见表4.
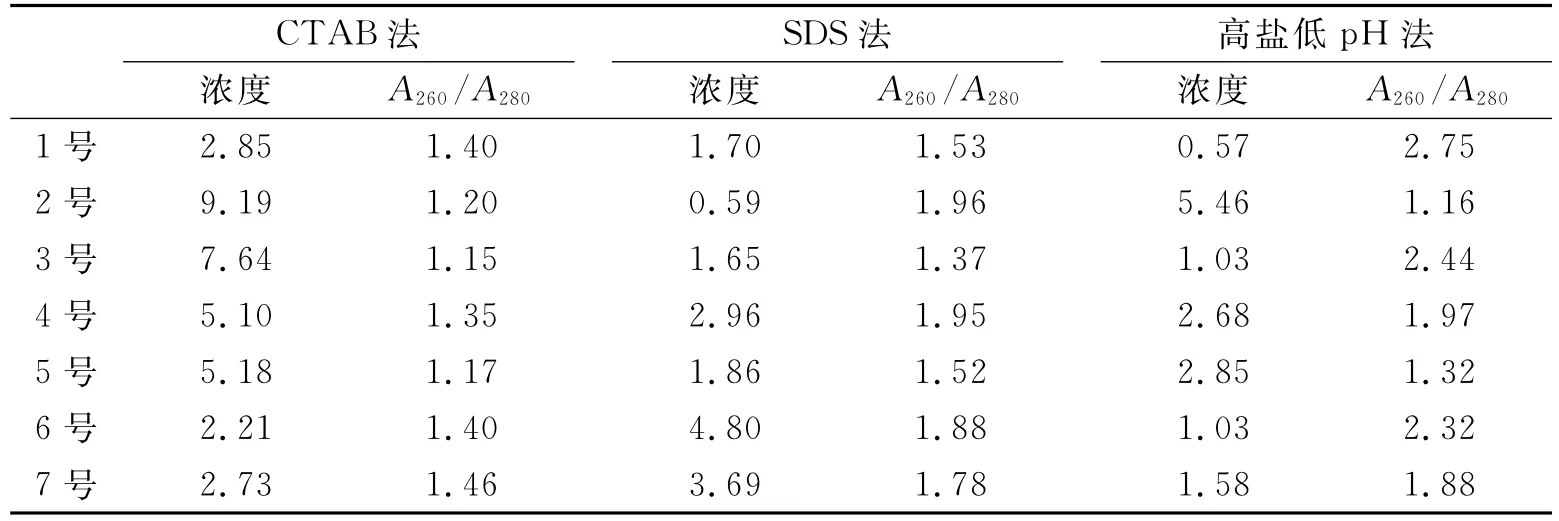
表4 不同保存年限木材DNA提取方法比较
表4中6号为常温放置1年的木材,在琼脂糖胶中3种方法均可以看到清晰的DNA条带,且DNAA260/A280值在1.40~2.32之间,质量较高.7号为放置2年的木材,在琼脂糖胶检测中也可以看到清晰的DNA含量,但是亮度小于半年木材,DNAA260/A280值在1.46~1.88之间,质量较高.4号、5号是2004年采集后常温放置至今的木材,从表中看到有一定的DNA浓度,且4号木提取的质量较高,但是用琼脂糖检测看不到明显的DNA条带,只是在500bp以下有降解的DNA存在.说明木材离开植株后在随着时间的增长而逐渐降解,六七年后虽然看不到DNA明显的条带,但是有降解的不同长度的片段.1号、2号、3号为1999年取自利川的水杉阴沉木,从琼脂糖凝胶检测中基本看不到有任何DNA的存在,但是,浓度检测有数值,且CTAB提取的2号、3号木材有较高的数值,由于2号、3号木材的DNA提取液呈黑褐色,所以,浓度的高数值有可能是杂质所致,不足以作为DNA浓度参考数值(见图4).
随着木材的保存年限增长,基因组DNA出现了明显的降解,在采伐后一两年内,依然可以提取到完整的基因组DNA,在这种情况下,片段长度超过1kb时仍然可以进行有效的扩增.对于采样5年以上的木材,基因组DNA降解情况已经十分严重,DNA提取检测中看不到明显的基因组条带,在序列扩增中保存6年的荆州万城的木材可以扩增出TrnL-F片段、ITS2片段以及TrnL intro片段等700bp以下的片段,而保存6年的采自东湖医院的木材仅可扩增出ITS2片段,虽然保存年限相同,但降解程度依然有差别.而对于年代更久的阴沉木而言,350bp的片段也无法扩增(见图5).
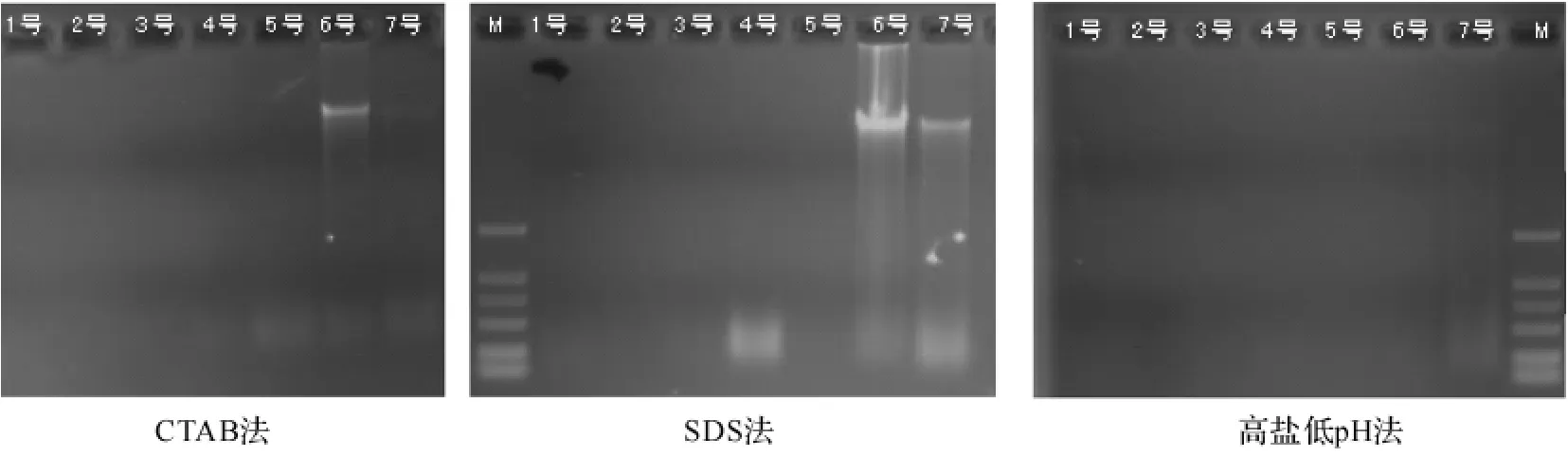
图4 不同保存年限木材不同DNA提取方法的比较编号与表4中编号相同
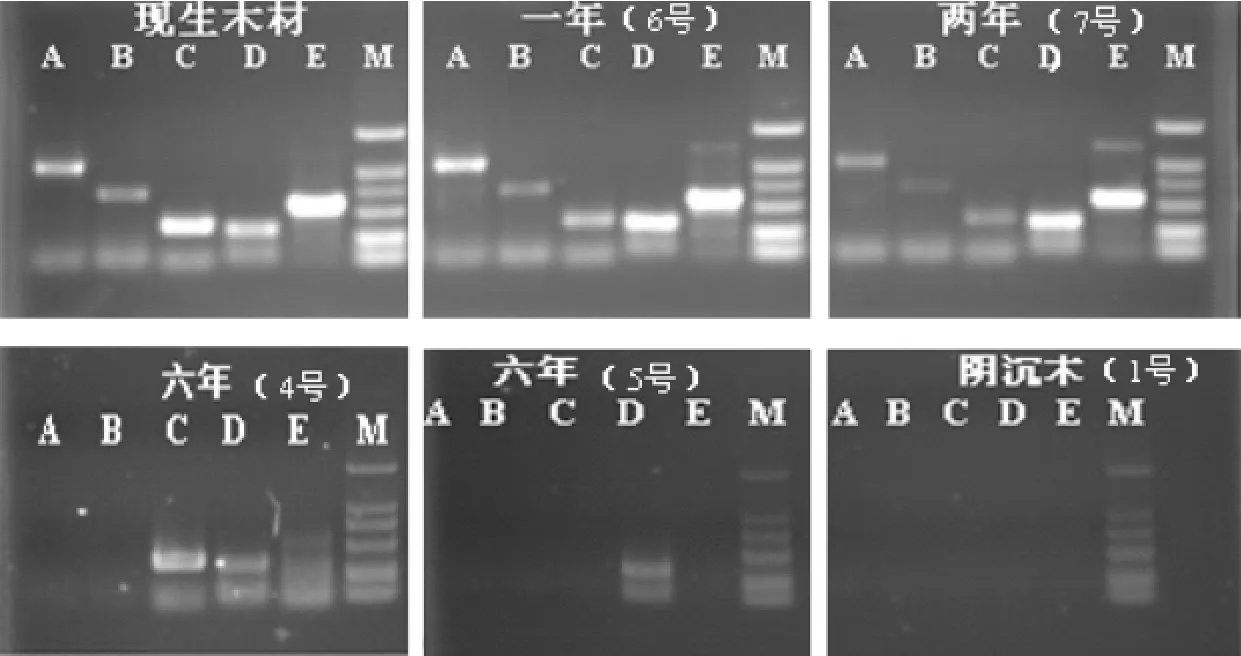
图5 放置不同时间的木材DNA PCR扩增
研究结果显示,现生木材DNA扩增获得的ITS序列与NCBI中水杉ITS序列的最大相似度(maxident)值为92%~94%;获得的rbcL序列与NCBI中水杉rbcL序列的最大相似度值为99%;获得的TrnL-F序列与NCBI中水杉TrnL-F序列的最大相似度值为92%~100%;获得的ITS2序列与NCBI中水杉ITS2序列的最大相似度值为97%,各序列均可准确指向鉴定;采自荆州万城的木材ITS2以最大相似度98%搜索到水杉,确认此木材为水杉;采自东湖医院的木材ITS2以最大相似度97%搜索到水杉,确认此木材为水杉.
3 结果与讨论
3.1 水杉木材DNA提取技法由于水杉芽叶的细胞、形成层细胞分裂旺盛,代谢很活跃,物质合成迅速,故细胞中DNA含量很高,这比较有利于DNA的抽提,但这些细胞中蛋白质含量又较高,即使用苯酚和氯仿抽提3次,电泳结果显示仍有较多蛋白质杂质(如图3,b),故需在DNA提取液中加蛋白酶K以降解蛋白质.而射线细胞中蛋白质含量低于前两者无须加蛋白酶K仍能获得较纯的DNA.在木材中,射线细胞是生活细胞,联通木质部和韧皮部,完成物质的横向运输.射线细胞数量比较少,细胞核DNA抽提比较不容易,其抽提的具体方法也与芽叶和形成层细胞有较大不同,主要体现在:①所加研磨的细粉质量要大于前二者,以提高DNA提取质量,保证在电泳中能显现DNA条带;②温育时间较长,使CTAB与DNA充分结合,提高DNA得率;③因为DNA浓度低于10μg/mL,加异丙醇沉淀后置于-20℃冷藏静置20h.方法的关键在于材料的研磨手法,对提取形成层细胞和射线细胞DNA尤为重要,是实验成败的关键;材料研磨得越细越好,水杉芽叶研磨时绿色明显变浅时表明已经研磨充分,而研磨形成层细胞和射线细胞时,当由刚开始的浅灰白色变为纯白色时表明已经研磨充分,这也主要是为了提高DNA的得率;在研磨过程中为了防止DNA酶降解DNA,还需不断及时添加液氮,另外异丙醇先用-20℃预冷30min再沉淀DNA效果较好.为了使电泳中显现DNA条带清晰,可在后续步骤中加等体积的氯仿/异戊醇(V/V24∶1),上下颠倒混匀,于4℃,7 000r/min离心6min,回收上相完成后将回收的上相四份合一,以提高DNA浓度.
3.2 不同年限的水杉木材DNA降解对于离体后保存不同年限的木材,随着常温保存时间的延长,木材中DNA发生了明显的降解,降解发生致使较大的片段无法进行扩增.对于同样保存6年的4号和5号木材而言,其扩增效果上的差异也有可能是木材的材质所致,4号木材料采自干燥环境中的生长树木,其木材细胞结构致密,这样的情况可能对其DNA起到一定的保护作用;而对于阴沉木而言,被埋藏时间是DNA降解的重要原因,同时因是埋藏于潮湿的环境中,致使大量杂质浸入细胞发生化学和物理反应,也是造成其DNA降解的直接原因,另外阴沉木中所含杂质在DNA提取过程中难以有效去除,此对PCR扩增也造成较大的干扰和障碍.
3.3 水杉木材DNA条形码鉴定本文中所获的水杉序列以及在GenBank上获得的杉科所属植物的111条序列(登录号略),用 MEGA4.1软件对不同序列进行比对分析,比较不同序列的 “Alignment length(比对长度)”、“Variable sites(变异位点)”、“Pasim-informative sites(信息位点数)”、“G+C content(G+C含量)”、K-2P(Kimura-2-parameter distance)模型遗传距离.分析结果显示杉科所属植物rbcL、matK、TrnL intro、TrnL-F、ITS、ITS2 6个片段中,TrnL-F、TrnL intro、ITS2片段的长度较小,rbcL片段的序列长度比较适中,比较适合用于降解基因的扩增,另外其测序仅需一个反应便可完成,符合作为DNA barcoding的要求[7-11].ITS的G+C含量最高,为62.1%,TrnL intro的G+C含量最低,为32.9%.就信息位点数来看,ITS2比例最高,为75.89%,而rbcL的比例最低,为5.8%.各序列的遗传距离秩和检验可见属间变异程度大致是:ITS>ITS2>TrnL-F>TrnL intro=rbcL,且除rbcL、matK、TrnL intro外,各个序列属间变异P<0.005,甚至P<0.001,说明各序列间差异显著,甚至是极显著.属内遗传距离的Wilconxon秩和检验显示,只有ITS序列属内变异P<0.05,差异显著,其余各序列属内变异程度相似,所以其用于属内变异,没有优势序列[12-18].
3.4 结论通过对水杉木材DNA的提取,PCR扩增以及基于杉科植物的DNA条形码检索筛选,最终得到以下结论:
(1)改良后的CTAB法、SDS法及高盐低pH法均可以用于水杉木材DNA的提取,经过纯化的DNA,完全可以进行片段扩增.
(2)水杉木材不同部位DNA含量明显不同,其中心材含量最低,且降解程度较严重,无法进行较长片段的扩增.
(3)随着木材离体时间的延长,DNA处于一种不断降解的状态,同时所能扩增的片段,也不断缩短.
(4)ITS2序列和trnL-F序列,比较适合作为水杉木材鉴定的DNA条形码序列,对于已经降解的DNA而言,ITS2更适合作为鉴定条码.
[1]陈向明.用CTAB法提取植物 DNA的技术改进[J].合肥教育学院学报,2000,17(1):14-15.
[2]张海泉,符晓棠,杨国荣,等.不同提取条件对 DNA质量的影响[J].安徽农学通报,2006,12(6):58-60.
[3]姜静.分子生物学实验原理与技术[M].沈阳:东北林业大学出版社,2003:5.
[4]Kress W J,Erickson D L.A two-locus global DNA barcode for land plants:the codingrbcL gene complements the non-codingtrnH-psbA spacer region[J].PloS One,2007,2(6):508-513.
[5]Lahaye R,Van der Bank M,Bogarin D,et al.DNA barcoding the floras of biodiversity hotspots[J].Pro Nat Acad Sci USA,2008,105(8):2923-2928.
[6]王亚玲,张寿洲,崔铁成.trnL内含子及trnL-trnF间隔区序列在木兰科系统发育研究中的应用[J].西北植物学报,2003,23(2):247-252.
[7]向巧萍,向秋云,Aaron Liston,等.ITS(nrDNA)片段在冷杉属植物中的长度多态性及其在松科的系统与演化研究中的应用[J].植物学报,2000,42(9):946-951.
[8]Asif M J,Cannon C H.DNA Extraction from processed wood:a case study for the identification of an endangered timber species(Gonystylusbancanus)[J].Plant Molecular Biobogy Reporter,2005,23:185-192.
[9]Kazumasa Yoshida,Akira Kagawa,Mitsuru Nishiguchi.Extraction and detechion of DNA from wood for species identification[C]//Proceedings of the international symposium on development of improved method to identifyshoreaspecies wood and its origin.Tokyo(Japan):The University of Tokyo,2007.
[10]Tani N,TsumuraY,Sato H.Nuclear gene sequences and DNA variation ofCryptomeriajaponicasamples from the pastylacial period[J].MolEcol,2003,12(4):859-868.
[11]Reynolds M M,Williams C G.Extracting DNA from submerged pine wood[J].Genome,2004,47(5):994-997.
[12]唐建阳,周先治.植物DNA条形码研究现状及应用前景[J].中国农学通报,2009,25(24):35-43.
[13]宁淑萍,颜海飞,郝刚,等.植物DNA条形码研究进展[J].生物多样性,2008,16(5):417-425.
[14]陈士林,姚辉,宋经元,等.基于 DNA barcoding(条形码)技术的中药材鉴定[J].世界科学技术,2007,9(3):7-1.
[15]彭居俐,王绪祯,何舜平.DNA条形码技术的研究进展及其应用[J].水生生物学报,2005,32(6):926-919.
[16]吴春颖.DNA条形码候选序列在百合科植物鉴定中的应用[D].北京:北京林业大学,2009:3-6.
[17]葛家文,王好转.DNA条形码与生物分类学研究[J].畜牧与饲料科学,2009,30(5):52-53.
[18]任保青,陈之端.植物DNA条形码技术[J].植物学报,2010,45(1):1-12.
DNA extraction from woodMetasequoiaglyptostroboidesand molecule barcode identification
YANG Xingyu,YANG Lulu,YU Zhiwei,YANG Jianming
(School of Life Science,Hubei University,Wuhan 430062,China)
Through wood DNA fragments extraction and PCR experiment,in different fixed number of year and in different parts ofMetasequoiaglyptostroboides,the results showed the method of CTAB(16alkyl three methyl brominated ammonium),SDS(sodium dodecyl sulfate)and high-saltlow pH after improvement could be used in theMetasequoiaglyptostroboideswood′s DNA extracted.After purification in wood DNA,the experiment proved it could be PCR.During the extracting,the sapwood was better than heartwood,sapwood DNA′s quantity and quality was more reliable.The experiments showed that theMetasequoiaglyptostroboideswood′s DNA molecules was about 23kbp.In the use of wood DNA molecular series,we carried the analysis of testing DNA sequence,bar code screening,characteristics of the genetic distance,rank and inspection,barcoding gap inspection,the results indicated that the sequence ITS2,trnL-F was suitable to its DNA bar code technology requirements.It could be used as identificationMetasequoiaglyptostroboideswood.
Metasequoiaglyptostroboides;wood′s DNA extraction;PCR;DNA barcode;CTAB
Q94-336
A
1000-2375(2011)04-0397-07
2011-05-30
湖北大学教学研究项目(2010.9)资助
杨星宇(1981-),男,博士生;杨建明,通信作者,教授,E-mail:yjm6432@sina.com
致谢实验中曾得到中国科学院武汉植物研究所王瑛研究员,湖北大学生命科学学院杨之帆副教授的亲临指导帮助,特致以诚挚的感谢。
(责任编辑 游俊)
