棉花变黑轮枝菌的鉴定及致病性的测定
2011-01-06金利容万鹏黄民松黄薇杨绍丽喻大昭
金利容,万鹏,黄民松,黄薇,杨绍丽,喻大昭
(湖北省农业科学院植保土肥研究所,湖北 武汉430064)
棉花变黑轮枝菌的鉴定及致病性的测定
金利容,万鹏,黄民松,黄薇,杨绍丽,喻大昭
(湖北省农业科学院植保土肥研究所,湖北 武汉430064)
自湖北棉区有黄萎病症状的棉叶中分离到能产生厚垣孢子的褐色菌,取2个供试菌株V12和V24,经形态特征、生物学特性和ITS分析,鉴定为变黑轮枝菌(V.nigrescens).对其致病性进行测定,发现其对棉花致病力极弱.推测该菌是一种植物衰老期或植物生长势呈下降趋势时的病原菌,常与大丽轮枝菌混生.
变黑轮枝菌;鉴定;致病性
1816年Nees von Esenbeck[1]建立了Verticillium属,主要包括大丽轮枝菌(V.dahliaeKleb.)、黑白轮枝菌(V.albo-atrumReinke et Berth.)、变黑轮枝菌(V.nigrescensPethyhr.)、云状轮枝菌(V.nubiliumPethybr.)和三体轮枝菌(V.tricorpusIsaac).引起棉花黄萎病主要为大丽轮枝菌(V.dahliaeKleb.).Pethybridge首次从英国马铃薯植株和块茎中分离到两种产生厚垣孢子的轮枝菌[2],分别命名为变黑轮枝菌(V.nigrescensPethyhr.)和云状轮枝菌(V.nubiliumPethyhr.).1969年 Phillips从有褐茎腐病的大豆植株中分离到变黑轮枝菌[3].据报道,变黑轮枝菌是棉花的弱致病菌,可使棉花轻度萎蔫发黄[4-6].本研究室在湖北棉区分离到能产生厚垣孢子的褐色菌,经形态特征、生物学特性和ITS分析结果鉴定为变黑轮枝菌.
1 材料和方法
1.1 菌株的采集、分离和纯化供试样本采集于湖北棉区,菌株分离于有黄萎病症状的棉叶叶柄.本试验共采用6个菌株,2个供试菌株:V12-1和 V24-1,由本实验室分离得到;2个变黑轮枝菌(V.nigrescens)对照菌株:V394和V43,由西北农林科技大学胡小平老师提供,从苜蓿中分离得到;2个大丽轮枝菌(V.dahliae)对照菌株:V11和V991,V11由本实验室分离得到,V991由华中农业大学张献龙老师提供.
分离采用组织保湿培养法,将棉株叶柄用自来水洗净,用0.1%升汞处理30s,后用灭菌水清洗数次后用剪刀剪成小段,放在灭菌的玻片上保湿,25℃下恒温培养,大约7d后在显微镜下观察两端是否有轮枝小梗,将其挑出并进行纯化,单孢分离.
1.2 菌株的形态学鉴定将供试菌株和对照菌株接种于PDA平板上于25℃暗培养1周后进行菌落观察和镜检.挑取菌块的少许,置于显微镜下观察并用测微尺测量分生孢子和厚垣孢子的大小.将菌落用小刀切开,12~24h后观察分生孢子梗的形态.
将各菌株接种于查氏液体培养基,放入25℃恒温摇床上150r/min培养7d,观察液态培养特性.
1.3 温度对菌落生长的影响供试温度:设置15、20、25、30、33、35℃ 共5个温度.试验方法:用直径为0.6cm的打孔器切取菌饼接种于PDA固体培养基上,分别置于上述6个不同温度的恒温箱内暗培养,设3个重复.观察和记录持续2周,第14天测量菌落直径,用十字交叉平均法算出各菌株菌落的直径.
1.4 菌株DNA的提取和核糖体ITS基因扩增与测序
1.4.1 菌株DNA的提取 采用CTAB法[7]提取6个菌的菌株DNA.DNA电泳检测.
1.4.2 ITS扩增 用真核生物核糖体DNA通用引物ITS1和ITS4进行PCR扩增.其序列为,ITS1:5′-TCCGTAGGTGAACCTGCGG-3′,ITS4:5′-TCCTCCGCTTATTGATATGC-3′.
PCR反应体系总体积为50μL,反应液组分为:10×PCR Buffer 5μL,25mmol/L MgCl24μL,10 mmol/L dNTP 2μL,5U/μL Taq酶0.3μL,模板DNA 10ng,引物ITS1和ITS4(25μmol/L)各1μL,加ddH2O使总体积达到50μL,在PTC-100PCR扩增仪上扩增.扩增条件:95℃预变性4min;94℃变性1min;54℃退火1min;72℃延伸1min,共35个循环;最后72℃延伸10min.PCR产物委托南京金斯瑞生物公司进行纯化和测序.
1.4.3 ITS序列分析 将6个菌株的核糖体DNA-ITS序列用DNAMAN软件进行同源性分析,并将这些菌株的测序序列与GenBank中已经注册的核酸数据库中的ITS序列进行同源性比较(http://www.ncbi.nlm.nih.gov/blast),建立同源关系图.
1.5 致病性测定
1.5.1 棉株的准备 准备无土基质若干,于灭菌锅中灭菌2h,灭菌后摊开晾干.将感病品种鄂棉24脱绒处理,取大约300粒棉种种入无土基质中,待棉株长至1~2片真叶时待接种.
1.5.2 菌液的准备 活化4个菌株V991、V11、V12-1和V24-1,在PDA上长至4d后在边缘挑取少许菌丝接种于查氏培养基中,放入25℃恒温摇床上150r/min培养7d,用灭菌四层纱布过滤,用无菌水将孢子液浓度调整到1×107个/mL.
1.5.3 接种方法 待棉株长至1~2片真叶时将棉株从疏松的基质中慢慢托起,以免伤到幼苗,从中选230株健康的棉苗,在4个不同菌株的菌液里各浸入50株苗子接种,接种时间为30min.其中30株浸到无菌水中,作为空白对照.接种30min后将棉苗重新种入到基质中.将环境温度控制在22~27℃,每2d浇一次水,保证苗子的湿度.每天观察和记录病害的发生情况,第15天、第20天、第25天和第30天调查发病率及病情指数.以第30天调查的结果记录发病情况并计算发病指数.
2 结果与分析
2.1 菌株形态学特征
2.1.1 菌落形态 各菌株固体培养基的形态:V12-1、V24-1和V43在PDA平板上培养初期为白色,1周左右后颜色开始慢慢变成褐色或者黑褐色,在菌落表面产生灰白色粉层,并有小颗粒状的菌丝团形成,边缘整齐光滑.V394与前三者形态上一致,只是颜色要略深一点,为深褐色.V11和V991在PDA平板上培养初期为白色,后变为黑色,产生黑色微菌核,边缘整齐,上面形成一层较薄的白色圈.
各菌株液体培养基的形态:V12-1、V24-1、V394和V43液体培养7d后在瓶壁上出现一圈浅红色或者浅褐色的菌丝体,菌液中产生白色颗粒状的菌丝团,镜检发现其产孢量较大.V11和V991液体培养7d后在瓶壁上会出现一层微菌核形成的黑色圈,菌液浑浊,未出现白色颗粒状的菌丝团.
2.1.2 分生孢子梗的形态 6个菌株均能在切开的菌落边缘产生大量形态一致的轮枝孢子梗,轮枝孢子梗的形态并无太大的差异,均能形成层次分明的轮枝,3~5层互生、对生或者轮生,多的可达8~10层,分生孢子有的位于轮枝孢子梗的顶端,呈圆形.有的散落出来,呈椭圆形,如图1A.
从老菌落中挑取颜色较深的部分在显微镜下观察发现,供试菌株和V.nigrescens菌能产生厚垣孢子,这种厚垣孢子呈圆形、梨形、卵形或者不规则形,由细小菌丝联接而成.位于基丝末端或中部,单生或几个排列成短链,如图1B.
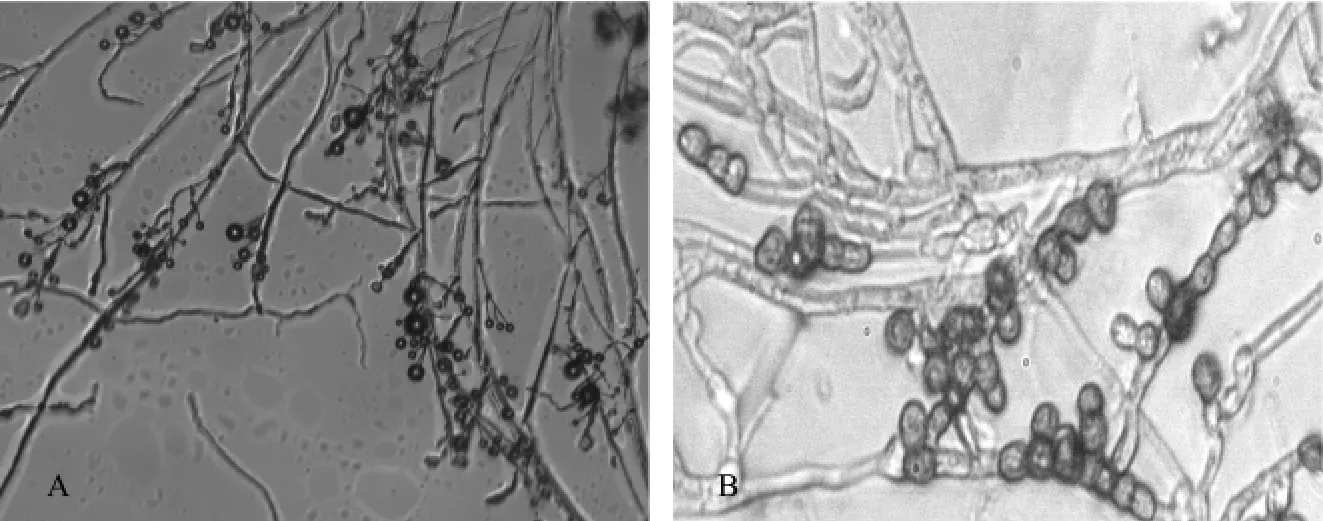
图1 显微镜观测图像(A:轮枝分生孢子,10×10倍;B:厚垣孢子,10×40倍)
用测微尺对各菌株的分生孢子和厚垣孢子的大小进行测定,V11和V991不能产生厚垣孢子,其分生孢子略大些,两个供试菌株和两个V.nigrescens菌株能产生厚垣孢子,两个供试菌株的厚垣孢子略大于两个V.nigrescens菌,见表1.
2.2 温度对各菌株生长的影响温度试验表明,2个供试菌株和2个V.nigrescens菌在15~30℃在PDA上均能较好地生长,33℃下生长缓慢,在35℃仍略有生长,最适生长温度约为25~28℃.两个V.dahliae菌35℃停止生长,最适生长温度约为23~25℃.对6个菌各个处理温度的生长速率进行统计学分析表明,6个菌在各个温度处理下的生长速度有一定的差异,同样的温度下两个V.dahliae菌与其他4个菌有较为显著的差异,见表2.
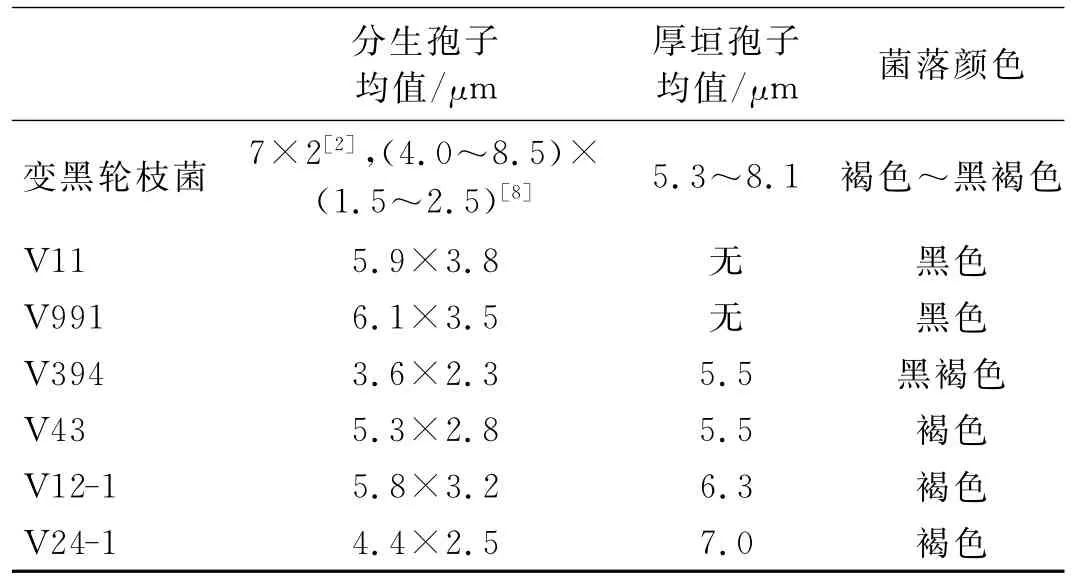
表1 各菌株分生孢子和厚垣孢子的大小
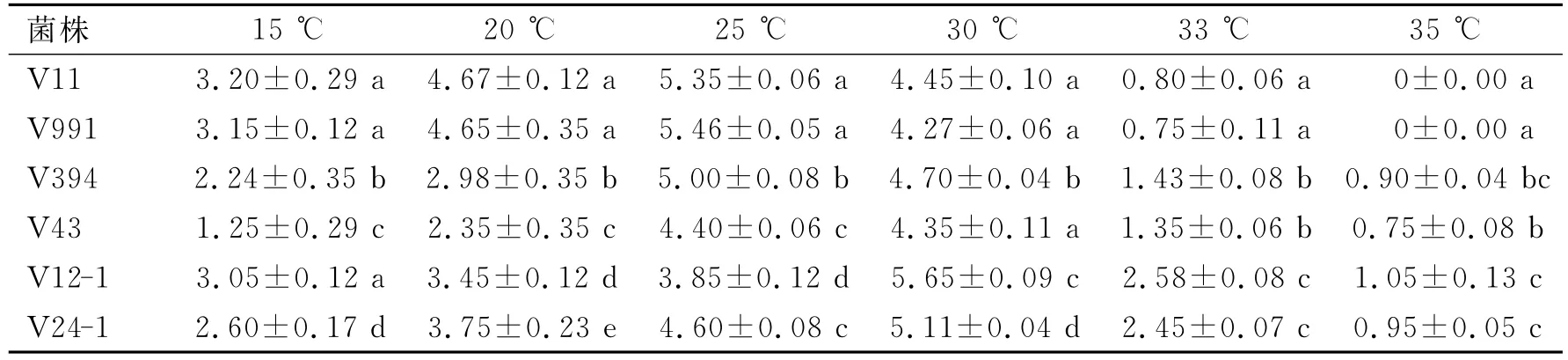
表2 不同温度下生长14d后6个菌株的菌落直径 cm

图2 V11在不同温度下的菌落形态(C:菌落背面,D:菌落正面)
2.3 ITS分析结果利用真核生物核糖体DNA通用引物ITS1和ITS4对这6个菌株的ITS区进行PCR扩增,均得到约为500bp的片段,将扩增产物送南京金斯瑞公司纯化测序,将测序结果放到GenBank上查找,发现供试菌株和两个V.nigrescens菌与已注册的V.nigrescens有较高的同源性,而V11和V991则与已注册的V.dahliae有较高的同源性.我们选取已注册的V.nigrescensCBS 179.40 (GenBank No.EF543851)和V.dahliaeT9(GenBank No.AY555947)ITS序列,用DNAMAN软件进行同源性比对,建立同源关系图.结果表明,T9、V991和V11有100%的同源性,V12-1、V24-1、V43、V394和CBS有100%的同源性.结合形态学特征,判断本实验室分离的2株供试菌株为变黑轮枝菌(图4).
2.4 致病性测定结果对2个供试菌和两个V.dahliae菌进行致病性测定,结果发现,2个供试菌株接种于棉花上并不表现有明显的黄萎病症状,植株生长正常,不受抑制,仅有个别植株出现萎蔫;而V991和V11的第30天调查的病指分别为72.2和52.5,表现出较为明显的黄萎病症状.

图3 V24-1在不同温度下的菌落形态(E:菌落背面,F:菌落正面)
3 讨论
关于从棉花中分离到变黑轮枝菌,国内的报道并不多见,陈吉棣在北京的茄子、马铃薯、利马豆、菜豆、豇豆、茼麻、藜、葎草,黑龙江的茄子和河北的马铃薯等植物上首次分离到变黑轮枝菌[9].王克荣等在我国江苏省棉区分离到3个V.nigrescens菌株[10].本研究室从湖北棉区采集的黄萎病病株中分离到能产生厚垣孢子的褐色轮枝菌,选取其中两株,并结合两个V.nigrescens菌和两个V.dahliae菌,进行形态学、生物学特性及ITS序列分析,鉴定为变黑轮枝菌(V.nigrescens).这是首次报道从湖北棉区分离到变黑轮枝菌.
从菌落形态上看,两个供试菌株V12-1和V24-1的菌落颜色为褐色,其休眠结构并不是黑色的微菌核,而是菌丝联接在一起的厚垣孢子,商鸿生等认为菌丝休眠体的形态是区分各近似种的重要形态鉴别特征[11].V12-1和 V24-1的分生孢子的大小与两个V.nigrescens菌的大小相当,但略小于两个V.dahliae菌.而两个供试菌株厚垣孢子的大小比两个V.nigrescens菌要大些,据报道,不同地区分离的V.nigrescens菌的分生孢子和厚垣孢子的大小数值并不是完全一致[12-14].在温度试验中,V12-1、V24-1和两个V.nigrescens菌33℃生长良好,35℃边缘仍有少许生长,而两个V.dahliae菌35℃不生长.将ITS扩增序列用软件进行同源性比对,V12-1和V24-1的ITS序列与V.nigrescens同源性很高,达到100%.
致病性测定结果表明,V12-1和V24-1对棉花的致病性很弱,且对植株生长影响也不大,这与王克荣等的结果是一致的.V12-1和V24-1是9月初从典型的黄萎病棉株中分离得到的,陈吉棣[9]指出,主要在植物后期分离到变黑轮枝菌,大多与大丽轮枝菌混生.我们可以认为该菌是一种植物衰老期或植物生长势呈下降趋势时的病原菌,由于其通常与大丽轮枝菌混生,较难分离到.虽然V12-1和V24-1对苗期棉花不具致病力或致病力极弱,但是否会对棉花后期造成影响,还需要进一步的研究.
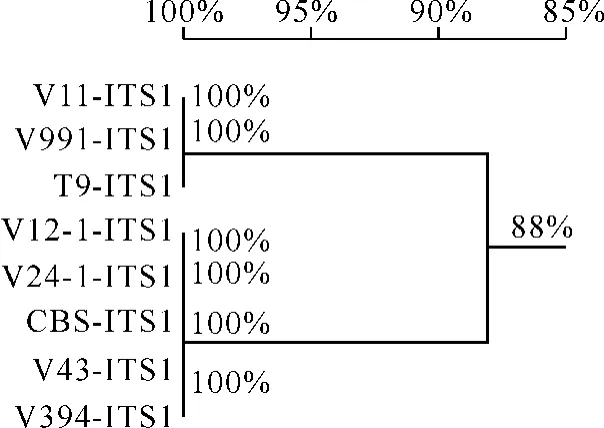
图4 同源关系图
[1]Nees von Esenbeck C G.Das system der pilze und schwamme[M].Ein bersuch,Würzburg:In der Stahelschen buchhandlung,1816.
[2]Pethybridge G H.Notes on some saprophytic species of fungi associated with diseased potato plants and tubers[J].Trans Brit Mycol Soc,1919,6:104-120.
[3]Phillips D V.Incidence of brown stem rot of soybean in Georgia[J].Plant Dis,1970,54:987-988.
[4]Roncadori R W.Fungal invasion of developing cotton bolls[J].Phytopathology,1969,59:1356-1359.
[5]Wiese M V,DeVay J E,Ravenscroft A V.Relationship between polygalacturonase activity and cultural characteristics ofVerticilliumisolates pathogenic in cotton[J].Phytopathology,1970,60:641-646.
[6]Wyllie T D,DeVay J E.Growth characteristics of several isolates ofVerticilliumalbo-atrumandVerticillium nigrescensfrom cotton[J].Phytopathology,1970,60:907-910.
[7]Tayor J W,Natvig D O.Isolation of fungal DNA[M].Personal Communication,1998.
[8]CMI descriptions of pathogenic fungi and bacteria[M].Kew,Surrey,England:Commonwealth Mycological Institute,1970:257-258.
[9]陈吉棣.变黑轮枝菌—我国寄主植物上首次报道的一种轮枝菌[J].植物病理学报,1982,12(1):33-37.
[10]王克荣,陆家云.变黑轮枝菌种的鉴定及其致病力的测定[J].南京农业大学学报,1987,1(2):59-62.
[11]商鸿生,杨家荣,赵小明.苜蓿黄萎病菌与轮枝孢属近似种的比较研究[J].草业学报,1998,7(4):32-37.
[12]Devaux A L,Sackston W E.Taxonomy ofVerticilliumspecies causing wilt of horticultural crops in Quebec[J].Canad Jour Bot,1966,44(6):803-811.
[13]Hoes J A.Development of chlamydospores inVerticilliumnigrescensandV.nubilum[J].Canad Jour Bot,1971,49:1863-1866.
[14]Isaac I A.A comparative study of pathogenic isolates ofVerticillium[J].Brit Mycol Soc Trans,1949,32:137-157.
Indentification and pathogenicity determination of isolates ofVerticilliumnigrescensPethybr
JIN Lirong,WAN Peng,HUANG Minsong,HUANG Wei,YANG Shaoli,YU Dazhao
(Institute of Plant Protection and Soil Science,Hubei Academy of Agricultural Sciences,Wuhan 430064,China)
V12and V24,two isolates ofVerticilliumwith brown chlamydospores,isolated from cotton growing regions in Hubei,were identified asVerticilliumnigrescensbased on morphology,biological characters and ITS analysis.Inoculating cotton in greenhouse,we found that the pathogenicity of both the two isolates was very weak to cotton.It was speculated that the isolates were a kind of pathogen parasitizing on the stage of plant senescence,or plant in downward trend.And it was often mixed withV.dahliae.
VerticilliumnigrescensPethybr;indentification;pathogenicity
S435
A
1000-2375(2011)04-0413-05
2011-03-30
农业部公益性行业科研专项(nyhyzx07-052)和国家科技基础性工作专项(SB2007FY027)资助
金利容(1982-),女,助理研究员;喻大昭,通信作者,研究员,E-mail:dazhaoyu@china.com
(责任编辑 游俊)
