海参质量标准的分析研究
2010-12-09刘洋洋许琼情刘平怀
杨 勋,刘洋洋,时 杰,许琼情,刘平怀
(海南大学材料与化工学院 海南优势资源化工材料应用技术教育部重点实验室,海南 海口 570228)
海参质量标准的分析研究
杨 勋,刘洋洋,时 杰,许琼情,刘平怀*
(海南大学材料与化工学院 海南优势资源化工材料应用技术教育部重点实验室,海南 海口 570228)
研究海参主要活性成分的定量分析方法,并应用于海参质量标准的制定.试验采用分光光度法测定并计算海参皂苷及多糖含量,海参皂苷及多糖的标准曲线分别为Y=1.3876X-0.0161(R2=0.9994)和Y=0.0454X+0.2487(R2=0.9989),在一定浓度范围内线性关系良好.该方法简单,稳定性好,可分别用于测定海参药材中总皂苷和总多糖含量.将总皂苷与总多糖含量两个指标作为海参质量标准的限度,对规范海参药材质量具有一定的参考价值.
海参;皂苷;多糖;分光光度法;质量标准
海参为棘皮动物门(Echinodermata)海参纲(Holothurioidea)动物,在中国多个海域有分布,仅中国南海就有30多种,西沙群岛居多,温带海区以山东半岛和辽东半岛为主[1-5].海参营养丰富并含有多种生物活性物质,具有较高的经济价值和药用价值,明代《食物本草》指出海参有主补元气、滋益五脏六腑虚损的养生功能,清代《本草纲目拾遗》将海参列为补益药物.现代科学研究表明,在海参体内,主要含有两种有效成分,即海参皂苷和海参多糖成分,能够起到增强人体免疫,抗疲劳,抗肿瘤的作用[1].海参作为一种名贵的滋补药材,其质量标准未加以规范,这给海参药材的质量控制及规模化生产带来了不便.本文通过对海参主要活性物质的含量进行定量测定,旨在探讨一种适合海参活性成分的定量测定方法,为海参质量标准[6-7]制定提供一定的依据.
1 材料与方法
1.1 仪器、试剂与材料
TU-1810PC紫外可见光分光光度计(北京普析通用仪器公司),香草醛(国药集团化学试剂有限公司),高氯酸(天津鑫源化工厂),天青Ⅰ试剂(温州市化学试剂有限公司).Echinoside A(海参三萜皂苷),海参多糖均为实验室制备.
实验所用海参采自海南省万宁市日月湾海域,经海南大学生物工程系刘平怀教授鉴定为花刺参Stichopus Uariegatus(Sempen).
1.2 实验方法
1.2.1 样品液的制备
(1)海参总皂苷溶液的制备.取干燥的海参2 g用体积分数为60%的乙醇提取,后用正丁醇萃取,取正丁醇段挥发干,得到海参样品总皂苷.用体积分数为60%的乙醇溶解并定容至100 mL.制成皂苷液备用.
(2)海参多糖溶液的制备.海参匀浆加入蛋白酶完全水解,离心,得到的上清液加蒸馏水到一定浓度[8-11].
1.2.2 测定波长的确定
(1)Echinoside A测定波长确定.皂苷类物质与香草醛-高氯酸反应,生成共轭双键系统,在酸性条件下形成阳碳离子盐而显色,在紫外光下有特定的吸收波长.精确称量Echinoside A 0.7 mg,加入0.2 mL 5%香草醛-冰醋酸溶液及0.8 mL高氯酸,60℃水浴15 min,冰水冷却,加冰醋酸5 mL,摇匀,用紫外可见光分光光度计于波长400-700 nm扫描,在波长560 nm处出现峰值(见图1).确定测定波长为560 nm.以该反应体系未加Echinoside A为空白对照[12-15].
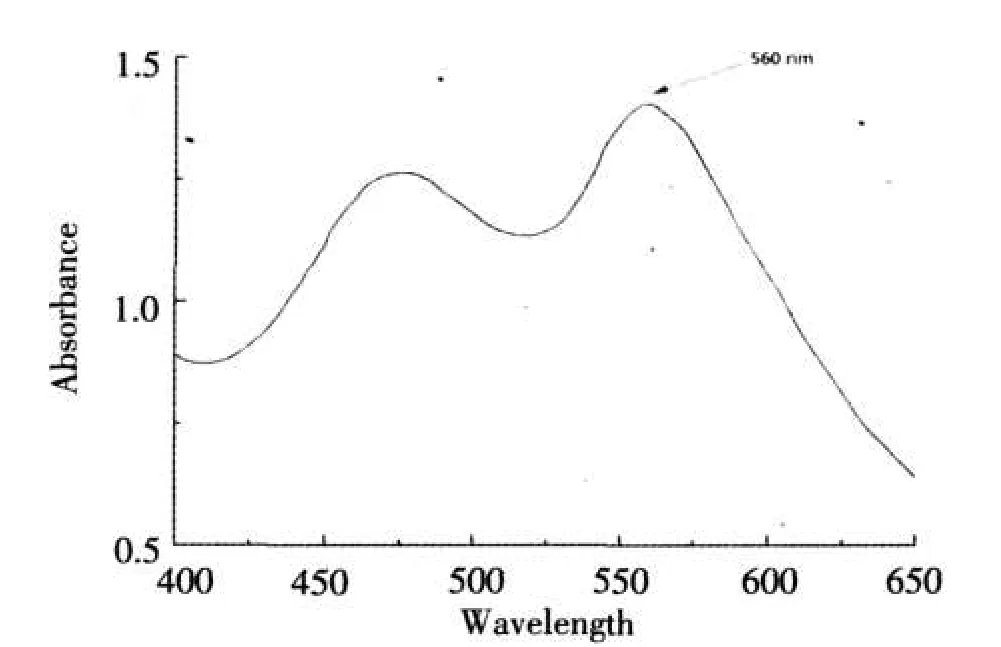
图1Echinoside A波长扫描图Fig.1The absorbance spectra of Echinoside A
(2)海参多糖液测定波长确定.海参多糖和天青I试剂特异性结合,生成蓝紫色物质,该蓝紫色物质在515 nm处有最大吸收[9-10].因此,测定海参总多糖与天青I试剂结合物在515 nm下的吸收值,可以间接对海参多糖进行定量分析.
1.2.3 标准曲线的绘制
(1)海参皂苷标准曲线绘制.精确称量Echino⁃side A 10.5 mg用体积分数为60%的乙醇溶解后定容至10 mL配制成标准溶液.分别量取标准液0、0.1、0.2、0.3、0.4、0.5 mL至瓶中,90℃挥干溶剂.加入0.2 mL 5%香草醛-冰醋酸溶液及0.8 mL高氯酸,60℃水浴15 min,冰水冷却,加冰醋酸5 mL,摇匀,分别于560 nm处测吸光值,重复测量,取平均值,该反应体系未加Echinoside A为空白对照.以Echinoside A 含量(mg)为横坐标(X),吸光值为纵坐标(Y)绘制标准曲线.
(2)海参多糖标准曲线的绘制.精密称取海参多糖用蒸馏水配制成0.25 mg/L溶液.天青I试液:取天青I试剂0.5 g,以蒸馏水稀释至500 mL,放置7 d.过滤除去不溶物,得天青I储备液,冷藏保存.临用时取储备液1 mL加蒸馏水至加20 mL.精密量取海参多糖标准溶液10、20、30、40、50 μL分别加水至50 μL,依次加入天青I试液5.0 mL,混匀后10 min内于515 nm波长处测定吸光值,该反应体系未加海参多糖为空白对照.以多糖含量(μg/mL)为横坐标(X),吸光值为纵坐标(Y),绘制标准曲线.
1.2.4 测定方法稳定性试验
(1)皂苷稳定性.连续测定0.2 mL的Echino⁃side A标准液5次,方法同1.2.3,计算SD和CV值.该方法的SD=0.73%,CV=2.61%.结果表明该方法稳定可靠.
(2)多糖稳定性.取浓度0.10 mg/mL的海参多糖标准溶液1.00 mL,加入天青Ⅰ试液50 mL,混匀后平均分成10份,每隔1 h测定1次含量,计算RSD值.计算得到RSD值0.56%,表明此方法的成色物质在10 h内稳定.
1.2.5 含量测定
(1)总皂苷含量测定.取一定量总皂苷液按1.2.3的方法测其吸光值,根据标准曲线计算皂苷含量.取不同量的重复测量,计算后取平均值.
(2)多糖含量的测定.精密量取供试多糖样品1.0 mL置于10 mL容量瓶中以水定容,摇匀,得样品液.量取25 μL样品液,加入天青Ⅰ试液5.0 mL,混匀后10 min内于515 nm波长处测定吸光值,以水作为空白对照.如果样品的吸光值在量程范围内,则参照标准曲线计算多糖含量;否则将稀释样品的浓度作适当调整,使吸光值最终落在线性范围内.
2 结果与讨论
2.1 皂苷标准曲线
以Echinoside A的质量(mg)为X,吸光值为Y,绘制得到标准曲线Y=1.3876X-0.0161,相关系数R2=0.9994.在0-0.6 mg之间呈现良好的线性关系.结果见图2.
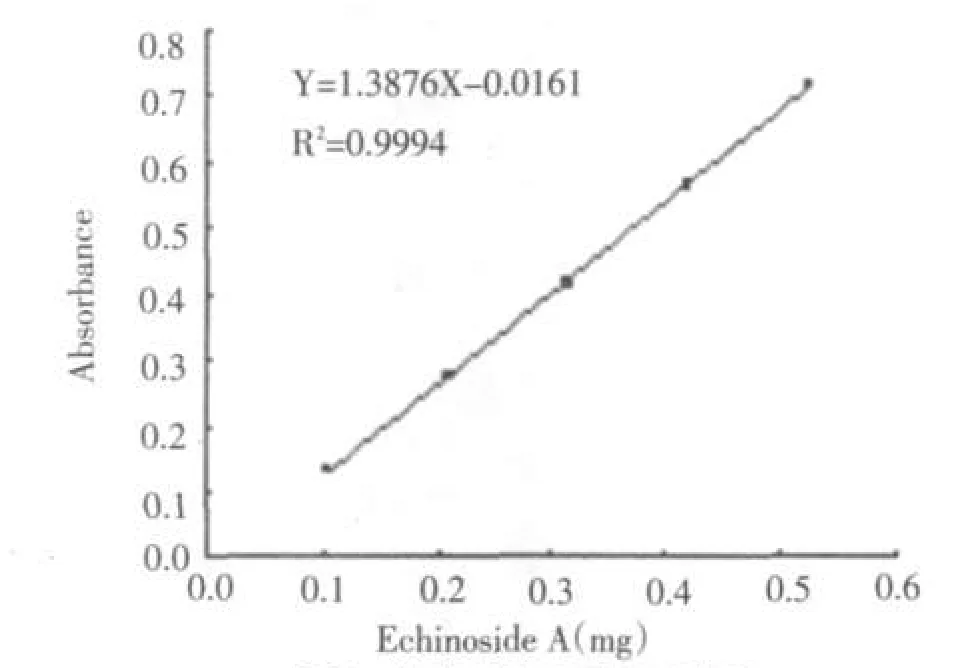
图2 皂苷浓度与吸光值关系Fig.2Relation between concentration of Echinoside A and absorption
2.2 多糖标准曲线
以多糖含量(μg/ml)为横坐标(X),吸光值为纵坐标(Y),绘制得到标准曲线Y=0.0454X+0.2487,R2=0.9989,在5.0-21.0 μg之间呈现良好的线性关系.结果见图3.
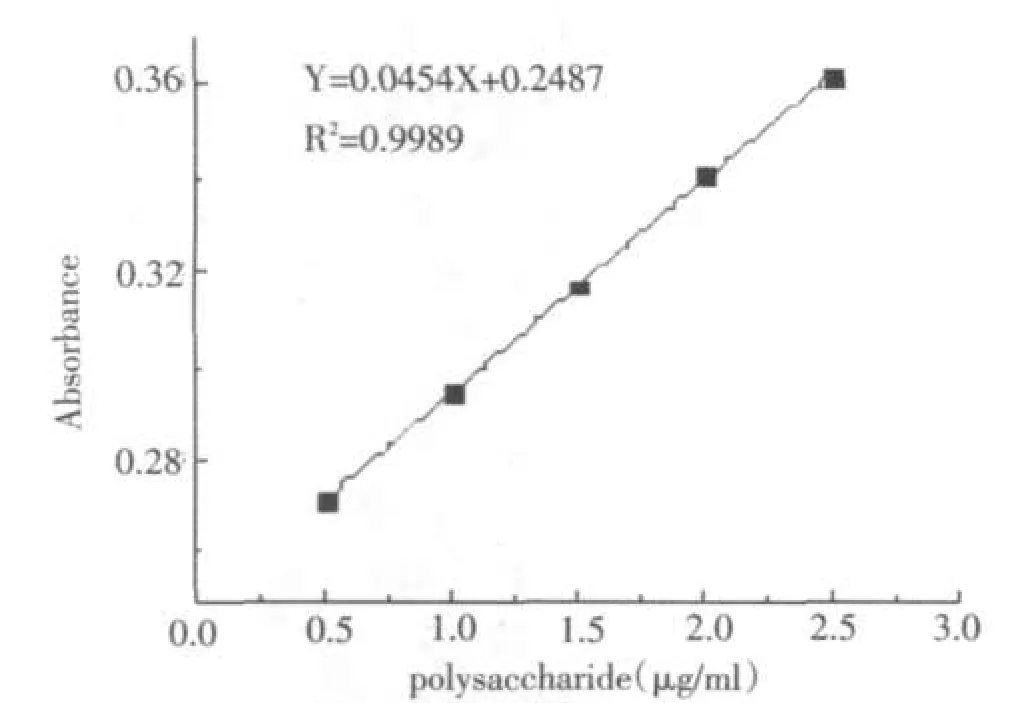
图3 多糖浓度与吸光值关系Fig.3Relation between concentration of polysaccharide and absorption
3 讨论
海参多糖和皂苷对海参食用及药用价值影响很大,是不可或缺的海参营养评价指标.海参多糖是海参体壁的重要组成成分,其含量约占干海参有机物总量的6%以上.国内外研究表明,海参体壁多糖主要为海参糖胺聚糖(Glycosaminoglycan,GAG)或称粘多糖(Holothurian Glycosaminoglycan,HG),另一种海参岩藻多糖(Holothurian Fucan,HF)[16].海参皂苷的种类很多,其结构多数为羊毛甾烷型三萜皂苷,且绝大多数具有药理活性[17-18].
使用天青I试剂与多糖特异性结合及香草醛-高氯酸试剂与皂苷特异性结合在特定波长下的特征吸收值来对其含量进行定量分析,这种方法在一定的浓度范围内具有良好的线性关系,且稳定性好.实验所用海参多糖及Echinoside A均为实验室制备,用作标准品能够准确的测定海参多糖及皂苷含量,且纯度要求不是很高,制备方法简单可行.本文提到定量测定多种类型物质成分含量作为药材的质量标准规范,对于复杂成分的中药材质量标准的制定有一定的参考价值.
4 结论
海参质量标准[19]:本品为花刺参Stichopus Uarie⁃gatus(Sempen)的干燥体.海参捕得后,除去内脏,洗净腔内泥沙,入适当的盐水中烧煮约1 h,捞起放冷,经曝晒或烘焙至八、九成干时,再入蓬叶液中略煮,至颜色转黑时,取出晒干.
性状:本品肉质厚嫩.体稍呈方柱形,一般长30-40 cm,最长可达95 cm.背面散生多数圆锥形和排列不规则的肉刺.腹面管足排列成3纵带,喘带较宽,触手20个.皮的内片:第1种为桌形体,基塔部顶端具12个向外扩张的小齿,它的底盘小,略带方形,中央常有4个大孔,周围有4个或4个以上的小孔;底盘较大的桌形体,其周围小孔也较多.第2种骨片是大小不等的C形体.第3种似为数个C形体连接组成的花纹样体.形态特征:体呈圆筒状,长10~20 cm,特大的可达30 cm.触手轮形,17~30个,一般为20个.触手坛囊发达.口在前端,多偏于腹面.肛门在后端,多偏于背面.背面一般有疣足,腹面有管足.
检查:水分按照水分测定法(参照《中国药典》2005版附录ⅨH第一法)测定.总灰分参照《中国药典》2005版附录ⅨK.酸不溶性灰分参照《中国药典》2005版附录ⅨK.
浸出物:照浸出物测定法项下的热浸法(参照《中国药典》2005版附录ⅩA)测定,用水溶性测定法或醇溶性测定法待定.
含量测定:总皂苷(1)皂苷液的制备:取干燥的海参2 g用体积分数为60%的乙醇提取,后用正丁醇萃取,取正丁醇段挥发干,得到海参样品总皂苷.用体积分数为60%的乙醇溶解并定容至100 mL.制成皂苷液备用.(2)标准曲线绘制:精确称量Echinoside A 10.5 mg用体积分数为60%的乙醇定容10 mL配制成标准溶液.分别量取标准液0、0.1、0.2、0.3、0.4、0.5 mL至瓶中,90℃挥干溶剂.加入0.2 mL 5%香草醛-冰醋酸溶液及0.8 mL高氯酸,60℃水浴15 min,冰水冷却,加冰醋酸5 mL,摇匀.照紫外-可见光分光光度法(2005版药典附录V A)分别于560 nm处测吸光值,重复测量,取平均值.以Echinoside A含量为横坐标(X),吸光值为纵坐标(Y)绘制标准曲线.(3)测量:取一定量总皂苷液90℃挥干溶剂.加入0.2 mL 5%香草醛-冰醋酸溶液及0.8mL高氯酸,60℃水浴15 min,冰水冷却,加冰醋酸5 mL,摇匀.测其吸光值,根据标准曲线计算皂苷含量.
总多糖:(1)多糖液的制备:将海参匀浆加入蛋白酶完全水解,离心,得到的上清液加水到一定浓度.(2)标准曲线绘制:精密称取海参多糖标准品用水配制成0.25 mg/L溶液.天青I试液:取天青I试剂0.5 g,以水稀释至500 mL,放置7 d.过滤除去不溶物,得天青I储备液,冷藏保存.临用时取储备液1 mL加水至加20 mL.精密量取海参多糖标准溶液10、20、30、40、50 μL分别加水至50 μL,依次加入天青I试液5.0 mL,混匀后10 min内于照紫外-可见光分光光度法(2005版药典附录V A)于515 nm波长处测定吸光值,以多糖含量为横坐标(X),吸光值为纵坐标(Y).以水为空白对照,绘制标准曲线.(3)测量:精密量取供试多糖样品1.0 mL置于10 mL容量瓶中以水定容,摇匀,得样品液.量取25 μL样品液,加入天青I试液5.0 mL,混匀后10 min内于515 nm波长处测定吸光值,以水作为空白对照.如果样品的吸光值在量程范围内,则参照标准曲线计算多糖含量;否则将稀释样品的浓度作适当调整,以使吸光值最终落在量程范围内.根据测得吸光值依据标准曲线计算多糖含量.
炮制:以水瀹胖,剖去肚杂泥沙用.现行,取原药材,除去杂质,洗,切厚片或段,干燥.先从肛门处挑一小口,放净体内的内脏,经沸水浴处理后,控净水,凉透后加入适量的粗盐拌均匀(一般500 g海参加盐550-750 g),腌渍8 h后,捞出控净水,加入草木灰拌匀,摊放在阴凉透风处晾干(加工厂一般用紫外线烘干),拍净海参表面的草木灰装袋即成.贮藏:置干燥处,防蛀.
[1]陈颖,汪树理.海参的化学成分与药理作用研究进展[J].河北渔业,2008,4:6-7.
[2]赵永峰.海参的营养成分介绍[J].休闲渔业,2006,2:71-72.
[3]房英春,王晓益,张慧,等.海参的营养及药用价值[A].农技服务,2007,24(11):64.
[4]李春艳,常亚青.海参的营养成分介绍[J].科学养鱼,2006(2):71-72.
[5]樊绘曾.海参:海中人参-关于海参及其成分保健医疗功能的研究与开[J].中国海洋药物,2001,82(4):37-44.
[6]刘爱玲,陈玉秀,刘红英,等.博落回果实药材质量标准研究[B].现代生物医学进展,2009,7:1277-1278.
[7]马晓蕾,康琛,李曼玲.丹参药材质量标准研究进展[D].Chinese Journal of Information on TCM.,2008,15:118-120.
[8]王洪涛,付学军.海参多肽、多糖综合提取工艺条件的优化[J].食品与生物技术学报,2006,25(6):83-86.
[9]曹慧丽,王珍,武桂玲.海参口服液中海参多糖的测定[J].职业与健康,2004,2(20):52.
[10]李燕妮,车业娜,刘国静.分光光度法测定海参多糖含量方法的改进[A].云南化工,2008,35(4):27-28.
[11]蔡彬新,吴成业.海参多糖的分离纯化方法及其主要生物活性[J].福建水产,2008,3:71-74.
[12]郭丹,熊阳,张悦,等.HPLC-ELSD法测定黑乳海参皂苷甲Nobiliside A冻干脂质体中药物含量以及包封率[A].药物分析杂志,2009,29(3):373-374.
[13]王莹,康万利,辛士刚,等.鲍鱼、海参中微量元素的分析研究[A].光谱学与光谱分析,2009,29(2):511-514.
[14]董平,薛长湖,盛文静,等.海参中总皂苷含量测定方法的研究[A].中国海洋药物杂志,2008,27(1):28-32.
[15]韩玉谦,冯晓梅,管华诗.海参皂苷的研究进展[J].天然产物研究与开发,2005,17(5):669-672.
[16]马同江,周清凯,蔡云见.海参的药理作用及应用[J].海洋药物,1982,2(2):9-13.
[17]崔桂友,赵廉.食用海参的名称与种类鉴定[J].扬州大学烹饪学报,2000(3):13.
[18]廖玉麟.中国动物志.棘皮动物门海参纲[M].北京:科学出版社,1997:110-116.
[19]国家药典委员会.中华人民共和国药典[M].北京:化学工业出版社,2005.
Study on the Quality Standards of Sea Cucumbers
YANG Xun,LIU Yangyang,SHI Jie,XU Qiongqing,LIU Pinghuai*
(Ministry of Education Key Laboratory of Application Technology of Hainan Superior Resources Chemical Materials,College of Materials and Chemical Engineering,Hainan University,Haikou570228,China)
We developed a quantitative analysis method of the main active ingredients of sea cucumber,and used this method to formulate the quality standards of sea cucumber.We calculated saponins and polysaccharides content of sea cucumber by measuring with spectrophotometry.The standard function were Y=1.3876X-0.0161,(R2=0.9994)and Y=0.0454X+0.2487,(R2=0.9989)respectively,which have good linear relationship within a certain concentration.So the method can be used to measure the saponins and polysaccharides content of sea cucumber with simplicity and good sta⁃bility.Using the total saponin and polysaccharide content as the quality standards of sea cucumbers can provide refer⁃ence for the specification of the quality of sea cucumbers.
sea cucumbers;saponins;polysaccharides;spectrophotometry;quality standard
R 282.7
A
1674-4942(2010)04-0423-04
2010-08-17
海南省重点科技计划项目(06202);2006年度海口市重点科技计划项目
*通讯作者
毕和平
