Cu-Ni/γ-Al2O3双功能催化剂上二甲醚水蒸气重整制氢
2010-12-05王晓蕾潘相敏寇素原邹卫兵马建新
王晓蕾 潘相敏 林 瑞 寇素原 邹卫兵 马建新,*
(1同济大学环境科学与工程学院,上海 200092;2同济大学新能源汽车工程中心,上海 201804; 3同济大学汽车学院,上海 201804;4华东理工大学资源与环境工程学院,上海 200237)
Cu-Ni/γ-Al2O3双功能催化剂上二甲醚水蒸气重整制氢
王晓蕾1,2潘相敏2,3林 瑞2,3寇素原2,3邹卫兵2,4马建新2,3,*
(1同济大学环境科学与工程学院,上海 200092;2同济大学新能源汽车工程中心,上海 201804;3同济大学汽车学院,上海 201804;4华东理工大学资源与环境工程学院,上海 200237)
用沉积-沉淀法分别制备了Cu/γ-Al2O3、Ni/γ-Al2O3和Cu-Ni/γ-Al2O3催化剂,并研究了它们在二甲醚水蒸气重整(DME SR)制氢反应中的催化性能.采用比表面积测定(BET)、X射线衍射(XRD)、H2程序升温还原(H2-TPR)、X射线光电子能谱(XPS)、NH3程序升温脱附(NH3-TPD)、程序升温氧化(TPO)和透射电子显微镜(TEM)等表征手段对催化剂的物相结构、微观形貌、还原性能、表面酸性和积炭特性等进行了研究.结果表明:Cu、Ni均为二甲醚水蒸气重整制氢的活性组分,Cu、Ni和γ-Al2O3之间存在着相互作用;镍的加入可以有效地提高铜组分在γ-Al2O3上的表面富集与分散,优化铜组分的分布状态,促进CuO颗粒的细小化,并可增强铜组分和载体之间的相互作用,有效地防止铜晶粒的团聚,从而提高催化剂的活性及稳定性;铜的加入可以改善催化剂中金属镍的分散性,减少镍颗粒的尺寸,降低催化剂对CH4的选择性,提高催化剂的H2产率,并在一定程度上抑制了积炭的形成与沉积.在350℃的温度下,反应进行100 h后,Cu-Ni/γ-Al2O3催化剂仍保持95%的二甲醚转化率,说明该催化剂具有较好的活性和稳定性.
铜;镍;氧化铝;二甲醚水蒸气重整;制氢;稳定性
近年来,为应对日益严峻的能源危机和环境污染,世界各国高度重视新能源的开发,而氢气作为清洁、高效的新能源载体已应用于移动和中小型静态燃料电池的发电.二甲醚(DME)是一种新型的替代能源[1],其含氢量高,无毒、无“三致”作用,环境友好;更为重要的是二甲醚的物性与液化石油气(LPG)相似,易于存储和运输,并可与现有的LPG基础设施相兼容[2].此外,以DME为原料的重整制氢技术具有能量密度高、温度低、无污染等特点.因此,该技术已经成为近期的研究热点[3-6].
二甲醚水蒸气重整制氢反应温度一般在250-400℃,该反应可分为两步进行[7],二甲醚先水解成甲醇,甲醇通过水蒸气重整,进而生成H2和CO2.
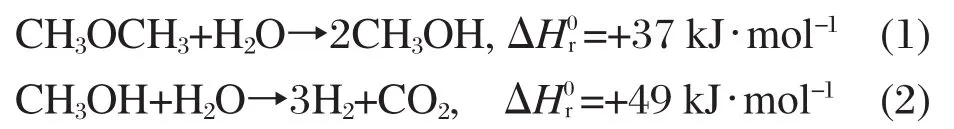
总的反应为
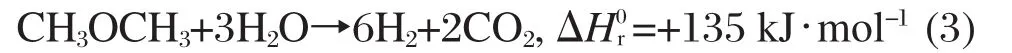
因而,二甲醚水蒸气重整制氢催化剂是一种双功能催化剂,其二甲醚水解与甲醇重整过程需要二甲醚水解催化剂和甲醇重整催化剂的协同作用.在催化剂中起水解作用的活性组分通常是γ-Al2O3[4,7-17]或各类分子筛[10-15,18-19],而起甲醇重整作用的活性组分主要有CuO[20]、CuO-ZnO[7,12,15,19-20]、CuB2O4(B=Fe, Mn,Cr,Ga,Al,Fe0.75Mn0.25)尖晶石态催化剂[9-11,13-14,16]、CuO-Cu1+xMn2-xO4(x=0.4,0.5)[21]、CuO-CeO2[5,22]以及CuO-Ga2O3和Ga2O3[23-24]等.迄今为止,关于二甲醚水蒸气重整制氢的研究基本上仍处于实验室阶段,大多数研究[8-11,13-16,18-19,21-22]是将重整活性组分同水解活性组分进行机械混合,研究重点依然是开发低温、高活性、高稳定性的催化剂.
众所周知,镍系催化剂价格低廉,且具有良好的抗烧结能力[25-26].负载型Cu-Ni催化剂已应用于甲烷裂解,甲醇、乙醇水蒸气重整等制氢反应[27-30],但是将其应用于DME水蒸气重整制氢的研究还未见报道.
本文在前期工作[8]的基础上,利用沉积-沉淀法一步制备了Cu-Ni/γ-Al2O3催化剂,并研究了其在DME水蒸气重整制氢过程中的催化性能.沉积-沉淀法避免了大多数研究中重整催化剂同水解催化剂的机械混合步骤,有利于催化剂大规模生产.在稳定性实验中,选择性地采取了进料中未加稀释气体的评价方法,所获得实验数据更有利于指导该催化剂的工业化生产和应用.
1 实验部分
1.1 催化剂的制备
Cu/γ-Al2O3、Ni/γ-Al2O3和Cu-Ni/γ-Al2O3催化剂(aCu-bNi-cAl2O3,其中 a、b、c分别为 Cu、Ni和 γ-Al2O3的摩尔比)采用沉积-沉淀法制备.将适量的γ-Al2O3粉末(纯度≥99%,温州氧化铝厂)分散于去离子水中,搅拌1 h得到悬浊液;取配制好的Cu(NO3)2· 3H2O、Ni(NO3)2·6H2O(分析纯,国药集团化学试剂有限公司)单一或混合溶液置于分液漏斗中,取适量Na2CO3(分析纯,国药集团化学试剂有限公司)溶液置于另一分液漏斗中,在不断搅拌下将两者并流滴加到上述悬浊液中,调节pH≈9.0,控制温度约为75℃,搅拌老化3 h,经过滤、洗涤至滤液呈中性,滤饼在110℃干燥12 h,500℃焙烧4 h.
1.2 催化剂的表征
催化剂的比表面积(BET)以及孔结构由ASAP 2020比表面及孔结构分析仪(美国Micromeritics公司)进行测试,约100 mg样品先在250℃脱气预处理4 h,然后在-196℃进行氮气的吸-脱附等温实验.
催化剂的X射线衍射(XRD)表征由日本理学D/ max 2550型X射线衍射仪测定,其操作条件为:Cu Kα射线,管电压40 kV,管电流100 mA,测量步长为0.02°,扫描范围为20°-80°,并利用Jade 6.5软件计算晶粒大小.
催化剂还原性能在自制的的程序升温还原(H2-TPR)装置上测定.将100 mg催化剂在40 mL·min-1氩气吹扫的条件下,以10℃·min-1的速率升温至120℃,恒温40 min,然后降至室温,并切换为10% H2-90%Ar混合气(40 mL·min-1),以10℃·min-1的速率升温至900℃,然后降至室温.消耗的H2用MAX300-LG质谱(美国Extrel公司)进行在线检测.
催化剂表面元素的化学组成和化学态用英国Kratos公司的Axis Ultra DLD型X射线光电子能谱(XPS)仪分析.使用Al Kα射线(1486.6 eV,150 W),在大约1.33×10-7Pa下收集XPS样品.所有窄扫描在分析仪80 eV通能下进行.XPS结合能用污染碳C 1s(284.8 eV)进行校正,以便于催化剂与标准化合物的对比.
催化剂的酸性质采用NH3程序升温脱附法(NH3-TPD)测定.将100 mg样品在20 mL·min-1He气吹扫下以20℃·min-1升温至550℃,并保持0.5 h;然后,在He气氛下降温至100℃,切换为NH3,待催化剂吸附饱和后,以He气吹扫去除物理吸附的NH3,再以20℃·min-1的速率升温至500℃.脱附出来的NH3用Omnistar-200型质谱(瑞士Balzers公司)进行在线检测.
催化剂的积炭在自制的程序升温氧化(TPO)装置上测定.将100 mg反应后的催化剂在40 mL· min-1氩气吹扫的条件下,以10℃·min-1的速率升温至120℃,恒温40 min,然后降温至室温,并切换为10%O2-90%Ar(体积分数)混合气(40 mL·min-1),以10℃·min-1的速率升温至500℃,然后降至室温.生成的CO2用MAX300-LG质谱(美国Extrel公司)进行在线检测.
催化剂的微观结构与形貌用透射电子显微镜(TEM)测试(日本电子公司JEM-2010/日立公司H 800),加速电压为200 kV.
1.3 催化剂的性能评价
DME水蒸气重整反应在常压固定床反应器(内径12 mm,高250 mm)内进行.催化剂的装填量均为2 g,两端填充同等粒径的石英砂.催化剂装填后先用10%H2-90%N2混合气在400℃下还原3 h,降温至350℃后,切换成原料气进行反应.二甲醚和N2平衡气的流量用质量流量计(美国Alicat公司)控制,水由恒流泵(北京四合创智科技有限公司)控制,经过110℃汽化后进入反应器;反应气体的组成为n(DME)∶n(H2O)∶n(N2)=12∶36∶60,或者n(DME)∶n(H2O)=21.6∶86.4.反应稳定(约1 h)后,取样分析.尾气经冷凝、干燥后进入Agilent7890型(美国Agilent公司)气相色谱仪进行分析.气相色谱仪包括三通道和三个检测器,用TCD(thermal conductivity detector)检测器、PoraPak Q柱和5A分子筛柱分析CO2、N2和CO;用另一TCD检测器和PoraPak Q柱分析H2;用FID(flame ionization detector)检测器和PoraPak Q柱分析DME、CH3OH、CH4.干尾气流量用皂沫流量计测量.DME的转化率(XDME)、H2的产率(YH2(mmol· g-1·h-1))以及C1气体产物的选择性(SC1)由以下公式进行计算:
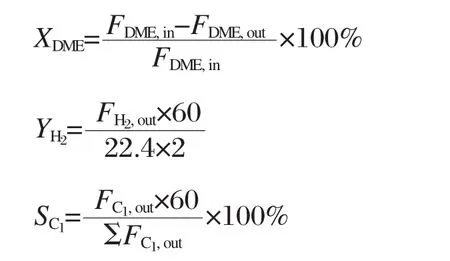
其中,FDME,in和FDME,out分别表示反应前后DME的体积流量,FH2,out表示H2的体积流量,FC1,out表示C1气体产物的体积流量(C1代表CO2、CO和CH4气体).
2 结果与讨论
2.1 催化剂的活性评价
2Cu-1Ni-5Al2O3、2Cu-5Al2O3和 1Ni-5Al2O3催化剂在二甲醚水蒸气重整制氢反应中,随温度变化的催化性能如图1所示.由图1(a)可知,当温度低于350℃时,2Cu-1Ni-5Al2O3具有较高的DME转化率;在温度高于350℃时,各催化剂的DME转化率均达到100%.当反应温度由300℃升至450℃后,再降至350℃时,2Cu-1Ni-5Al2O3和1Ni-5Al2O3仍能保持100%的DME转化率,而2Cu-5Al2O3的DME转化率显著下降,仅为50%左右.图1(b)是各种催化剂上H2的产率.可以看出,各种催化剂上H2的产率同DME转化率的变化趋势基本相同.2Cu-1Ni-5Al2O3在整个反应温度区间内均具有最高的H2产率,其最大值出现在反应温度为350℃的反应条件下,随着反应温度进一步升高,H2的产率略有降低.这可能是在高温下发生了DME的裂解和逆水气变换副反应[16],即
当反应经过300-450℃升温过程之后,再降温至350℃时,2Cu-5Al2O3上H2的收率约由50 mmol· g-1·h-1下降到11 mmol·g-1·h-1,其失活最为显著. 2Cu-1Ni-5Al2O3与2Ni-5Al2O3的H2收率比较稳定,且高于2Cu-5Al2O3.由此可见,镍的加入可以显著增强催化剂的热稳定性.
2.2 Ni/γ-Al2O3和Cu-Ni/γ-Al2O3催化剂的稳定性测试
为了进一步比较Cu-Ni/γ-Al2O3和Ni/γ-Al2O3在二甲醚水蒸气重整制氢反应中的稳定性,本文对这两种催化剂分别进行了30 h的稳定性测试(图2).在稳定性测试中,为了使反应条件更接近实际应用,原料气中未加入N2稀释气.由图2(a)可知,Cu-Ni/γ-Al2O3和Ni/γ-Al2O3均具有较高的DME转化率,反应30 h后,两种催化剂DME的转化率均未发生明显下降,具有较好的稳定性.从图2(b)还可看出,在30 h的稳定性测试中,2Cu-1Ni-5Al2O3的H2产率要远大于1Ni-5Al2O3,并且反应结束时未发生明显的下降.这说明2Cu-1Ni-5Al2O3的H2选择性优于1Ni-5Al2O3.表1中列出了反应稳定后,两种催化剂上反应产物中CO2、CO、CH4的选择性.可以看出,两种催化剂均具有较高的CO选择性.一般认为,在DME水蒸气重整制氢过程中的甲醇重整步骤包括甲醇分解和水气变换两个串联反应[31],即:
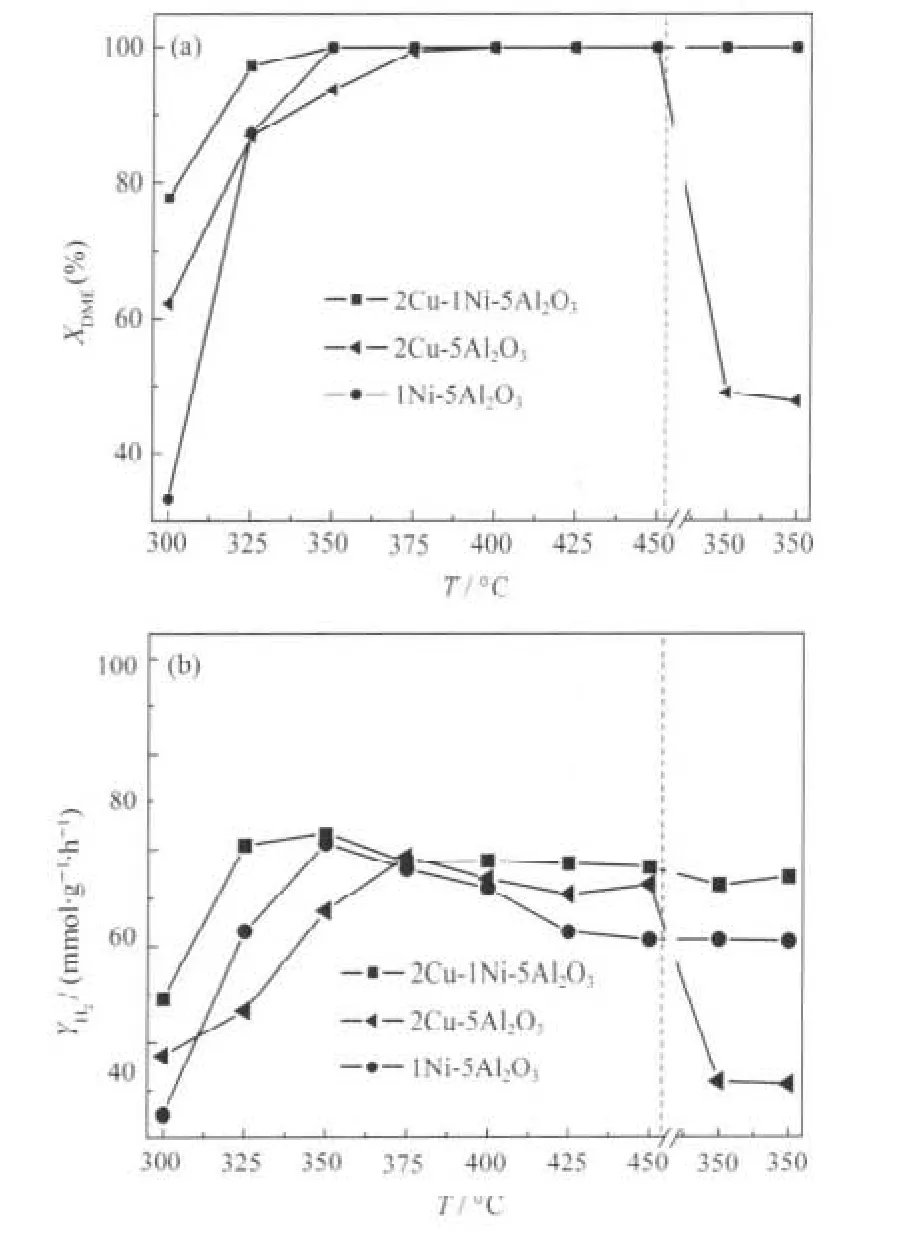
图1 不同催化剂在二甲醚水蒸气重整反应中的催化性能Fig.1 Catalytic activity of different catalysts on dimethyl ether steam reforming(DME SR)(a)XDME:DME conversion,(b)YH2:H2production rate.Flow rates of DME,H2O,and N2are 12,36,and 60 mL·min-1,respectively. Total gas flow rate is 3240 mL·g-1·h-1.mcatalyst=2 g,p=101.3 kPa

可见,催化剂中Ni的存在一定程度上抑制了水气变换反应.另外,1Ni-5Al2O3相对于2Cu-1Ni-5Al2O3具有较高的CH4选择性,这是由于1Ni-5Al2O3催化剂上发生了甲烷化反应:
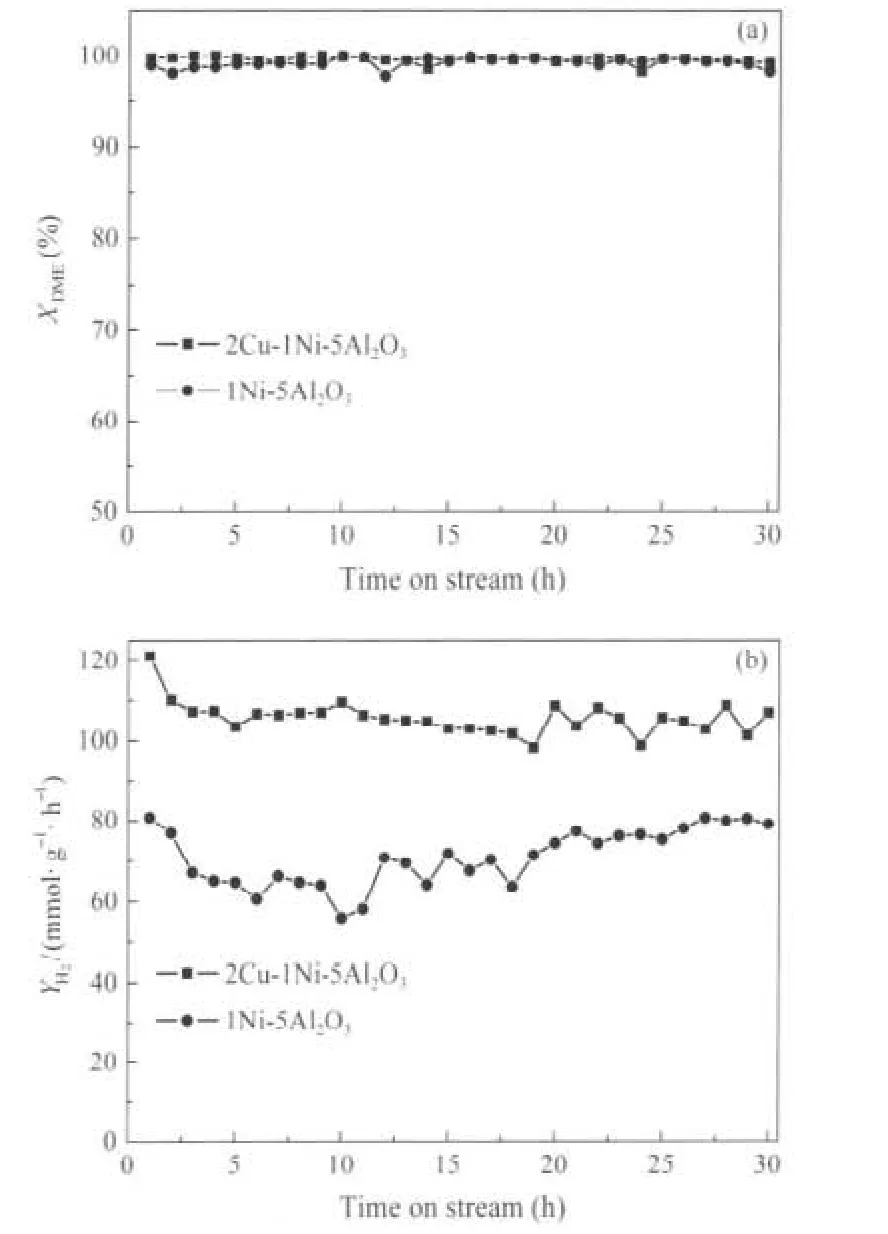
图2 2Cu-1Ni-5Al2O3和1Ni-5Al2O3在二甲醚水蒸气重整反应中的稳定性测试Fig.2 Durability test of 2Cu-1Ni-5Al2O3and 1Ni-5Al2O3catalysts on DME SRFlow rates of DME and H2O are 21.6 and 86.4 mL·min-1.Total gas flow rate is 3240 mL·g-1·h-1.mcatalyst=2 g,p=101.3 kPa,T=350℃

CH4的生成会占据大量的H原子,从而使H2产率下降.相比之下,2Cu-1Ni-5Al2O3具有较低的CH4选择性.可见,催化剂中Cu的存在可以抑制甲烷化反应的发生.同时,较高的CH4选择性会促进炭在催化剂表面的形成与沉积[32-33],不利于催化剂的稳定性.关于两种催化剂的积炭情况,本文将在后述的TPO表征中进行进一步的讨论.
目前,关于DME水蒸气重整制氢的研究中,仅有少数文献开展了催化剂稳定性的研究,进料中加入了惰性气体,并且测试时间也不超过 100 h.Nishguchi等[5]在气体空速为4526 mL·g-1·h-1(DME∶H2O∶7.1%N2/H的体积比为2.3∶8.1∶16.0)的反应条件下,对CuO/CeO2-WO3/ZrO2催化剂进行了100 h的稳定性测试,结果显示,反应结束时H2的收率由30 mmol·g-1·h-1下降到约20 mmol·g-1·h-1.Tanaka等[16]在反应温度为400℃,进料气体空速为3000 h-1(气体组成(体积分数)分别为15%DME,60%H2O和15%N2)的反应条件下,对Cu2Mn1Fe3-γ-Al2O3催化剂进行了100 h的稳定性测试,反应结束时催化剂的活性未有明显下降.Fukunaga等[13]在反应温度为380℃,进料气体的空速为2000 h-1的反应条件下,对CuMn2O4-γ-Al2O3进行了100 h的稳定性测试,在反应时间内该催化剂保持了较高的DME转化率.本实验在反应温度为350℃,气体空速为3240 mL· g-1·h-1(DME:H2O的体积比为21.6∶86.4)的反应条件下,对2Cu-1Ni-5Al2O3催化剂进行了100 h的稳定性测试(图3).由图3可知,该催化剂具有较好的稳定性,能够在未加惰性稀释气的情况下稳定反应100 h,且没有出现明显的失活,反应结束时,DME的转化率保持在95%左右.另外,从图3中还可以看出各种产物气体的浓度随时间的变化.在最初3 h的反应时间内,H2和CO2的浓度略有下降,而CO的浓度略有上升,这是由于反应过程中水气变换反应(式(6))逐步被抑制所造成的.在整个反应过程中,产物中CH4的浓度较为平稳,基本上保持在2%-3%.由此可见,2Cu-1Ni-5Al2O3催化剂在DME水蒸气重整制氢过程中具有优异的稳定性,而具体原因将在催化剂表征中得到进一步的揭示.
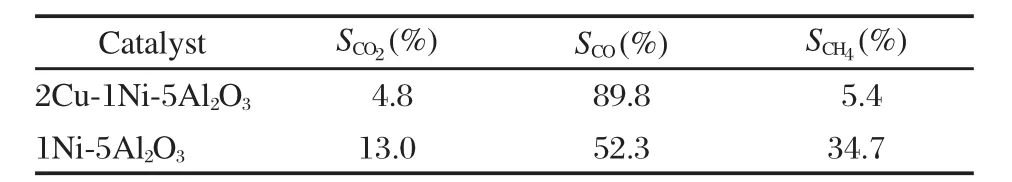
表1 2Cu-1Ni-5Al2O3和1Ni-5Al2O3催化剂在二甲醚水蒸气重整制氢反应中的C1气体产物的选择性(S)Table 1 C1products selectivity(S)of 2Cu-1Ni-5Al2O3 and 1Ni-5Al2O3on DME SR
2.3 催化剂的表征
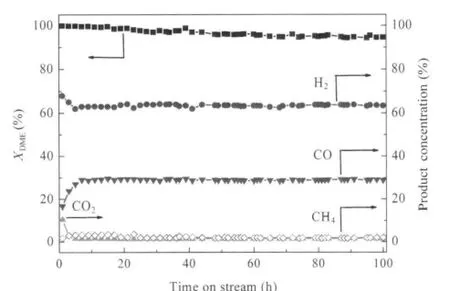
图3 2Cu-1Ni-5Al2O3在二甲醚水蒸气重整反应中100 h稳定性测试Fig.3 100 h durability test of 2Cu-1Ni-5Al2O3catalyst on DME SRReaction conditions are the same as those in Fig.2.
2.3.1 催化剂的织构性质
催化剂的BET比表面积及孔结构的其它参数见表2.可以看出,载体γ-Al2O3具有最大的比表面积、孔容及孔径.当载体上负载金属以后,金属氧化物附着在载体表面或沉积在微孔中,使催化剂的比表面积、孔容及孔径均有不同程度的降低.
2.3.2 催化剂的物相结构
催化剂的XRD图谱见图4.由图4(a)可知,2Cu-1Ni-5Al2O3和2Cu-5Al2O3催化剂的谱图中分别出现了CuO和γ-Al2O3的特征峰,且前者CuO衍射峰峰形更为弥散,这说明前者中CuO微晶的尺寸较小.此外,通过拟合也发现,2Cu-1Ni-5Al2O3和 2Cu-5Al2O3中CuO晶粒尺寸分别为6.4和8.8 nm.可见,镍的加入可以促进CuO颗粒的细小化,为反应提供更多的铜活性位,进而提高催化剂在反应中的催化活性和选择性.在2Cu-1Ni-5Al2O3和1Ni-5Al2O3催化剂的衍射图谱中,均未出现NiO的特征衍射峰,这说明NiO以高分散态存在.
30和100 h稳定性测试后的2Cu-1Ni-5Al2O3的XRD图谱如图4(b)所示.由图可知,反应后催化剂的图谱中均出现了金属铜的特征衍射峰,两者的峰形与峰强没有明显差异.经过拟合可知,30和100 h稳定性测试后Cu中微晶的颗粒尺寸分别为15.5和16.9 nm.可见,在后续的70 h反应过程中,2Cu-1Ni-5Al2O3中铜晶粒几乎没有进一步长大.由此也证明,2Cu-1Ni-5Al2O3具有良好的抗烧结性能.其原因可以归结如下:一方面,由于镍的加入可以有效地促进CuO晶粒的细小化,这在一定程度上防止了铜晶粒的团聚;另一方面,可能由于镍的加入增强了铜组分和载体之间的相互作用,抑制了铜晶粒的热迁移.该原因将会结合催化剂的H2-TPR和TEM表征,进一步加以说明.
另外,需要指出的是,经过稳定性测试后,2Cu-1Ni-5Al2O3出现了比较明显的金属铜的衍射峰,但是并未出现镍和氧化镍的特征衍射峰.这可能是由于镍与铜以及镍和载体之间存在着相互作用,使得NiO以高分散态存在.
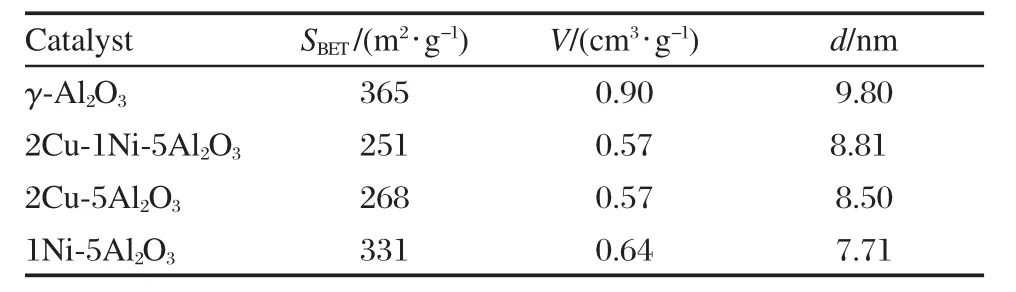
表2 催化剂的织构性质Table 2 Textural properties of different catalysts
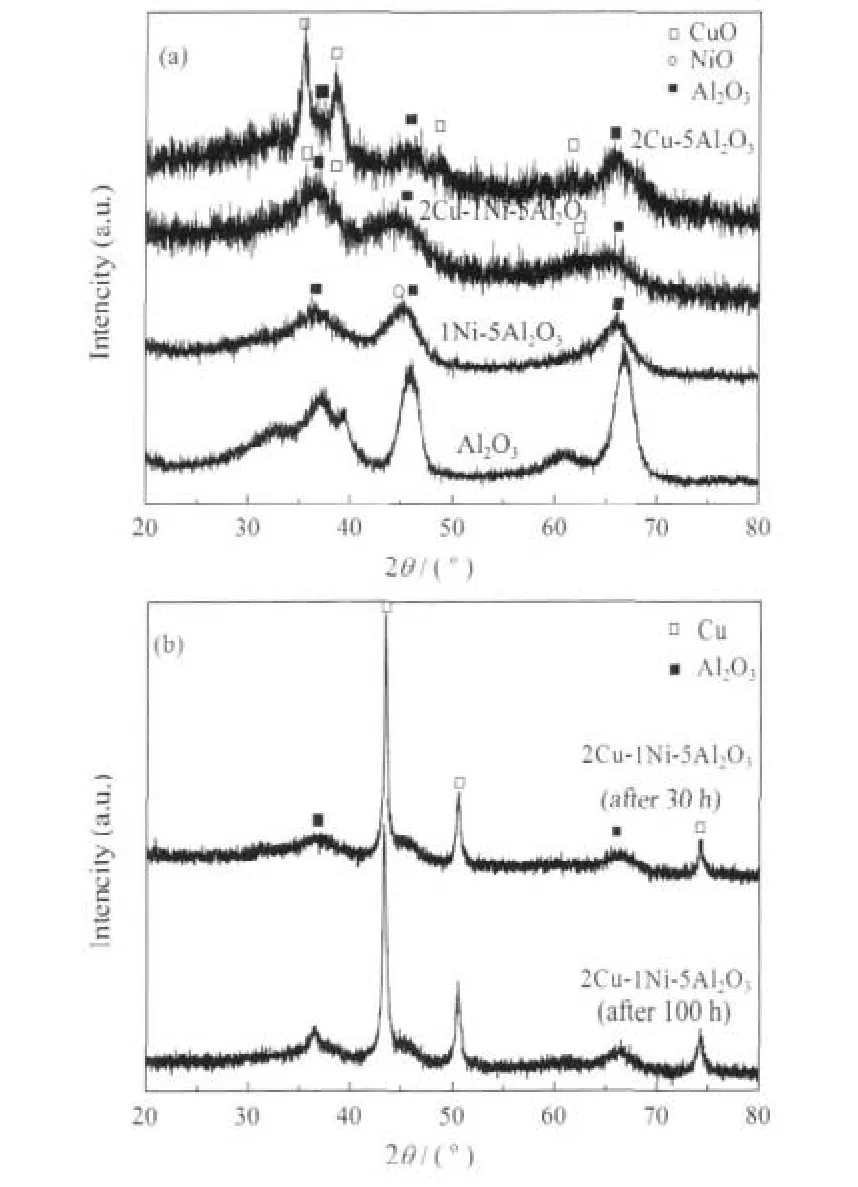
图4 催化剂的XRD图谱Fig.4 XRD patterns of different catalysts(a)before reaction,(b)after reaction(30 h and 100 h)
2.3.3 催化剂的还原性能
催化剂的H2-TPR曲线如图5所示.由图可知, 2Cu-1Ni-5Al2O3和2Cu-5Al2O3催化剂分别在204和190℃附近有一个还原峰,该还原峰归属于CuO的还原.为了进一步了解铜组分在两种催化剂的形态分布,分别对图中的H2还原峰进行分峰拟合,并将所得结果列于表3中.
结合相关报道[29,34-37],认为在H2-TPR图谱中,低温还原峰(α)可能是高分散的CuO还原峰,而高温还原峰(β)则对应体相较难还原的CuO的还原峰.由H2-TPR图谱可以看出,2Cu-1Ni-5Al2O3中高分散的CuO的含量要远大于体相CuO的含量,而对于2Cu-5Al2O3,高分散CuO的含量要小于体相CuO的含量,这说明2Cu-1Ni-5Al2O3中活性组分的分布状态要优于2Cu-5Al2O3.由表3可知,2Cu-5Al2O3催化剂的α、β峰分别在172和186℃处,而2Cu-1Ni-5Al2O3催化剂的两个还原峰分别升高至201和216℃.这与文献[25]的研究结果相一致,表明2Cu-1Ni-5Al2O3中铜和γ-Al2O3存在着相互作用,这种相互作用,抑制了铜晶粒的热迁移,使得铜颗粒在还原和反应的过程中不易长大.综上所述,镍的加入可优化活性组分铜的分布状态,增强铜组分和载体之间的相互作用,有效地防止活性组分铜的团聚,进而提高催化剂的活性及稳定性,延长催化剂的使用寿命,而前述的活性测试结果也证实了这一点.
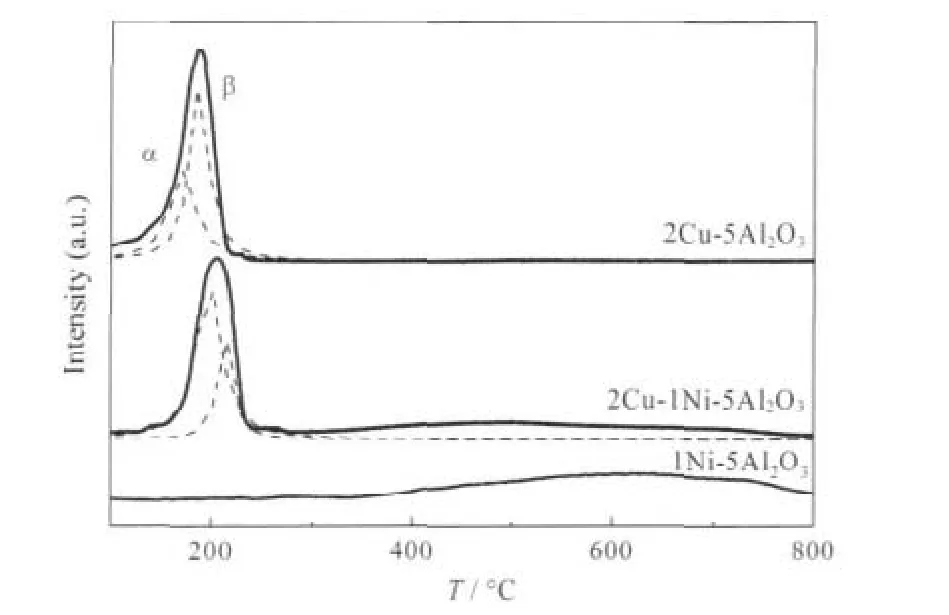
图5 催化剂的H2-TPR图谱Fig.5 H2-TPR profiles of different catalysts peak α:reduction of dispersed CuO species;peak β:reduction of bulk CuO species
另外,对于2Cu-1Ni-5Al2O3和1Ni-5Al2O3催化剂在350-650℃较宽的温度范围内还有一个还原峰,该峰应归属于NiO的还原.
2.3.4 催化剂表面元素的化学组成和化学态分析
图6为催化剂的XPS图谱.由图6(a)可以看出,未添加Ni的催化剂其Cu 2p3/2和Cu 2p1/2的峰均为单峰,对应的电子结合能分别为934.3和954.5 eV,并且在939-944 eV处出现Shake-up伴峰,该伴峰是Cu物种以CuO状态存在的主要特征,说明Cu主要以Cu2+的形式存在[38-39].添加Ni后两峰没有发生明显的偏移.另外,由图6(b)可以看出,未添加Cu的催化剂其Ni 2p3/2和Ni 2p1/2的峰均为单峰,对应的电子结合能分别为854.4和871.9 eV,说明Ni主要以Ni2+的形式存在[40].添加Cu后Ni 2p3/2和Ni 2p1/2的结合能均有所增加,这说明Cu的添加促进了Ni和载体之间的相互作用[41].
根据XPS的半定量方法原理,可计算2Cu-5Al2O3、1Ni-5Al2O3和2Cu-1Ni-5Al2O3表面Cu和Ni的原子个数百分比,其数据见表4.由表4可以看出, 2Cu-5Al2O3表面Cu的含量低于制备时Cu的平均含量,但2Cu-1Ni-5Al2O3表面Cu的含量略高于制备时Cu的平均含量.这说明Ni的加入可以促进Cu在γ-Al2O3表面的富集[30],这与H2-TPR的表征结果是一致的.另外,从表4还可以看出,1Ni-5Al2O3表面Ni的含量远大于制备时Cu的平均含量,说明Ni多富集于载体的表面,但是Cu的加入使2Cu-1Ni-5Al2O3表面的Ni含量由27.8%降至9.4%,说明Cu的加入促使Ni占据γ-Al2O3的体相位置[42],从而降低了Ni在γ-Al2O3表面的含量.
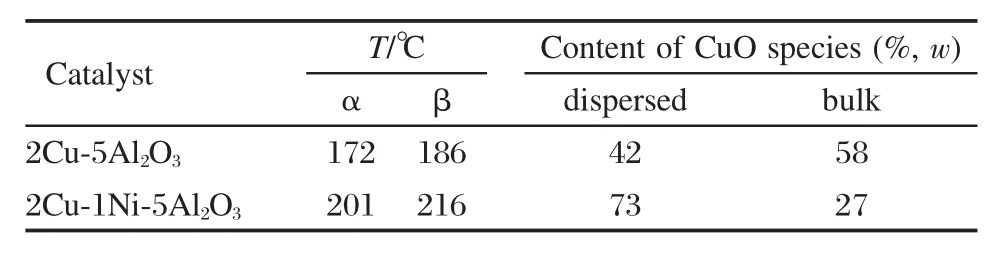
表3 催化剂的还原温度及催化剂中各CuO物种的含量Table 3 Reduction peak temperature and content of CuO species of different catalysts
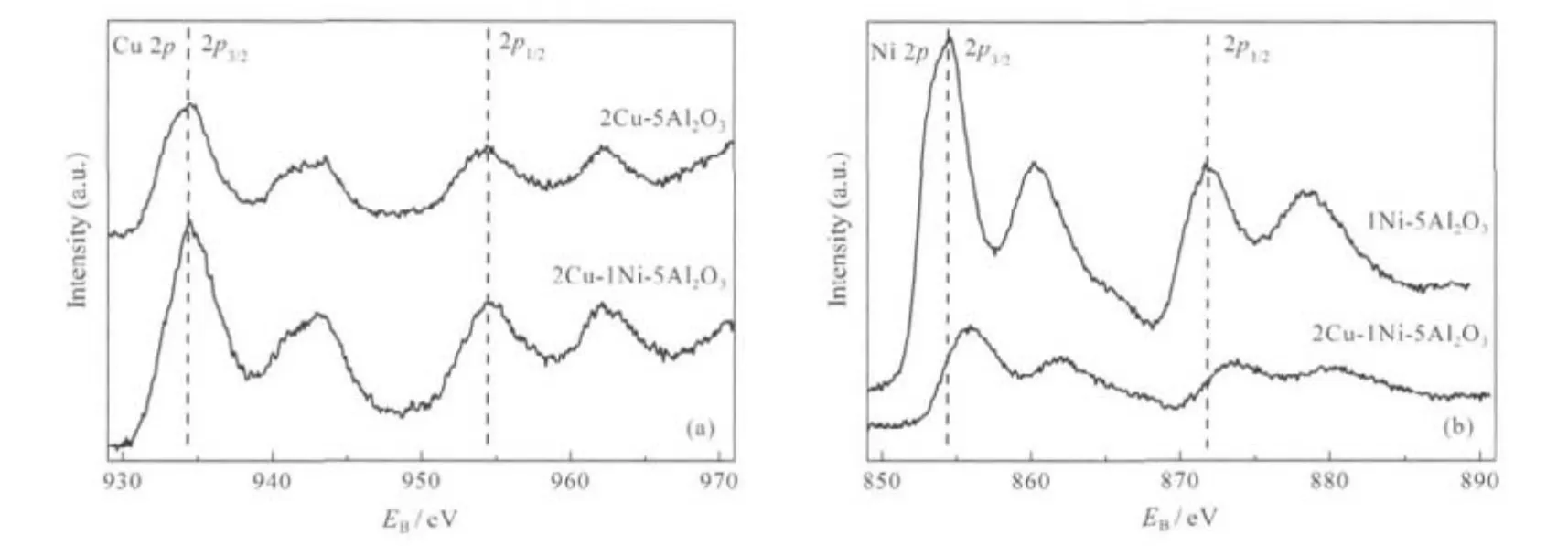
图6 不同催化剂表面上Cu 2p和Ni 2p的XPS图谱Fig.6 XPS patterns of Cu 2p and Ni 2p on the surface of different catalysts
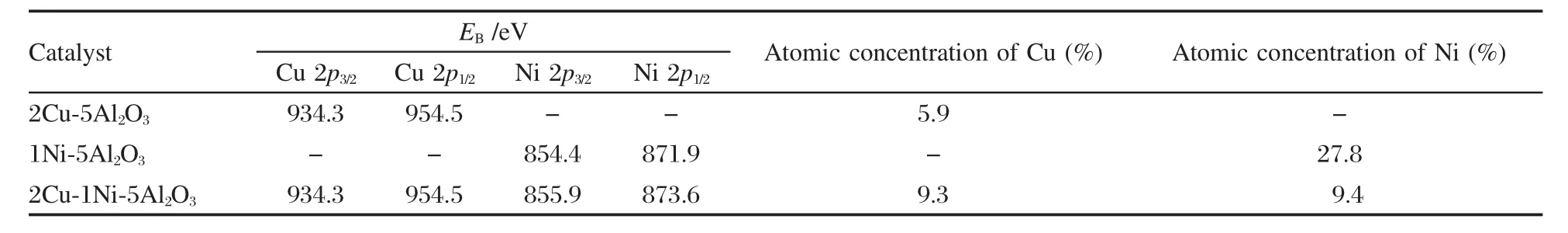
表4 不同催化剂的XPS分析结果Fig.4 XPS results of different catalysts
2.3.5 催化剂的表面酸性
2Cu-1Ni-5Al2O3和1Ni-5Al2O3催化剂的NH3-TPD图谱见图7.脱附峰的峰面积与酸中心数成正比,而峰温与酸中心的强度有关,峰温越高,酸中心越强.由图7可以看出,两种催化剂均在150-400℃范围出现NH3的脱附峰,且2Cu-1Ni-5Al2O3的脱附峰的峰顶温度和峰面积均低于1Ni-5Al2O3,说明前者的酸性位强度和数量均低于后者,因而推断Cu的加入调变了催化剂的表面酸性.
2.3.6 催化剂的积炭分析
30 h稳定性测试后的2Cu-1Ni-5Al2O3和1Ni-5Al2O3的TPO图谱如图8所示.可以看出,两种催化剂在100-500℃均出现了CO2的生成峰,并且在这两处还检测到H2O信号,说明两种催化剂上均有含氢炭物种的形成与沉积.同时,一些研究也表明[42-44],在酸性载体的金属催化剂上,表面炭既可沉积在金属部位,也可沉积在酸性部位,而且大部分炭都沉积在酸性部位;金属部位上的炭在低温下(350℃左右)燃烧,而酸性部位上的炭需要在高温下(480℃左右)燃烧.由图8可知,2Cu-1Ni-5Al2O3的CO2生成峰面积较小,温度较低(150-300℃),说明该催化剂上的碳物种的含量比较少,结构也比较简单,可以将其归结于DME在重整、裂解过程中形成的小分子含碳物种(如CH4、·CH3等)的氧化[42,45],且该碳物种应沉积于金属部位.与此不同的是,1Ni-5Al2O3的CO2生成峰的温度较高(200-500℃),峰形较宽,面积较大(经过积分可知,其面积约为2Cu-1Ni-5Al2O3的2.1倍),说明1Ni-5Al2O3上的碳物种的含量更多,结构更为复杂,该生成峰应归结于催化剂上的小分子碳物种以及由小分子碳物种进一步聚合而形成的聚合物的氧化[42,45],且该碳物种多沉积于催化剂的酸性部位.该聚合物还有可能随着反应时间的延长逐渐累积和钝化,覆盖催化剂的活性位,并最终导致催化剂的失活.结合前面的NH3-TPD表征可知,铜的加入可以调变催化剂的表面酸性,使催化剂的金属功能和酸性功能更好地匹配,并可改善催化剂中金属Ni的分散性,减少Ni颗粒的大小[29],并抑制CH4的生成[46],从而显著减少或抑制积炭的形成与沉积,提高了催化剂的抗积炭性能.
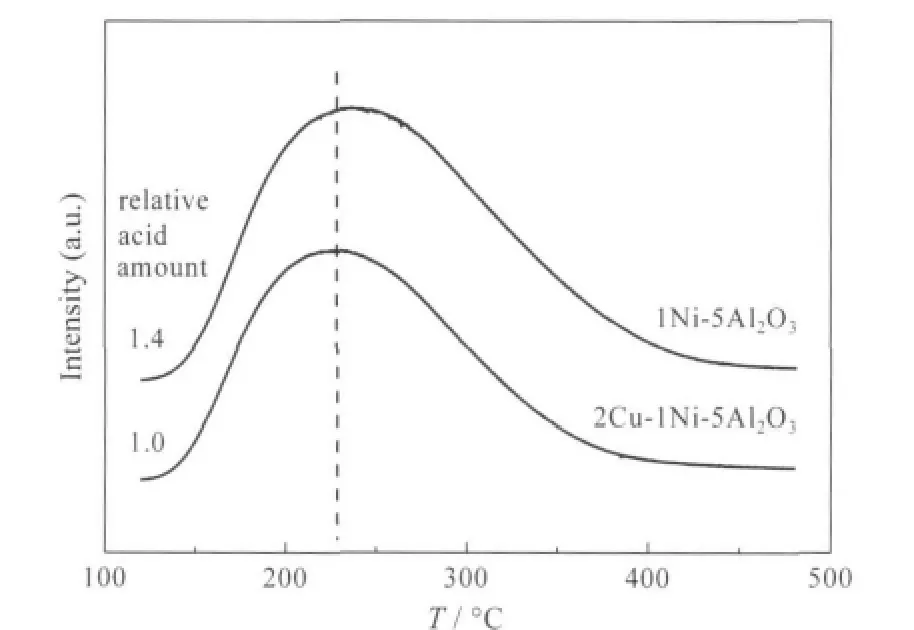
图7 2Cu-1Ni-5Al2O3和1Ni-5Al2O3催化剂的NH3-TPD图谱Fig.7 NH3-TPD profiles of 2Cu-1Ni-5Al2O3and 1Ni-5Al2O3catalysts

图8 2Cu-1Ni-5Al2O3和1Ni-5Al2O3催化剂的TPO图谱Fig.8 TPO profiles of 2Cu-1Ni-5Al2O3and 1Ni-5Al2O3catalysts
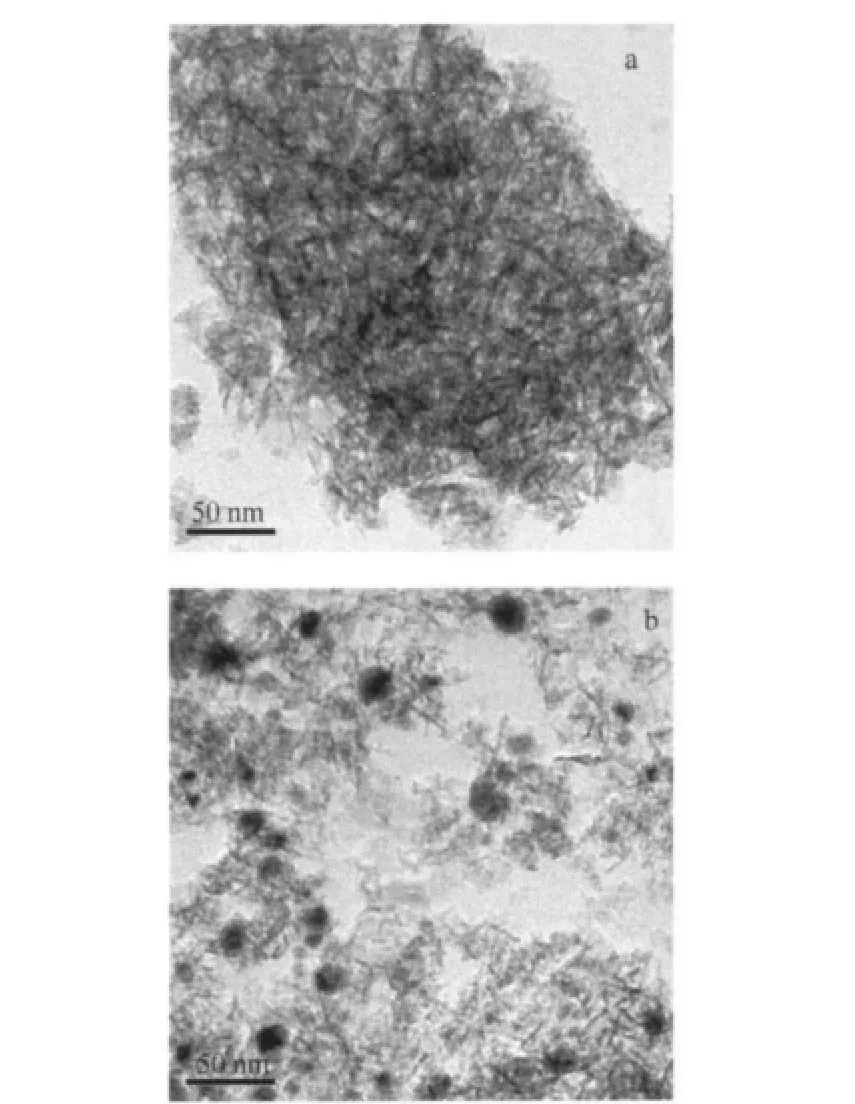
图9 2Cu-1Ni-5Al2O3催化剂的TEM图谱Fig.9 TEM images of 2Cu-1Ni-5Al2O3catalysts(a)after reduction,(b)after 100 h reaction
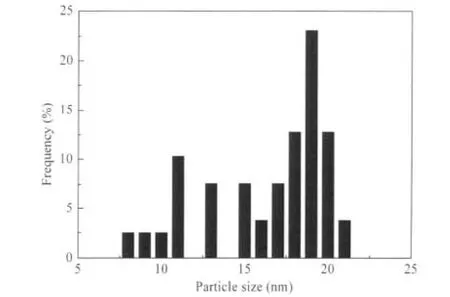
图10 基于TEM测试的反应后催化剂中金属Cu颗粒粒径分布Fig.10 Cu particle size distribution of catalyst after reaction based on TEM results
2.3.7 催化剂的形貌分析
100 h稳定性测试前后2Cu-1Ni-5Al2O3催化剂形貌的TEM表征结果如图9所示.从图9可以看出,还原后的新鲜催化剂中γ-Al2O3的孔道结构清晰可见,并且金属颗粒分布比较均匀,反应后金属颗粒的轮廓更加清晰,且彼此相互隔离,说明金属颗粒具有较好的分散性,且反应过程中没有发生明显的团聚与烧结.图10中给出了Cu的粒径分布,可以看出反应后催化剂中Cu粒径主要分布在10-20 nm范围,这与催化剂稳定性测试结果以及XRD表征中铜晶粒的计算结果是一致的.
3 结论
将Cu-Ni/γ-Al2O3双功能催化剂用于DME水蒸气重整制氢反应,取得了较好的效果.在反应温度为350℃,气体空速为3240 mL·g-1·h-1条件下,反应进行100 h,催化剂保持了95%以上的DME转化率,具有较好的催化活性和稳定性.铜、镍均为DME水蒸气重整制氢的活性组分,镍的加入可以有效地提高铜组分在γ-Al2O3表面的富集与分散,优化铜组分的分布状态,促进CuO颗粒的细小化,并可增强铜组分和载体之间的相互作用,有效地防止铜晶粒的团聚,从而提高催化剂的活性及稳定性,延长催化剂的使用寿命.此外,镍的加入还在一定程度上抑制了水气变换反应,使得Cu-Ni/γ-Al2O3具有较高的CO选择性.铜的加入可以改善催化剂中金属镍的分散性,减少镍颗粒的尺寸,降低催化剂对CH4的选择性,提高了催化剂的H2产率,并在一定程度上抑制催化剂表面积炭的形成与沉积.
1 Semelsberger,T.A.;Borup,R.L.;Greene,H.L.J.Power Sources, 2006,156(2):497
2 Wang,X.L.;Ren,K.W.;Lin,R.;Pan,X.M.;Ma,J.X.Nat.Gas. Chem.Ind.,2008,33(3):65 [王晓蕾,任克威,林 瑞,潘相敏,马建新.天然气化工,2008,33(3):65]
3 Park,S.J.;Lee,D.W.;Yu,C.Y.;Lee,K.Y.;Lee,K.H. J.Membrane Sci.,2008,318(1-2):123
4 Galvita,V.V.;Semin,G.L.;Belyaev,V.D.;Yurieva,T.M.; Sobyanin,V.A.Appl.Catal.A-Gen.,2001,216(1):85
5 Nishguchi,T.;Oka,K.;Matsumoto,T.;Kanai,H.;Utani,K.; Imamara,S.Appl.Catal.A-Gen.,2006,301(1):66
6 Zou,J.J.;Zhang,Y.P.;Liu,C.J.J.Power Sources,2007,163(2): 653
7 Nilsson,M.;Pettersson,L.J.;Lindström,B.Energ.Fuel,2006,20 (5):2164
8 Wang,X.L.;Pan,X.M.;Lin,R.;Ren,K.W.;Kou,S.Y.;Ma,J.X. Acta Phys.-Chim.Sin.,2009,25(6):1097 [王晓蕾,潘相敏,林瑞,任克威,寇素原,马建新.物理化学学报,2009,25(6):1097]
9 Faungnawakij,K.;Shimoda,N.;Fukunaga,T.;Kikuchi,R.; Eguchi,K.Appl.Catal.A-Gen.,2008,341(1-2):139
10 Faungnawakij,K.;Tanaka,Y.;Shimoda.N.;Fukunaga,T.; Kawashima,S.;Kikuchi,R.;Eguchi,K.Appl.Catal.A-Gen.,2006, 304(1):40
11 Faungnawakij,K.;Tanaka,Y.;Shimoda,N.;Fukunaga,T.; Kikuchi,R.;Eguchi,K.Appl.Catal.B-Environ.,2007,74(1-2): 144
12 Semelsberger,T.A.;Ott,K.C.;Borup,R.L.;Greene,H.L.Appl. Catal.A-Gen.,2006,309(2):210
13 Fukunaga,T.;Ryumon,N.;Shimazu,S.Appl.Catal.A-Gen., 2008,348(2):193
14 Faungnawakij,K.;Kikuchi,R.;Matsui,T.;Fukunaga,T.;Eguchi, K.Appl.Catal.A-Gen.,2007,333(1):114
15 Semelsberger,T.A.;Ott,K.C.;Borup,R.L.;Greene,H.L.Appl. Catal.B-Environ.,2006,65(3-4):291
16 Tanaka,Y.;Kikichi,R.;Takeguchi,T.;Eguchi,K.Appl.Catal.BEnviron.,2005,57(3):211
17 Yamada,Y.;Mathew,T.;Ueda,A.;Shioyama,H.;Kobayashi,T. Appl.Surf.Sci.,2006,252(7):2593
18 Matsumoto,T.;Nishiguchi,T.;Kanai,H.;Utani,K.;Matsumura, Y.;Imamura,S.Appl.Catal.A-Gen.,2004,276(1-2):267
19 Kawabata,T.;Matsuoka,H.;Shishido,T.;Li,D.L.;Tian,Y.; Sano,T.;Takehira,K.Appl.Catal.A-Gen.,2006,308(10):82
20 Takeishi,K.;Suzuki,H.Appl.Catal.A-Gen.,2004,260(1):111
21 Ren,K.W.;Wang,X.L.;Pan,X.M.;Lin,R.;Ma,J.X.Nat.Gas. Chem.Ind.,2009,34(1):1 [任克威,王晓蕾,潘相敏,林 瑞,马建新.天然气化工,2009,34(1):1]
22 Oka,K.;Nishiguchi,T.;Kanai,H.;Utani,K.;Imamura,S.Appl. Catal.A-Gen.,2006,309(2):187
23 Mathew,T.;Yamada,Y.;Ueda,A.;Shioyama,H.;Kobayashi,T. Appl.Catal.A-Gen.,2005,286(1):11
24 Mathew,T.;Yamada,Y.;Ueda,A.;Shioyama,H.;Kobayashi,T.; Gopinath,S.Appl.Catal.A-Gen.,2006,300(1-2):58
25 Xu,J.K.;Ren,K.W.;Wang,X.L.;Zhou,W.;Pan,X.M.;Ma,J. X.Acta Phys.-Chim.Sin.,2008,24(9):1568 [徐军科,任克威,王晓蕾,周 伟,潘相敏,马建新.物理化学学报,2008,24(9): 1568]
26 Rogatis,L.D.;Montini,T.;Lorenzut,B.;Fornasiero,P.Energ. Environ.Sci.,2008,1:501
27 Li,J.Z.;Lu,G.X.;Li,K.;Wang,W.P.J.Mol.Catal.A-Chem., 2004,221(1-2):105
28 Mariňo,F.;Boveri,M.;Baronetti,G.;Laborde,M.Int.J.Hydrogen Energ.,2001,26(7):665
29 Zhang,B.C.;Li,Y.;Cai,W.J.;Tang,X.L.;Xu,Y.D.;Shen,W.J. Chin.J.Catal.,2006,27(7):567 [张保才,李 勇,蔡伟杰,唐晓兰,徐奕德,申文杰.催化学报,2006,27(7):567]
30 Hierl,R.;Knozinger,H.;Urbach,H.J.Catal.,1981,69(2):475
31 Santacesaria,E.;Carrà,S.Appl.Catal.A-Gen.,1983,5:345
32 Bradford,M.C.J.;Vannice,M.A.J.Catal.,1998,173(1):157
33 Schurman,Y.;Marquez-Alvarez,C.;Kroll,V.C.H.Catal.Today, 1998,46(2-3):185
34 Xu,R.;Ma,Z.Y.;Yang,C.;Wei,W.;Sun,Y.H.Acta Phys.-Chim.Sin.,2002,19(5):423 [徐 润,马中义,杨 成,魏 伟,孙予罕.物理化学学报,2002,19(5):423]
35 Jun,K.W.;Shen,W.J.;Rao,K.S.R.;Lee,K.W.Appl.Catal.AGen.,1998,174(1-2):231
36 Wang,Y.J.;Wang,X.L.;Xie,G.Q.;Lu,J.Q.;Jin,W.Y.;Liu,X. J.;Luo,M.F.Chin.J.Catal.,2004,29(5):482 [王月娟,王雪俐,谢冠群,鲁继青,金炜阳,刘西敬,罗孟飞.催化学报,2004,29 (5):482]
37 Li,Z.;Zheng,H.Y.;Xie,K.C.Chin.J.Catal.,2008,29(5):431 [李 忠,郑华艳,谢克昌.催化学报,2008,29(5):431]
38 Chang,S.S.;Lee,H,J.;Park,H.J.Cream Int.,2005,31:411
39 Suo,J.;Liu,L.F.;Yang,F.L.Chin.J.Catal.,2009,34(4):323 [索 静,柳丽芬,杨凤林.催化学报,2009,34(4):323]
40 Naghash,A.R.;Etsell,T.H.;Xu,S.Chem.Mater.,2006,18:2480
41 Tang,S.;Ji,L.;Lin,Y.J.;Zeng,H.C.;Tan,K.L.;Li,K.J.Catal., 2000,194(2):424
42 Wang,Y.;Ma,A.Z.;Pan,J.C.;Liu,C.J.Mole.Catal.,2003,17 (2):151 [汪 莹,马爱增,潘锦程,刘 辰.分子催化,2003,17 (2):151]
43 Pieck,C.L.;Vera,C.R.;Querini,C.A.;Parera,J.M.Appl.Catal. A-Gen.,2005,278(1):173
44 Barbier,J.Appl.Catal.A-Gen.,1986,23:225
45 Xuan,D.;Shen,X.C.;Lou,H.;Zheng,X.M.J.Zhejiang Unvi., 2007,34(5):541 [宣 东,沈晓春,楼 辉,郑小明.浙江大学学报,2007,34(5):541]
46 Xu,J.K.;Li,Z.J.;Wang,J.H.;Zhou,W.;Ma,J.X.Acta Phys.-Chim.Sin.,2009,25(2):253 [徐军科,李兆静,汪吉辉,周 伟,马建新.物理化学学报,2009,25(2):253]
September 16,2009;Revised:November 30,2009;Published on Web:January 27,2010.
Dimethyl Ether Steam Reforming for Hydrogen Production over Cu-Ni/γ-Al2O3Bi-Functional Catalyst
WANG Xiao-Lei1,2PAN Xiang-Min2,3LIN Rui2,3KOU Su-Yuan2,3ZOU Wei-Bing2,4MA Jian-Xin2,3,*
(1School of Environmental Science and Engineering,Tongji University,Shanghai 200092,P.R.China;2Clean Energy Automotive Engineering Center,Tongji University,Shanghai 201804,P.R.China;3School of Automotive Studies,Tongji University, Shanghai201804,P.R.China;4Shool of Resource and Environmental Engineering,East China University of Science and Technology,Shanghai200237,P.R.China)
Cu/γ-Al2O3,Ni/γ-Al2O3,and Cu-Ni/γ-Al2O3catalysts were prepared using the deposition-precipitation method and the catalytic performances for hydrogen production during dimethyl ether steam reforming(DME SR)were investigated.The structure and surface characteristics of these catalysts were analyzed by Brunauer-Emmett-Teller (BET),X-ray diffraction(XRD),H2temperature-programmed reduction(H2-TPR),X-ray photoelectron spectroscopy (XPS),NH3temperature-programmed desorption(NH3-TPD),temperature-programmed oxidation(TPO),and transmission electron microscopy(TEM).It was revealed that both copper and nickel were active components during DME SR and there were interactions among Cu,Ni,and γ-Al2O3.Nickel addition improved copper dispersion to obtain small copper crystallites,and strengthened the interaction between copper and γ-Al2O3so as to prevent copper agglomeration. Copper addition also improved nickel dispersion and the smaller nickel particle size suppressed CH4formation,which prevented coke formation.Therefore,Cu-Ni/γ-Al2O3with superior catalytic activity and stability was obtained.During 100 h durability testing,the Cu-Ni/γ-Al2O3maintained about 95%DME conversion and did not show obvious deactivation.
Copper;Nickel;Alumina;Dimethyl ether steam reforming;Hydrogen production;Stability
[Article] www.whxb.pku.edu.cn
*Corresponding author.Email:jxma@tongji.edu.cn;Tel:+86-21-69589480;Fax:+86-21-69589121.
The project was supported by the Tongji University and Shell Hydrogen LLC International Cooperation Project(20071193).
同济大学-壳牌公司国际合作项目(20071193)资助
O643
