离子液体-水混合溶剂中Cr2O3纳米片的制备
2010-11-27孟艳艳廖辉伟贾金等
孟艳艳,廖辉伟,张 敏,贾金等,姜 珊,郑 敏
(西南科技大学材料科学与工程学院,中国 绵阳 621000)
目前,过渡金属氧化物以其独特的性能在材料学与物理学方面有着重要的应用,而纳米三氧化二铬因其表面效应和量子效应,呈现出特殊的理化性质——耐热、耐光、耐化学腐蚀,可用作无机颜料[1],具有磁性和高的硬度,可用作磁性材料或磁记录材料的研磨剂[2],也可用作有机合成的催化剂[3]等.目前制备纳米三氧化二铬的方法主要有溶胶-凝胶法[4]、水热还原法[5]、固相法[6]、沉淀和热解法[7]、机械化学法[1]、微波等离子法[8]等.
离子液体又称低温熔融盐,具有在空气和水中稳定、不挥发、低配位等特点,目前作为一种绿色溶剂在有机合成领域中得到了广泛的应用[9-11].近年来,离子液体因其独特的物理化学性质,在无机纳米材料的制备中也得到了广泛的应用,Pt[12]、TiO2[11]、CuO[13]、PbO[14]、V2O5[15]等纳米材料在离子液体中的制备已有最新报道,但是在离子液体-水混合溶剂中制备纳米Cr2O3的研究至今未见报道.
本文以CrCl3·6H2O和NaOH为原料,离子液体-水混合溶剂为反应介质,采用低温溶剂热法成功地合成了Cr2O3纳米片,同时比较了传统水热法与离子液体-水混合溶剂热法制备纳米Cr2O3的工艺,进一步证实了离子液体作为溶剂的良好性能.
1 实验部分
1.1 试剂及仪器
甲基咪唑(C4N2H6),六水合三氯化铬(CrCl3·6H2O),氢氧化钠(NaOH),氯代正丁烷(C4H9Cl),四氟硼酸钠(NaBF4),丙酮(C3H6O),二氯甲烷(CH2Cl2),无水氯化钙(CaCl2)均为分析纯,甲基咪唑和氯代正丁烷使用前经减压蒸馏提纯.荷兰帕纳科公司,X’PertPRO型X射线衍射仪;英国Ieica公司,S440扫描电镜;美国尼高力仪器公司,Nicolet-5700型红外吸收光谱仪;德国耐驰公司,STA2449C型综合热分析仪.
1.2 中间体[BMIM]Cl的制备
在装有搅拌器、回流冷凝管、温度计和氮气导管的三口瓶中加入N-甲基咪唑与氯代正丁烷(摩尔比1.2∶1),通氮气保护,磁力搅拌,70 ℃回流反应48 h,顶端接含有无水CaCl2的干燥管,静置分层得到淡黄色粘稠液体,用少量乙酸乙酯反复洗涤,然后用旋转蒸发仪减压蒸馏,除去未反应的氯代正丁烷和乙酸乙酯.
1.3 离子液体[BMIM]BF4的制备
在装有回流冷凝管的100 mL单口烧瓶中,加入等摩尔的纯[BMIM]Cl与NaBF4,以丙酮作溶剂,于45 ℃下磁力搅拌48 h,砂芯漏斗减压抽虑,滤液50 ℃下减压蒸馏,以除去溶剂丙酮,加入适量的二氯甲烷,析出白色固体,减压抽滤收集滤液后,减压蒸馏除二氯甲烷,得到亮黄色油状液体.
1.4 Cr2O3纳米片的制备
取3.9 g六水合三氯化铬溶于15 mL水,配制15 mL的5 mol/L氢氧化钠溶液,在磁力搅拌下将三氯化铬水溶液缓慢滴加到氢氧化钠溶液中,分别加入适量的蒸馏水和离子液体,继续搅拌5~10 min,混合均匀后,将反应物注入内衬聚四氟乙烯高压反应釜内,密封,在140~180 ℃下溶剂热处理24 h,离心分离,收集固体粉末,分别用去离子水和无水乙醇交替洗涤数次,然后置于真空干燥箱内60 ℃干燥,得暗绿色粉末.
2 结果与讨论
2.1 Cr2O3晶体结构表征及分析
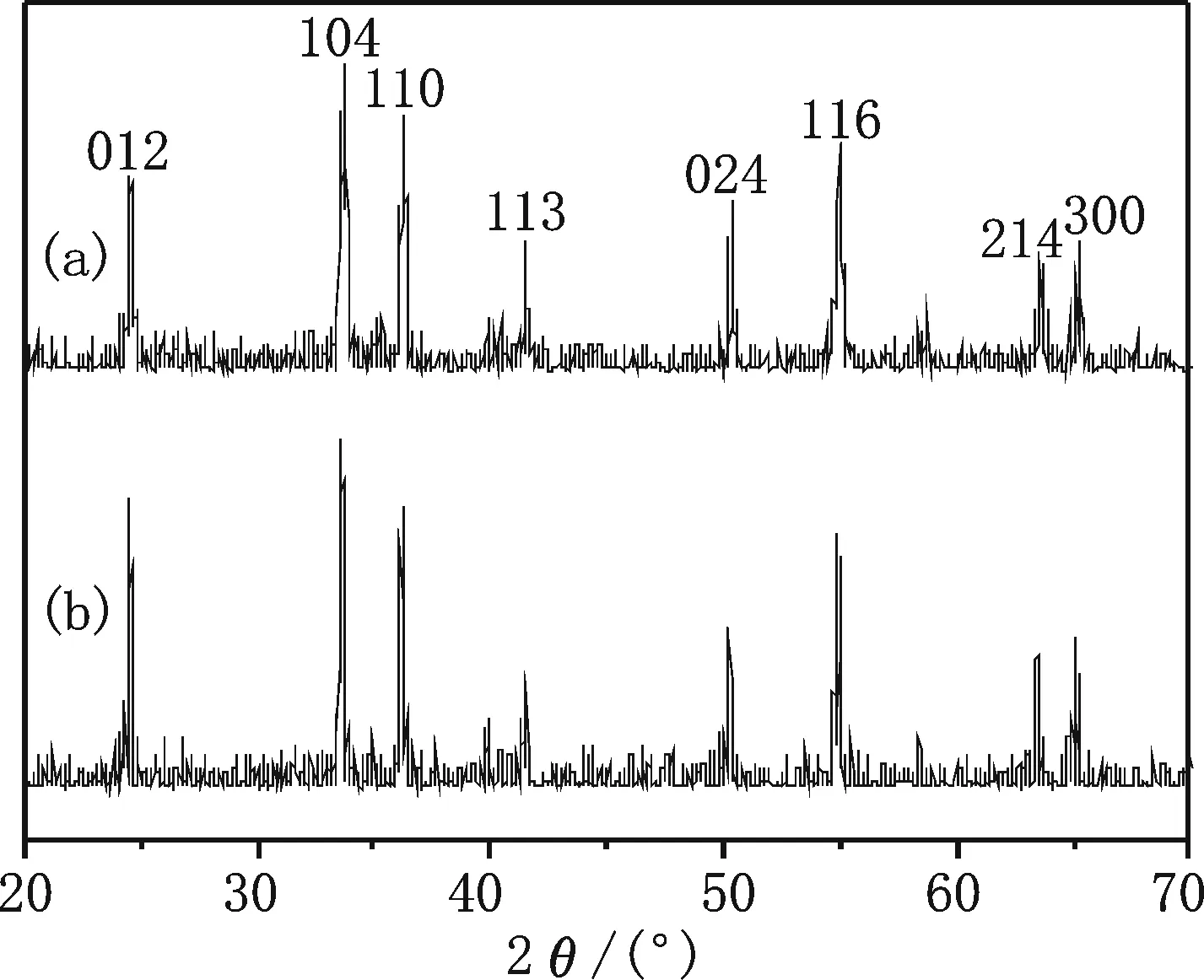
(a)混合溶剂中Cr2O3的XRD图谱;(b)水溶液中Cr2O3的XRD图谱图1 Cr2O3的XRD图谱
图1a、b分别是在混合溶剂、水溶液中制得的产物的XRD图谱,峰的位置与标准PDF卡片38-1479的特征峰位基本吻合,峰型尖锐,结晶性良好,并且没有其他杂峰,表明在两种溶剂中制备的产物都是纯的物质,所得晶体为六方晶系三氧化二铬,晶胞参数为a=b=4.960 41 nm,c=13.597 41 nm,α=β=90°,γ=120°(PDF卡片38-1479晶胞参数为a=b=4.595 nm,c=13.594 nm,α=β=90°,γ=120°).从谱图观察到,特征衍射峰都出现了明显的宽化,由于X射线衍射峰宽化是纳米材料的特性之一,表明所制备的Cr2O3晶体尺寸较小.
2.2 Cr2O3晶体形貌表征及分析
图2是制备的氧化铬纳米片的SEM图,其中a、b分别是在水溶液、 [BMIM]BF4-H2O混合溶液制备的样品,反应温度为180 ℃,反应时间为24 h.图2(a)产物纳米片较厚,厚度大概为50 nm,边缘片状结构有破裂.图2(b)是在[BMIM]BF4-H2O反应介质中的产物,与前者相比,所得产物的三维尺度明显减少,平均厚度大概为5~10 nm,形貌完整,但是有少量粒状颗粒附在其上,片状结构有层叠,导致堆积在一起.
图3是在不同温度下的混合溶剂中所得的产物形貌,由图3(a)可以看出,是形状规则的六面体块状结构,厚度约为20~40 nm,块状大小不均;图3(b)则是由中心向四周发散的片状聚集体,片状结构表面凹凸不平,有清晰的纹路出现,形状不规则;图3(c)是在200 ℃下反应的产物,产物较分散,既有块状结构又有片状结构,其表面较光滑,其中片状结构相比(b)来说,厚度有所减少,形状为规则的四边形,旁边的块状结构厚度则明显增加.

(a) (b)(a)水溶液中的产物形貌;(b)混合溶液中的产物形貌图2 不同溶剂中Cr2O3的SEM图

(a) (b) (c)(a)140 ℃下的产物形貌;(b)160 ℃下的产物形貌;(c)200 ℃下的产物形貌图3 混合溶剂中不同反应温度下Cr2O3的SEM图
2.3 红外光谱分析
图4b是包裹有离子液体的产物的红外谱图,所得产物2 965、2 878 cm-1为烷基链上C—H键伸缩振动吸收带,在1 470、1 385 cm-1处有微弱的吸收峰,这两处对应的是离子液体中烷基的弯曲振动吸收峰,表明样品的表面有离子液体的存在,由于经过多次洗涤,离子液体并没有被完全洗去,这表明离子液体与纳米粒子之间并不是简单的物理包夹作用.此外常规Cr2O3颗粒的特征吸收峰为619 568 cm-1(vas(Cr—O))[7],而离子液体包裹的Cr2O3的纳米片的特征吸收峰只在527 cm-1处出现,这可能与溶剂效应有关,从而进一步证实了离子液体与纳米粉体存在较强的吸附作用.另外,在3 428 cm-1处有明显的水峰出现,这与离子液体强吸水性有关.
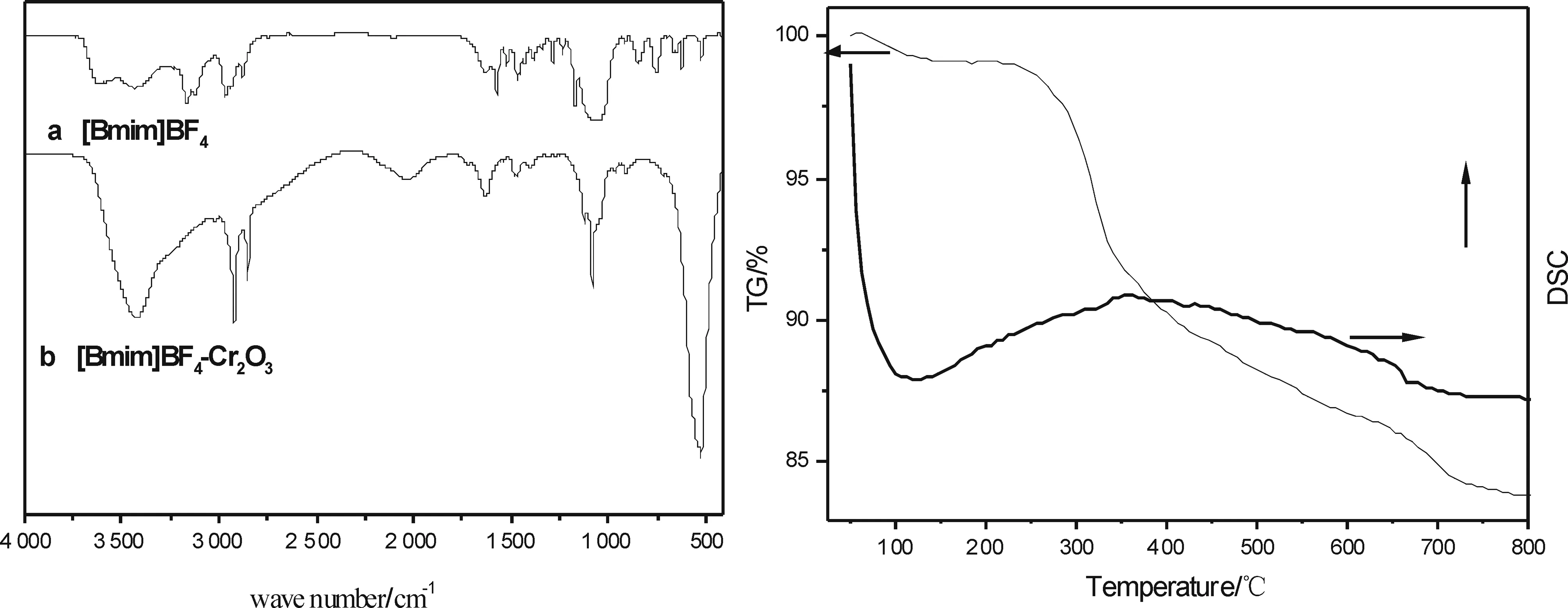
(a)[Bmim]BF4的红外谱图;(b) [Bmim]BF4-Cr2O3的红外谱图 图4 离子液体的红外谱图 图5 Cr2O3的TG/DSC曲线
2.4 TG/DSC分析
图5是Cr2O3的TG/DSC曲线,从DSC曲线可以看出,在320~480 ℃之间有一个缓慢的放热过程,对应的TG曲线有一个失重台阶,失重率大约为16%.这与纯离子液体[BMIM]BF4的分解温度较接近,表明在Cr2O3纳米片表面确实有离子液体有机修饰层的存在,离子液体总质量约占所制备样品16%.此外,通常有机物表面修饰纳米微粒的分解温度都低于200 ℃,而[BMIM]BF4修饰的Cr2O3纳米片分解温度可达320 ℃,这大大提高了材料的热稳定性,将拓宽材料的适用温度范围.TG曲线在100 ℃附近出现轻微的失重,对应的DTA曲线有一处明显的吸热峰,由于离子液体具有较强的吸水性,这应归属于离子液体中表面少量吸附水的脱附.另外DTA曲线在680 ℃出现一个小的放热峰,而对应的TG曲线并没有相应的失重率,可能是由于Cr2O3在晶型转变过程中的放热所致.
3 机理分析
3.1 水热反应机理
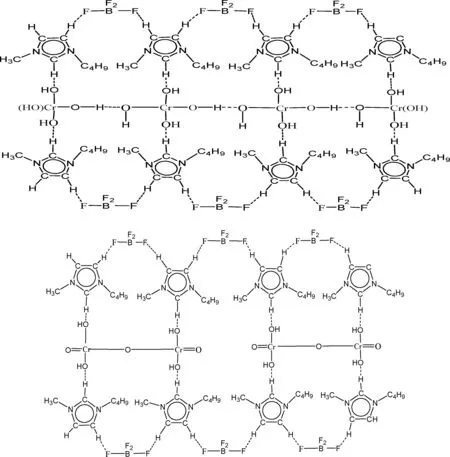
图6 反应机理示意图
Cr3+的配位数几乎都是6,通常以d2sp3杂化轨道成键,Cr3+的配合物有多种异构体存在,且配合物稳定性较高,在水溶液中不易发生解离反应或离解程度较小,但是在水热环境的高温高压下,配合物可缓慢离解出Cr3+,然后与溶液中的OH-结合.Cr3+的d轨道电子构型是3d3,形成的Cr3—OH酸性较低,易形成具有平面状结构的Cr3+四聚集体[Cr4O(OH)12(OH2)4]0[18],四聚集体反应活性很低,Cr3+的扩散速率大于四聚集体的形成速率,所以大部分Cr3+仍以离子状态游离在水热环境中,四聚集体随着反应温度的不断升高,最终脱水离解为Cr2O3,在水溶液中,最稳定的化合物当属三价的Cr2O3,至此结束一个反应单元.在四聚集体解离的过程中,伴随着新的四聚集体的生成,然后再解离,直至水溶液中大部分游离的Cr3+最终以稳定的Cr2O3形式存在.但是在反应过程中四聚集体由于其较低的反应活性,其解离速度显然小于其形成速度,并且完全离解的电解质将随温度的升高而重新聚合,所以会出现四聚集体团聚现象,继而影响Cr2O3纳米结构的形貌,这与观察到的SEM图像基本吻合.
3.2 混合溶剂热反应机理
反应过程如图6所示.在一定的温度、压强和极性极高的离子液体环境中,铬配合物会较快的离解出Cr3+,在强碱性环境下首先生成亮绿色的配合物[Cr(OH4)]-.阳离子[BMIM]BF4以氢键相连形成网状结构[19],[Cr(OH4)]-配合物吸附在其上,形成了带有铬离子的大分子平面网状结构单元.在溶剂热条件下,脱除层间以氢键相连的水,并离解为稳定的Cr2O3结构.离子的扩散与溶液的黏度呈反比,离子液体本身具有较高的黏性,而且通过离子液体大分子链的空间位阻和电性排斥作用避免了粉体之间的相互团聚.
4 结论
以不同溶剂为介质,制备了六方晶相相结构的Cr2O3纳米片.比较了水、离子液体-水混合溶剂中Cr2O3形貌,表明在混合溶剂中制备的纳米材料的形貌更均匀、有序.探讨了Cr2O3纳米片形成的过程和机理.Cr2O3在离子液体中自组装合成纳米片,离子液体发挥了模板剂的作用,阻止了新生相的团聚.
参考文献:
[1] TSUZUKI T, MCCORMICK P G. Synthesis of Cr2O3nanoparticles by mechanochemical prosessing [J]. Acta Materialia, 2000, 48: 2 795-2 801.
[2] 马文英, 方佑龄, 赵文宽. 相转移法制备超微粒子氧化铬 [J]. 无机盐工业, 1993, 5: 11-13.
[3] 邓鹏图, 田德余, 赵文宽. 超细三氧化二铬的制备方法: 中国, 1165782A[P]. 1997-05-18.
[4] 邓 双, 李会泉, 张 懿. 纳米Cr2O3的制备、表征及催化性能 [J]. 无机化学学报, 2003, 19(8): 825-829.
[5] 张 鹏, 曹宏斌, 徐红彬, 等. 水热还原法制备超细氧化铬及粒径调控 [J]. 过程工程学报, 2007, 7(1): 95-99.
[6] 张西军, 袁 伟. 固相法制备Cr2O3微粒子 [J]. 北京化工大学学报, 2002, 29(1): 71-74.
[7] 周立群, 王弛伟, 杨念华. Cr2O3纳米粉体的合成及性能研究 [J]. 武汉大学学报(理学版),2005, 51(14): 407-409.
[8] VOLLATH D, SICKAFUS K E. Synthesis of nanosized ceramic oxide powders by microwave plasma reactions [J]. Nanostructured Materials (UK), 1992, 1(5): 427-437.
[9] WELTON T. Room-temperature ionic liquids: Solvents for synthesis and catalysis [J]. Chemical Reviews, 1999, 99(8): 2 071-2 083.
[10] KUMAR A. Salt effects on Diels-Alder reaction kinetics [J]. Chemical Reviews, 2001, 101(1): 1-19.
[11] WASSERSCHEID P, KEIM W. Ionic liquids—new “solution” for transition metal catalysis [J]. Angewandte Chemie International Edition, 2000, 39(21): 3 772-3 789.
[12] SCHEEREN C W, MACHADO G, TEIXEIRA S R,etal. Synthesis and characterization of Pt(0) nanoparticles in imidazolium ionic liquids [J]. Journal of Physical Chemistry B,2006, 110: 13 011-13 020.
[13] SINGH P, KATYAL A, KALRA R,etal. Copper nanoparticles in an ionic liquid: an efficient catalyst for the synthesis of bis-(4-hydroxy-2-oxothiazolyl)methanes [J]. Tetrahedron Letters, 2008, 49: 727-730.
[14] CHEN L J, ZHANG S M, WU Z S,etal. Preparation of PbS type PbO nanocrystals in a room-temperature ionic liquid [J]. Materials Letters, 2005, 39: 3 119-3 121.
[15] MOHAMMAD A Z, HALA K F. Sol-gel synthesis of vanadium pentoxide nanoparticles in air-and water-stable ionic liquids [J]. Journal of Materials Science Letters, 2009, 44: 1 363-1 373.
[16] 高金森, 王 鹏, 董 坤, 等. 氯化烷基咪唑离子液体分子结构和红外光谱的模拟计算 [J]. 石油学报(石油加工), 2006, 22(1): 72-75.
[17] RIKA H, YASUHIKO I. Room temperature ionic liquids of alkylimidazolium cations and fluoroanions [J]. Journal of Fluorine Chemistry, 2000, 105: 221-227.
[18] 施尔畏, 陈之战, 元如林, 等.水热结晶学 [M]. 北京:科学出版社, 2004.
[19] DONG K, ZHANG S J, WANG D X,etal. Hydrogen bonds in imidazolium ionic liquids [J]. Journal of Physical Chemistry A,2006, 110:9 775-9 778.
