育珠蚌不同组织基因组DNA提取质量比较
2010-11-27彭本英许巧情
彭本英,金 敏,章 乐,许巧情
(长江大学动物科学学院,湖北 荆州 434025)
育珠蚌不同组织基因组DNA提取质量比较
彭本英,金 敏,章 乐,许巧情
(长江大学动物科学学院,湖北 荆州 434025)
利用饱和酚-氯仿法分别提取了三角帆蚌(Hyriopsiscumingii)6个组织斧足、鳃、闭壳肌、性腺、肝脏、心脏中的基因组DNA,并采用紫外分光光度法、琼脂糖凝胶电泳、PCR扩增法分析了三角帆蚌不同组织基因组DNA的提取效果。结果表明:三角帆蚌6个组织均能成功地提取基因组DNA,但6个组织提取的DNA质量存在差异,斧足中提取的DNA纯度、浓度最高,PCR扩增条带最亮,因而是三角帆蚌提取DNA的最佳组织,其次为斧足和闭壳肌、心脏和性腺提取的DNA较差。
三角帆蚌(Hyriopsiscumingii);基因组DNA;组织;提取质量
三角帆蚌(Hyriopsiscumingii)是我国淡水珍珠养殖主要蚌源,养殖历史悠久、产量高、成珠质量好。随着珍珠养殖的不断深入,由于不规范的增养殖措施,如使用近源亲本、苗种培育不科学、忽视养殖病害等[1],使得三角帆蚌种质退化、育珠期缩短、产珠质量明显下降。为防止三角帆蚌种质退化,提高三角帆蚌产珠性能,保证淡水珍珠的品质,利用分子生物学手段对三角帆蚌的遗传多样性和群体亲缘关系进行分析,为选种、育种提供基础数据是非常必要和极其重要的。DNA提取是进行相关研究工作的基础,对三角帆蚌分子生物学研究具有重要参考价值。目前关于三角帆蚌基因组DNA已有研究[2,3],但尚无对各个组织DNA提取效果进行比较的报道。
1 材料与方法
1.1 样本来源及处理
2008年7月28日在湖北省荆州市江陵县采集三角帆蚌10只,将蚌放入清水中暂养1周。解剖三角帆蚌,分别取斧足、心脏、鳃、闭壳肌、肝脏、性腺等6个组织,用灭菌的剪刀将各个组织剪成小块,称取重均为(20±2) mg的组织,用于基因组DNA的提取。分别取3只蚌的6个组织设置平行试验组。
1.2 样本DNA的提取
将三角帆蚌各个组织分别置于2 mL匀浆器中,加入540 μL HB(10 mmol/L Tris-HCl,pH 8.0,100 mmol/L EDTA),在冰上将各个组织充分匀碎后,将所有液体吸入2 mL EP管中,加入60 μL 10% 十二烷基磺酸钠和20 μL 10 mg/mL的蛋白酶K,于55 ℃水浴锅中消化至裂解液变澄清。
裂解液分别用等体积的酚∶ 氯仿∶异戊醇(25∶24∶1)抽提2次,加入2倍体积的无水乙醇离心沉淀DNA,用70%的乙醇清洗2次后置于滤纸上晾干,加入50 μL TE缓冲液(pH 8.0),4 ℃冰箱放置过夜,让DNA充分溶解。
1.3 DNA纯度、浓度及得率的计算
取适量DNA稀释后,以TE为对照,在德国Eppendorf分光光度仪(BioPhotometer)上测定其在260 nm、280 nm和230 nm波长处的光密度。DNA的纯度可以从D260/D280比值来判断。按下述公式分别计算DNA浓度和得率:DNA浓度(μg/μL)=D260×n(稀释倍数)×50 (μg/mL)÷1 000;得率(μg/g)=DNA量(μg)/样品量(g)。
1.4 DNA的PCR扩增
选用三角帆蚌的看家基因β-actin对所提取的DNA进行PCR扩增,检测DNA提取效果。PCR反应条件为:94 °C预变性5 min后;按照94 °C变性30 s,56 °C退火30 s,72 °C延伸1.0 min的循环参数运行25个循环;最后72 °C延伸10 min终止反应。反应体积20 μL,组成如下:5 ng DNA模板,10 μmol引物各1 μL,2.5 mmol/L dNTP 2 μL,10×buffer 2.5 μL,Blend Taq酶 (Fermentas公司) 0.25 μL,补足H2O 至20 μL。PCR产物在含溴化乙锭的1.5%琼脂糖凝胶中电泳分离。用凝胶成像系统(White/Ultraviolet Transilluminator GDS8000型,UVP公司)记录扩增产物条带。
三角帆蚌β-actin引物为武汉博杰公司合成,序列为:F/R: CCGTGTTTCCATCCATCGT/CAGGACTGGGTGCTCTTCA。
1.5 数据处理
采用Statistica统计软件中Duncan’s多重比较进行差异显著性检验,结果用平均值±标准差(Mean±SD)表示。
2 结果与分析
2.1 三角帆蚌不同组织DNA提取电泳结果
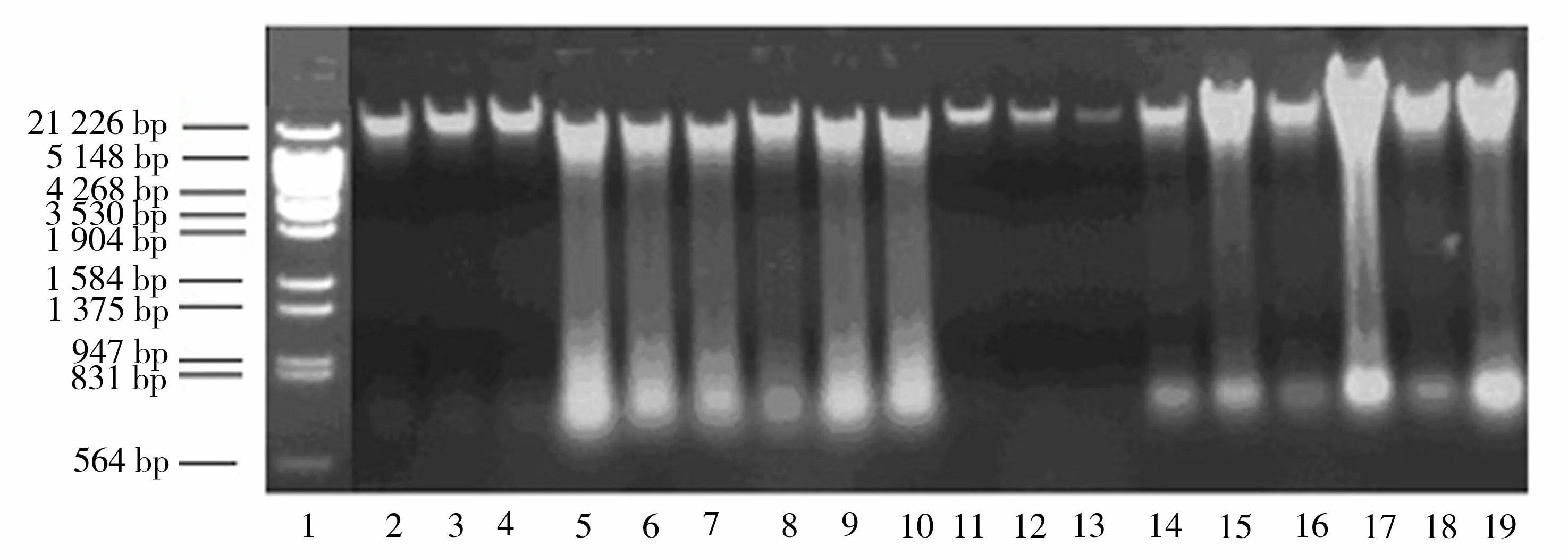
1:λ DNA Hind Ⅲ/Kpn Ⅰ 双酶切(bp);2~4:斧足;5~7:鳃;8~10:闭壳肌;11~13:性腺;14~16:肝脏;17~19:心脏图1 三角帆蚌不同组织DNA提取效果电泳图Figure 1 DNA Electrophoresis in different tissues of Hyriopsis cumingii
三角帆蚌斧足、鳃、闭壳肌、性腺、肝脏和心脏等6个组织均能提取较高质量的DNA,其中以斧足的提取效果最好,基因组DNA很完整,无拖尾现象,且浓度较高。性腺组织提取的DNA也无拖尾现象,但DNA的亮度较低。鳃、闭壳肌、肝脏和心脏等4个组织提取的DNA均有拖尾现象出现(图1)。
2.2 不同组织DNA纯度和得率比较
三角帆蚌6个组织提取的基因组DNA的纯度均较高,6个组织所测DNA的D260/D280值均在1.8~2.0之间。但不同的组织提取的基因组DNA浓度存在明显地差异,其中肝脏、心脏、斧足和闭壳肌等4个组织提取的DNA浓度较高,鳃和性腺中DNA浓度较低(表1)。

表1 三角帆蚌不同组织基因组DNA 纯度和得率比较Table 1 Extraction DNA purity and extraction rate in different tissues of Hyriopsis cumingii
注:同行不同小写字母表示组织间差异显著(Plt;0.05)。
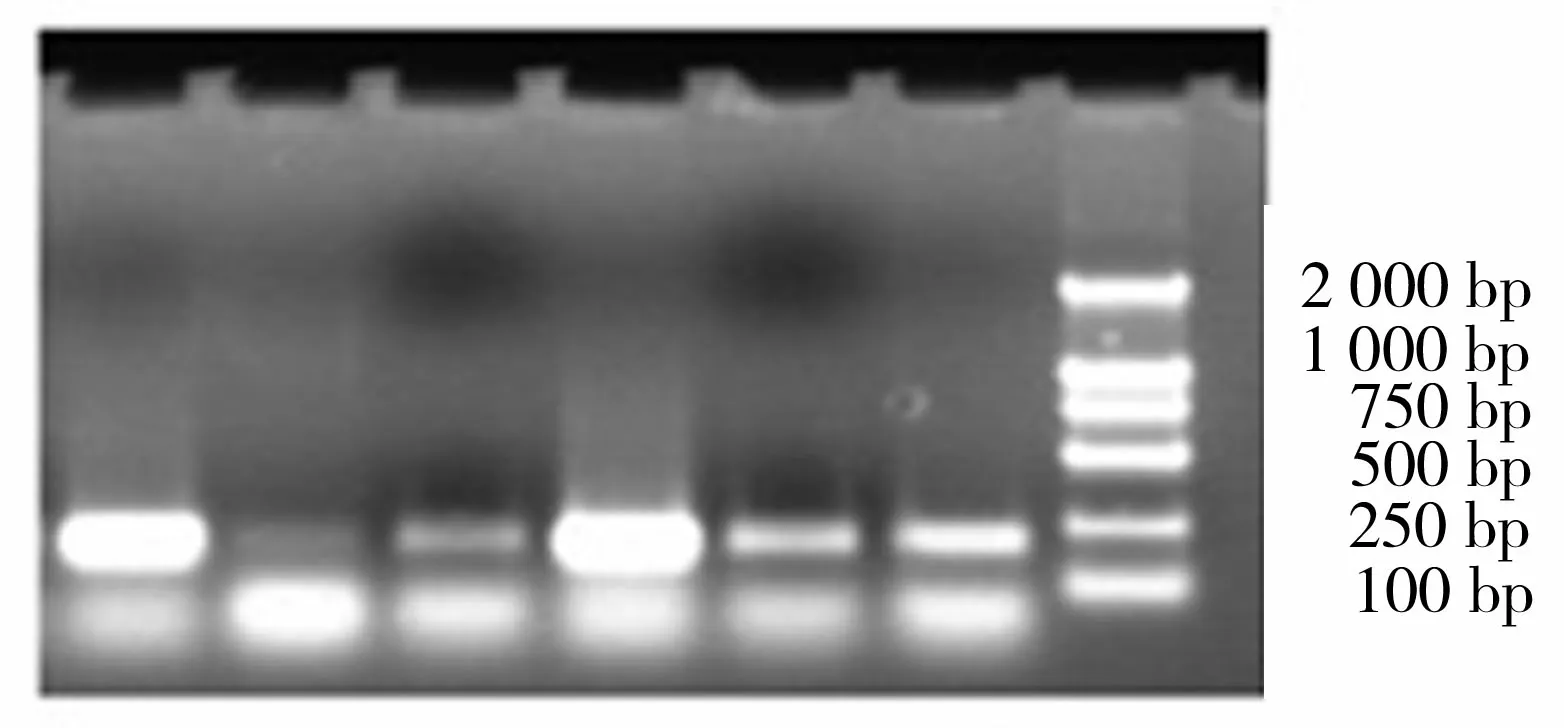
1:斧足;2:性腺;3:心脏;4:肝脏;5:鳃;6:闭壳肌;7:DL 2000 Marker图2 三角帆蚌不同组织基因组DNA PCR扩增效果比较Figure 2 PCR amplification comparison in DNA extractraion from different tissues of Hyriopsis cumingii
2.3 不同组织DNA的PCR扩增效果比较
将三角帆蚌不同组织所提取的DNA稀释为10 ng/μL作为模板进行PCR扩增,每个反应取模板量为0.5 μL。利用三角帆蚌看家基因β-actin对所有组织所提取的DNA进行PCR扩增,结果显示如图2。β-actin目的片段为227 bp。在所有6个组织中均能检测到β-actin的目的条带,但肝脏和斧足中条带最亮,其次为闭壳肌,鳃、性腺和心脏的条带较弱。
3 讨论
生物体组织细胞中的脱氧核糖核酸(DNA)部分与蛋白质结合,以核蛋白-脱氧核糖核蛋白(DNP)的形式存在。平衡酚-氯仿法是利用SDS裂解细胞,蛋白酶K消化大部分蛋白质,最后用酚+氯仿+异戊醇除去剩余的蛋白质。如果提取的DNA中含有蛋白质污染会影响后续的试验,因而采用酚+氯仿+异戊醇2次抽提的方法尽可能将其中的蛋白质除去干净。此外,考虑到软体动物斧足内部结构坚硬,蛋白质含量高[4],因而相对于刘瑾等[3]所描述的提取三角帆蚌基因组DNA的4种方法(苯酚法、改进苯酚法、CTAB法和改进ROSE法)来说,本研究采用的平衡酚-氯仿法增加1倍的蛋白酶K的加入量,电泳结果以及分光光度计测定的D260/D280结果表明,这种方法达到了较好的效果,各个组织所提取的DNA中基本无蛋白污染。此外,本研究不需要液氮,方便于一般的实验室操作。
目前在利用软体动物双壳类提取基因组DNA时,最常选择的组织是肌肉。如包永波等[4]用西施舌的斧足提取基因组DNA;刘瑾等[3]用三角帆蚌的斧足提取DNA;於琼维等[2]用褶纹冠蚌的闭壳肌提取DNA。一方面是由于这2个组织取样很容易,另一方面,本研究中三角帆蚌6个组织基因组DNA的提取效果比较显示,斧足DNA的电泳图谱完整、无拖尾现象、DNA纯度和浓度高、PCR扩增条带亮。因而三角帆蚌提取基因组DNA的最佳组织为斧足。虽然三角帆蚌闭壳肌提取的DNA纯度和浓度均较高,但电泳图谱中有少量拖尾现象,且PCR扩增条带也不是很亮,因而闭壳肌不是三角帆蚌提取DNA最适材料。肝脏是脊椎动物常用的提取基因组DNA材料[5,6],软体动物是无脊椎动物中唯一具有肝脏的动物。利用三角帆蚌肝脏提取基因组DNA虽然电泳显示有少许的拖尾,但分光光度计测定的结果表明其纯度和浓度均较高,PCR扩增的条带也很亮。三角帆蚌的肝脏是位于膨大的胃周围、褐色的消化腺。由于贝类的斧足和闭壳肌在匀浆的过程中很难完全匀碎,相对来说肝脏的匀浆就容易得多,因而肝脏也非常适合作为三角帆蚌提取DNA的材料。而三角帆蚌性腺和心脏无论是从电泳图谱、纯度、浓度还是PCR扩增来看提取的DNA均不是很好,而且非专业人员不能够正确地判断2种组织并对其取样,因而不建议利用这2种组织来提取DNA。
对于从基因组DNA上扩增大片段基因(例如gt;10 kb的基因)的实验来说,要求提取的DNA尽可能完整、断裂少、大部分DNA保持长的双链。因而在提取基因组DNA抽提的过程中摇荡液体动作要轻缓,转移液体的过程中吸样及放样动作要缓慢,且尽可能采用剪头灭菌的枪头。
[1]溪 流. 我国淡水珍珠业面临的问题 [J]. 现代渔业信息,2006,21(9):36.
[2]於琼维,杨受保,弭忠祥. 一种无液氮的育珠蚌基因组DNA提取方法 [J]. 水利渔业,2006,26(2):15~16.
[3]刘 瑾,舒妙安. 三角帆蚌基因组DNA提取方法的比较研究 [J]. 水利渔业,2008,28(4):43~45.
[4]包永波,尤仲杰,焦海锋. 西施舌基因组DNA的提取及其RAPD反应条件的优化[J]. 水利渔业,2005,25(6):32~33.
[5]范武江,王晓清,杨品红,等. 鳙鱼不同组织基因组DNA提取方法的探讨 [J]. 南方水产,2007,3(1):44~47.
[6]刘 臻,鲁双庆,肖调义,等. 鲫鱼基因组DNA提取方法的探讨 [J]. 水利渔业,2004,24(6):20~22.
2010-01-12
湖北省自然科学基金项目(2008CDB104);湖北省教育厅资助项目(Q20081204)
彭本英(1968-),女,湖北荆州人,助理实验师,研究方向为动物分子免疫学.
许巧情,E-mail:xuqiaoqing@163.com
10.3969/j.issn.1673-1409(S).2010.02.014
Q75;Q959.215
A
1673-1409(2010)02-S041-03
