MCP-1在小型猪慢性阻塞性胰腺炎组织中的表达及其意义
2010-11-23边洋塔娜李林郑峤张顺民郑建明左长京
边洋 塔娜 李林 郑峤 张顺民 郑建明 左长京
·论著·
MCP-1在小型猪慢性阻塞性胰腺炎组织中的表达及其意义
边洋 塔娜 李林 郑峤 张顺民 郑建明 左长京
目的检测慢性阻塞性胰腺炎小型猪血单核细胞趋化蛋白-1(MCP-1)含量及胰腺组织MCP-1蛋白表达,探讨其在胰腺纤维化中的作用。方法采用不全结扎主胰管方法建立小型猪慢性阻塞性胰腺炎模型,术后4、6、8周分批处死动物。观察胰腺病理变化;胶原(VG)染色评估胰腺纤维化程度;ELISA法检测血MCP-1浓度;免疫组化法检测胰腺组织MCP-1、α-SMA、PDGF、TGF-β1和NF-κB表达。结果造模成功14头(58.3%)。术后4周起胰腺体尾部呈萎缩性改变,间质纤维组织增生,炎细胞浸润,第8周改变最明显。胰腺纤维化Ⅰ期5头(35.7%),Ⅱ期4头(28.6%),Ⅲ期5头(35.7%)。术后4、6、8周造模成功组血MCP-1含量分别为(102.44±36.25)pg/ml、(97.84±28.67)pg/ml、(94.32±28.42)pg/ml,显著高于对照组的(10.42±5.86)pg/ml、(8.58±4.86)pg/ml、(8.22±4.58)pg/ml(P值均<0.01)。对照组胰腺无MCP-1蛋白表达,造模成功组胰腺组织内见MCP-1蛋白表达,且MCP-1表达与α-SMA、PDGF、TGF-β1和NF-κB表达呈正相关。结论MCP-1在慢性阻塞性胰腺炎胰腺纤维化过程中起重要作用。
胰腺炎,慢性; 趋化因子类; 单核细胞趋化蛋白-1; 星形细胞; 纤维化
单核细胞趋化蛋白-1(monocyte chemoattractant protein 1,MCP-1)是CC类趋化因子家族中的主要成员之一,对单核细胞、巨噬细胞、淋巴细胞具有很强的趋化活性,在免疫炎症反应、动脉粥样硬化等一系列疾病过程中发挥重要作用。近年来研究表明,MCP-1在慢性胰腺炎(CP)胰腺纤维化过程中发挥着十分重要的作用。本文检测慢性阻塞性胰腺炎小型猪的血MCP-1含量及胰腺组织MCP-1蛋白表达,探讨其在胰腺纤维化发展中的作用及其机制。
材料与方法
一、实验动物及分组
36头20~25 kg的雌性巴马小型猪,月龄6~12个月,体重20~ 25 kg,由第二军医大学实验动物中心提供。按数字表法随机分为实验组(24头)和对照组(12头)。参考文献[1]的方法,即用3.0号丝线把主胰管与双股3.0号聚丙烯线一起结扎,建立阻塞性胰腺炎模型。对照组仅翻动胰腺数次。术中取右叶胰腺组织置-180℃液氮保存。造模后4、6、8周分批处死动物,取胰腺常规固定。术后4、6、8周抽取外周血,分离血清备用。
二、血MCP-1浓度检测
采用ELISA法,试剂盒购自武汉博士德生物工程有限公司,严格按说明书操作。应用酶标仪测定各孔A450值。用MCP-1的标准蛋白做标准曲线,根据标准曲线计算标本中MCP-1的含量。
三、胰腺病理形态学观察及胶原纤维染色
常规行病理学检查。按照胰腺腺泡萎缩、炎细胞浸润和纤维化程度(主要根据胰腺纤维化的程度)分为三期[2]:Ⅰ期为轻微纤维化,即间质纤维组织轻度增生,胰腺腺泡轻度萎缩,较多淋巴细胞、浆细胞和少量巨噬细胞浸润;Ⅱ期为中度纤维化,即纤维组织明显增生,胰腺腺泡明显萎缩,间质内较多淋巴细胞、浆细胞浸润;Ⅲ期 为重度纤维化,即间质纤维组织大量增生,胰腺的外分泌实质几乎完全被破坏,胰腺腺泡显著萎缩,间质内少量淋巴细胞、浆细胞浸润。同时,采用VG染色观察胰腺组织纤维化程度。
四、胰腺组织蛋白表达的检测
采用免疫组化方法,按说明书操作。抗PDGF、TGF-β1、NF-κB和α-SMA抗体均购自武汉博士德生物工程有限公司。用TBS代替一抗作为空白对照。MCP-1、PDGF、TGF-β1和α-SMA均表达于细胞质内,NF-κB表达于细胞核和(或)细胞质内,出现棕黄色颗粒为阳性细胞。根据细胞染色强度评分:未染色,0分;黄褐色1分;褐色2分;深褐色3分。按阳性细胞率评分:<5% 0分;5%~10% 1分;11%~25% 2分;26%~50% 3分;>50% 4分。将两分值相加, ≤2分为阴性,>2分为阳性。
五、统计学分析
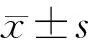
结 果
一、造模成功率
实验组1头猪因麻醉意外死亡,2头在造模术后1~2周内死亡,解剖显示胰管损伤,胰液外漏伴腹腔感染。实验组造模成功14头,成功率58.3%。
二、血MCP-1含量的变化
术后4、6、8周对照组血MCP-1含量分别为(10.42±5.86)pg/ml、(8.58±4.86)pg/ml、(8.22±4.58)pg/ml;造模成功组分别为(102.44±36.25)pg/ml、(97.84±28.67)pg/ml、(94.32±28.42)pg/ml,两组相差显著(P值均<0.01)。
三、胰腺病理学变化
对照组胰腺无病理形态学改变。造模成功组自术后4周起胰腺呈灰红色,质地较硬(图1),体尾部轻度萎缩,切面结节状。镜检示胰腺分叶状结构不同程度遭到破坏,胰腺腺泡萎缩、纤维组织增生,间质内散在淋巴细胞、浆细胞浸润(图2),VG染色示大量纤维组织增生(图3),以术后8周改变最明显。其中Ⅰ期5头(35.7%),Ⅱ期4头(28.6%),Ⅲ期5头(35.7%)。Ⅰ、Ⅱ、Ⅲ期猪的血MCP-1含量分别为(100.38±28.42)pg/ml、(98.26±24.36)pg/ml和(96.28±26.44)pg/ml,无显著差异。
四、MCP-1、PDGF、TGF-β1、NF-κB和α-SMA蛋白的表达
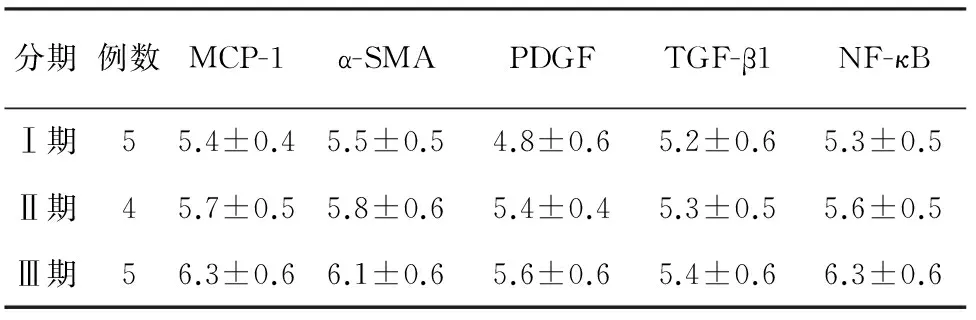
造模成功组造模后4、6、8周胰腺组织内均见MCP-1蛋白表达,定位于胰腺泡心导管、内皮细胞、成纤维细胞、巨噬细胞和T淋巴细胞胞质内(图4),且随分期增加表达逐渐增强,以Ⅲ期最为显著(表1),但无显著性差异。MCP-1蛋白表达与α-SMA、PDGF、TGF-β1和NF-κB表达呈正相关(P<0.01)。
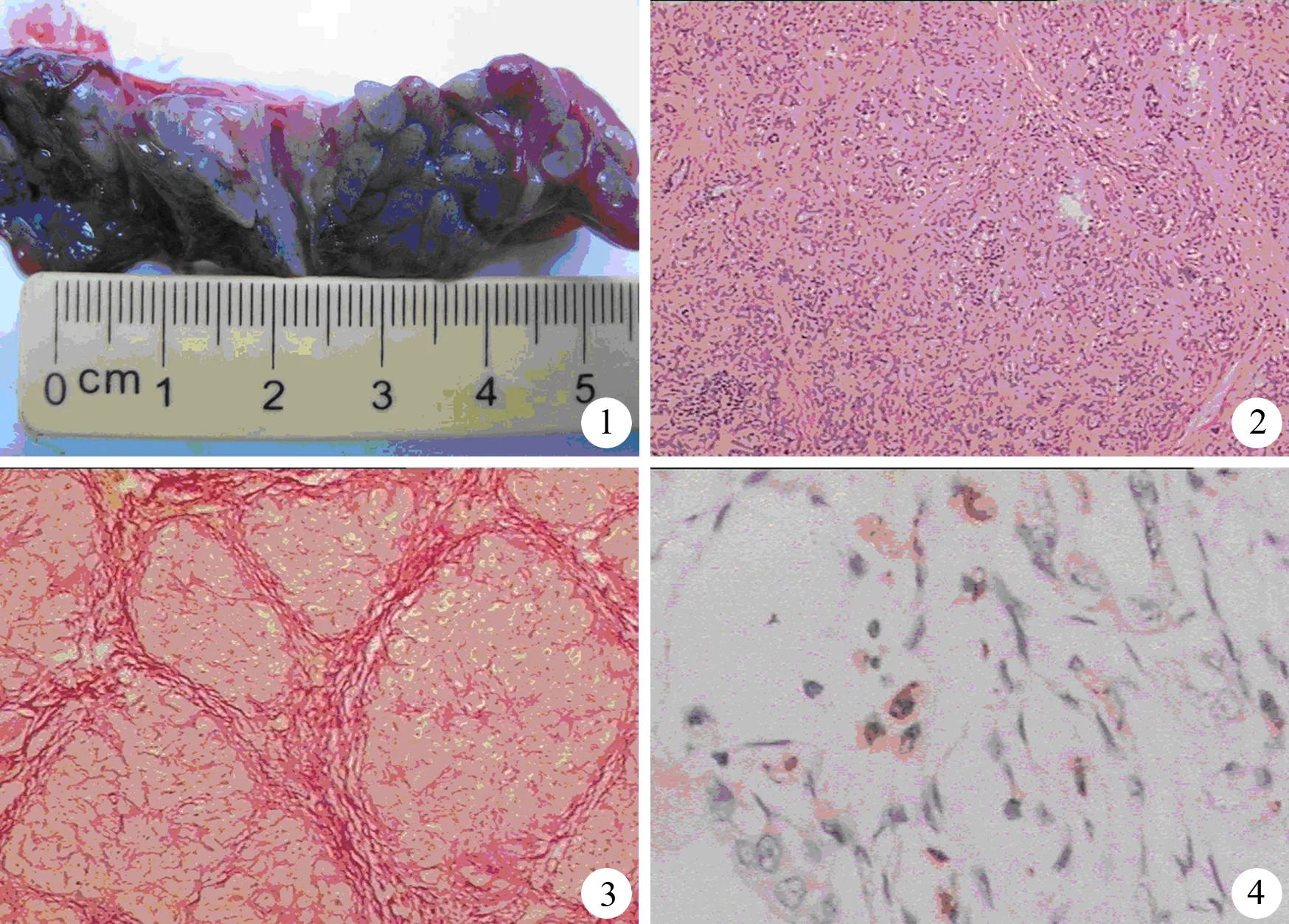
图1实验组4周的胰腺图2胰腺的病理改变(HE ×100)图3胰腺内大量纤维组织增生(VG ×100)图4胰腺MCP-1蛋白表达(免疫组化 ×200)
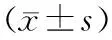
分期例数MCP-1α-SMAPDGFTGF-β1NF-κBⅠ期55.4±0.45.5±0.54.8±0.65.2±0.65.3±0.5Ⅱ期45.7±0.55.8±0.65.4±0.45.3±0.55.6±0.5Ⅲ期56.3±0.66.1±0.65.6±0.65.4±0.66.3±0.6
讨 论
以往CP动物模型多以鼠、猫等小型动物为对象,采用饮食、蛙皮素静脉内注射及胰管内注射等方法制成和人类相似的CP,但对于影像诊断和外科治疗的实验研究有一定的局限性。由于猪的消化系统和人很相似,且能够满足影像诊断和外科治疗的要求,因此猪是较理想的CP模型动物。目前已有采用主胰管结扎法建立猪CP模型的报道[2-3]。本实验选择巴马小型猪制作慢性阻塞性胰腺炎模型,结果显示其病理表现与人类的慢性阻塞性胰腺炎类似。
CP与免疫、细胞因子、基因突变、细胞凋亡有密切的关系,其中细胞因子在CP胰腺纤维化过程中起着十分重要的作用[3]。Inoue等[4]以二丁基二氯化锡诱导大鼠CP模型,其胰腺组织和血清中MCP-1 mRNA和蛋白浓度均明显增加。Zhao等[5]给该模型肌内注射能与MCP-1竞争结合的MCP-1突变体,结果血清MCP-1水平明显下降,胰腺炎症和纤维化发生率下降50%。Saurer等[6]用原位杂交方法检测23例CP和4例对照正常胰腺组织MCP-1 mRNA的表达,结果显示,MCP-1 mRNA在正常胰腺组织中不表达,CP组织则强表达。本实验结果显示,胰腺MCP-1的蛋白表达及血MCP-1含量随CP分期增加逐渐增强,以Ⅲ期最为显著。
Gharaee-Kermani等[7]报道,MCP-1通过上调TGF-β1水平促进纤维化发生。Zhao等[5]报道,抗MCP-1基因治疗能显著降低胰腺TGF-β、PDGF、IL-1β和IL-6表达水平。本实验结果亦显示,MCP-1与α-SMA、PDGF、TGF-β1和NF-κB表达呈正相关。
[1] Boerma D,Straatsburg IH,Offerhaus GJ,et al.Experimental model of obstructive,chronic pancreatitis in pigs.Dig Surg,2003,20:520-526.
[2] Stolte.Chronic pancreatitis.Verh Dtsch Ges Pathol(Germany),1987,71:175-185.
[3] Michalski CW,Gorbachevski A,Erkan M,et al.Mononuclear cells modulate the activity of pancreatic stellate cells which in turn promote fibros is and inflammation in chronic pancreatitis.J Transl Med,2007,5:63-73.
[4] Inoue M, Ino Y,Gibo J,et al.The role of monocyte chemoattractant protein-1 in experimental chronic pancreatitis model induced by dibutyltin dichloride in rats. Pancreas,2002;25:e64-e70.
[5] Zhao HF,Ito T,Gibo J,et al.Anti-monocyte chemoattractant protein 1 gene therapy attenuates experimental chronic pancreatitis induced by dibutyhin dichloride in rats.Gut,2005,54:1759-l767.
[6] Saurer L,Reber P,Schaffner T,et al.Differential expression of chemokines in normal pancreas and in chronic pancreatitis.Gastroenterology,2000,118:356-367.
[7] Gharaee-Kermani M,Denholm EM,Phan SH.Costimulation of fibroblast collagen and transforming growth factor b1 gene expression by monocyte chemoattractant protein-1 via specific receptors.J BiolChem,1996,271:17779-17784.
2010-04-07)
(本文编辑:吕芳萍)
ExpressionofMCP-1inthepancreasofpigletwithchronicobstructivepancreatitisanditssignificance
BIANYang,TANa,LILin,ZHENGQiao,ZHANGShun-min,ZHENGJian-ming,ZUOChang-jing.
Grade2007,Five-yearClinicalCourse,SecondMilitaryMedicalUniversity,Shanghai200433,China
ObjectiveTo determine the serum concentration of MCP-1 and the expression of MCP-1 protein in the pancreas in the piglet with chronic obstructive pancreatitis and to explore the role of MCP-1 protein in pancreatic fibrosisits.MethodsThe piglet model of chronic obstructive pancreatitis was established by incomplete ligation of the pancreatic duct. The piglets were sacrificed at 4, 6, 8 weeks after induction. Pathological changes of pancreas were examined. Pancreatic fibrosis was assessed by VG staining. Serum MCP-1 concentrations were detected by ELISA method. MCP-1 and α-SMA, PDGF, TGF-β1 and NF-κB protein expression were detected by immunohistochemistry.ResultsThe induction was successful in 14 piglets (58.3%). Mild atrophic changes, interstitial fibrosis, chronic inflammatory cell infiltration could be observed in the body and tail of pancreas from the 4th week in the experimental group. The most obvious changes occurred in the 8th week. Stage I pancreatic fibrosis occurred in 5 piglets (35.7%), stage Ⅱ in 4 piglets (28.6%), stage Ⅲ in 5 rats (35.7%). Seurm MCP-1 at 4, 6, 8 weeks was (102.44±36.25)pg/ml, (97.84±28.67)pg/ml, (94.32±28.42)pg/ml,respectively, and was significantly higher than that in control group [(10.42±5.86)pg/ml, (8.58±4.86)pg/ml, (8.22±4.58)pg/ml,P<0.01]. There was no MCP-1 protein expression in the control group; MCP-1 protein was detected in the successful induction group, and MCP-1 expression was positively correlated with expressions of the PDGF, TGF-β1, α-SMA and NF-κB.ConclusionsMCP-1 may play an important role in the course of pancreatic fibrosis in chronic obstructive pancreatitis.
Pancreatitis, chronic; Chemotactic factors; Monocyte chemoattractant protein-1; Astrocytes; Fibrosis
Commoncorrespondingauthor:ZHENGJian-ming,Email:jmzheng1962@163.com;ZUOChang-jing,Email:changjing.zuo@gmail.com
10.3760/cma.j.issn.1674-1935.2010.06.011
上海市科委国际合作科研基金(10410708800);2009年校大学生创新能力培养计划立项课题面上项目
200433 上海,第二军医大学临床医学本科五年制2007级学员队(边洋、塔娜、李林、郑峤);长海医院病理科(张顺民、郑建明),核医学科(左长京)
共同通信作者:郑建明,Email:jmzheng1962@163.com;左长京,Email:changjing.zuo@gmail.com
