茭白黑粉菌及茭白植株中DNA的提取方法
2010-11-12徐蝉张敬泽刘娜徐晓峰黄建中郭得平
徐蝉,张敬泽,刘娜,徐晓峰,黄建中,郭得平
(浙江大学农业与生物技术学院,浙江杭州,310058)
茭白黑粉菌(Ustilago esculentaP.Henn.)属黑粉菌目、黑粉菌科,广泛分布于中国、越南、日本等东南亚地区。在茭白(Zizania latifoliaTurcz.)生长期间,正常茭白植株中均存在茭白黑粉菌菌丝,茭白黑粉菌与茭白植株共生,并在茭白植株体内分泌代谢产物刺激茭白花茎基部膨大形成肉质茎[1],从而形成经济产量。目前对茭白黑粉菌及茭白植株分子生物学方面的研究鲜有报道,而要进一步深入研究其分子生物学特性并得到良好的试验结果,就必须获得适合于内切酶酶切和PCR扩增的高质量的DNA[2]。
随着分子生物学技术的不断发展,基于PCR技术的分子生物学方法,如直接测序、RAPD分析和AFLP分析研究亲缘关系遗传多样性水平,这些都要求一种安全快捷、成本合理且有效的DNA提取方法[3,4]。但由于不同材料的细胞中所含次生代谢产物的种类和含量不同,所以不同材料的DNA提取方法也不尽相同。如提取成年树木的基因组DNA时不使用液氮[5];Danilevich等[6]用盐缓冲溶液高温沸煮的方法直接提取用于PCR多态性扩增的酵母和真菌DNA。
1 材料与方法
1.1 材料准备
茭白黑粉菌成熟冬孢子于2009年秋采自浙江省湖州市德清县,于PDA培养基上培养纯化,得到菌落[18]。从PDA培养基上刮下菌落,用无菌去离子水洗涤3次,每次均经5 000 r/min离心后倾去上清液,然后将洗涤后的菌落置于45℃恒温箱中过夜,菌落干燥后即可用于基因组DNA的提取。
茭白植株取自浙江大学试验农场,田间选取新鲜幼嫩组织直接带回实验室立即用于基因组DNA的提取。
1.2 主要仪器
低温离心机(SIGMA 3K30)、电泳设备、水平摇床(ZD-9556)、紫外分光光度计、数码凝胶图像处理系统(Fine-do X3)、PCR 仪(Gene Company,ABI 2720)等。
1.3 主要试剂及配制
主要试剂:CTAB、Tris、EDTA 均为 Bio Basic Inc;DNA Marker,RNase A,10×Loading Buffer 均为TaKaRa;10 ×PCR Buffer,MgCl2,dNTP,Taq-DNA polymerase、Tris-平衡酚、Goldview核酸染料均购自上海生工生物工程技术服务有限公司;其他药品均为分析纯。
CTAB 提取缓冲液:2%(w/v) CTAB;1.4 mol/L NaCl;2.0 mmol/L EDTA;100 mmol/L Tris·HCl(pH值 8.0),高压灭菌备用。
1.4 提取茭白黑粉菌基因组DNA
①取干燥后的茭白黑粉菌菌落放入无菌研钵中,倒入液氮迅速研磨至粉末状。把粉末移入灭菌的 1.5 mL eppendorf管中,加入 600 μL 65℃的CTAB 溶液,置 65℃恒温水浴保温 0.5~1 h。
②加入氯仿/异戊醇溶液(氯仿/异戊醇/乙醇比例为 20∶1∶4)600 μL,开盖,通风柜中干燥 1~2 min,盖盖,置于摇床上轻轻混合15~20 min,然后4℃,1.2万r/min离心10 min。收集上清液,并重复操作一次。此时上清液不能带有下层液相。
③上清液加入等体积异丙醇(-20℃预冷),将离心管慢慢上下摇动30 s,置于冰上5 min,使异丙醇与水层充分混合至能见到DNA絮状物。4℃,1万r/min离心10 min,弃掉上清液,沿管壁缓慢加入1 mL 95%的乙醇,随后轻轻弃掉,自然风干,但不要让DNA过于干燥。
其实,每个人的生活都是一个样子,要么一地葱皮,要么一堆鸡毛蒜皮。如果一个家庭的生活不落到吃饭这种实实在在的行动上,它是不会幸福的。
④加入500 μL TE缓冲液,60℃恒温箱保温助溶30 min以使 DNA充分溶解。加入RNase A,静置于37℃恒温箱保温30 min。加入等体积的平衡酚500 μL 和氯仿/异戊醇(24∶1)500 μL,颠倒数次。4℃,1万 r/min离心 10 min。
⑤收集上清液,加入3 mol/L的 NaAC(体积为上清液的1/10)和100%的冻乙醇(体积为上清液的2倍),置于-20℃沉淀 30 min,然后 4℃,1万 r/min离心10 min。70%乙醇洗涤,弃去液体,室温下尽量挥发残留乙醇,但不要使DNA完全干燥。加入50~100 μL TE溶液,使核酸溶解,-20℃冰箱保存待测。
1.5 提取茭白植株基因组DNA
取适量茭白植株新鲜组织,步骤①同上。
②加入氯仿/异戊醇溶液(24∶1)600 μL,颠倒数次混匀,在水平摇床上轻轻混合10 min,然后4℃,1.2万r/min离心10 min。收集上清液,加入RNase A置于37℃水浴保温15~20 min,并缓慢颠倒数次。
③加入等体积的平衡酚300 μL和氯仿/异戊醇(24∶1)300 μL,颠倒数次。在水平摇床上轻轻混合 10 min,4℃,1.2 万 r/min 离心 10 min,收集上清液,加入纯氯仿600 μL在水平摇床上轻轻混合10 min,4℃,1.2 万 r/min 离心 10 min。
④取上清液于1.5 mL离心管中,加入等体积异丙醇(预冷),轻轻颠倒数次混匀,-20℃冰箱静置30~40 min。4℃,1万 r/min离心 10 min,弃掉溶液,加入95%的乙醇,轻轻弃掉溶液,室温下尽量挥发残留乙醇,但不要让DNA过于干燥。加入500 μL TE缓冲液,60℃保温助溶30 min使 DNA溶解。
⑤同 1.4。
1.6 基因组DNA质量检测
①紫外分光光度法检测 取DNA原液,无菌水稀释50倍,用紫外分光光度计测其在260 nm、280 nm波长处的吸光度,计算A260/A280值。
②琼脂糖凝胶电泳检测 制备1.0%的琼脂糖凝胶(加Goldview染料),分别取6 μL DNA和2 μL 10×Loading Buffer上样缓冲液混合,用1×TBE缓冲液于100 V电压电泳40 min,用凝胶成像分析系统检测并拍照。
③基因组PCR检测 在PCR仪上进行DNA的PCR扩增,由上海生工生物工程技术服务有限公司合成真菌通用引物 ITS1(5′-TCCGTAGGTGAACCTGCGG-3′) 和 ITS4 (5′-TCCTCCGCTTATTGATATGC-3′)。 在 50 μL 总反应体系中,含真菌通用引物 ITS1(20 μmol/L)和 ITS4(20 μmol/L)各2 μL,模板 DNA 2 μL,MgCl2(25 mmol/L)4 μL,10×PCR Buffer 5 μL,dNTP(2.5 mmol/L)1.5 μL,Taq-DNA polymerase(5 U/μL)0.5 μL,ddH2O 33 μL。PCR 反应条件:94℃预变性 5 min;94℃ 30 s,52℃ 30 s,72℃ 1 min 共 35 个循环;72℃延伸7 min。取6 μL 扩增产物和 2 μL 10×Loading Buffer上样缓冲液混合,用1×TBE缓冲液于100 V电压电泳40 min,于1.0%琼脂糖电泳(加Goldview染料),用凝胶成像系统拍照并进行下一步分析。
2 结果与分析
一般来说,纯DNA样品紫外消光值A260/A280≈1.8,大于 1.9,表明有 RNA 污染,小于 1.6 时,表明样品有蛋白质、酚类等污染。本试验所提取DNA紫外吸光值 A260/A280在 1.71~1.83(表1),说明采用改进的CTAB法可提取出较高纯度的茭白黑粉菌与茭白植株的基因组DNA。
茭白黑粉菌与茭白植株总DNA提取液电泳结果如图1所示,可看出DNA提取效果很好,均为完整的基因组DNA,小分子量DNA条带污染少,蛋白质、糖类污染也很少,并且没有DNA大量降解的情况。本试验提取的DNA呈乳白色,表明DNA十分纯净。
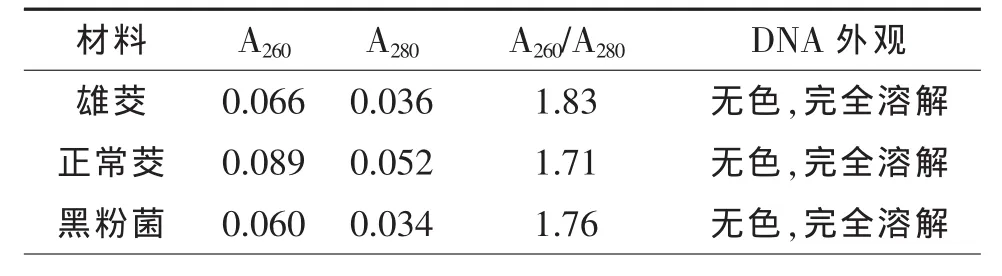
表1 DNA提取效果
茭白黑粉菌与茭白植株所提取DNA液PCR扩增产物电泳结果如图2所示。可以看出茭白黑粉菌与正常茭白植株PCR结果均有条带而雄茭则无条带。ITS1和ITS4为真菌通用引物,故而黑粉菌DNA能用PCR扩增出条带,而正常茭白植株中含有黑粉菌菌丝,所提取DNA液中含有微量茭白黑粉菌DNA,所以其PCR扩增产物有条带,但是较黑粉菌扩增产物条带暗,雄茭中无黑粉菌,所以无条带。由此扩增效果可以看出,本试验提取的DNA能满足后续分子生物学方面的研究。
3 结论与讨论
茭白黑粉菌与茭白植株为共生体系,正常茭白植株中存在茭白黑粉菌菌丝,目前学者们对茭白黑粉菌与茭白植株的研究多集中于生理、栽培等方面,分子生物学方面的研究涉及较少,而进一步深入研究其分子生物学特性的基础和关键是获得高质量的基因组DNA。提取高质量的DNA将有利于茭白黑粉菌与茭白植株进行DNA杂交、PCR扩增、AFLP及SSR分析、基因组克隆等领域的研究。
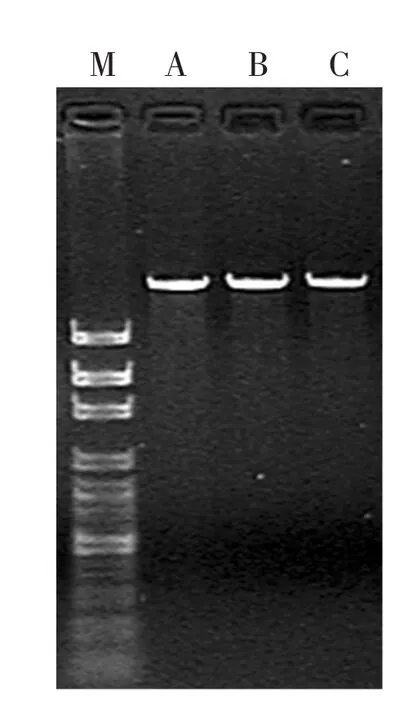
图1 基因组DNA琼脂凝胶电泳结果
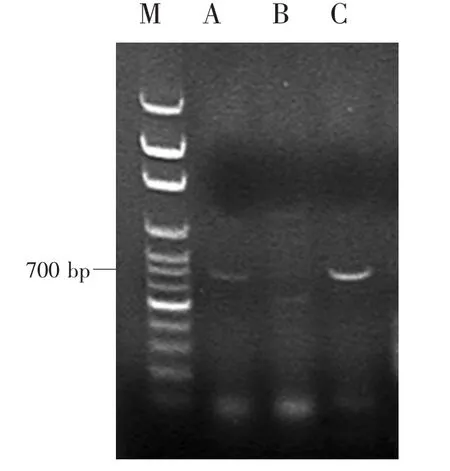
图2 PCR扩增产物琼脂凝胶电泳结果
CTAB是一种阳离子去污剂,它能与核酸形成复合物,这些复合物在低盐溶液中会因溶解度的降低而沉淀,而在高盐溶液中可解离,使DNA和多糖分开。本试验中,对前人所用CTAB法稍加改进,以适于提取高纯度的茭白黑粉菌与茭白植株基因组DNA。前人研究表明,CTAB法提取DNA 65℃时最适宜DNA和多糖大量释放,并且加醋酸钾(pH值7.5)和4℃离心对消除多糖很关键[19]。本试验采用了65℃破碎细胞,4℃离心,并采用醋酸钠溶液代替醋酸钾溶液,其效果相同。为了保证提取DNA的质量,必须要注意以下事项:尽可能选取新鲜幼嫩的茭白组织;茭白黑粉菌需提前培养好大量菌落,提取前菌丝必须冲洗以减少多糖的影响,否则在沉淀DNA时,或无沉淀出现,或得到的絮状沉淀难以用TE溶解,且纯度很低,无法用于下一步分析;收集CTAB与核酸形成的复合物时不要离心过度,因为形成的沉淀很难再溶解;在分离制备过程中必须采用温和的条件,同时还要避免核酸降解酶类对其的降解,为此试验中所用研钵、离心管等最好提前进行灭菌处理。
[1]余永年.茭白黑粉菌刺激生长物质的研究[J].植物学报,1962,12(3):317-327.
[2]吴忠兰,宋玉霞,马洪爱,等.用改进的CTAB法提取肉苁蓉基因组 DNA[J].宁夏大学学报:自然科学版,2008,29(1): 78-80.
[3]Mǒller E M,Bahnweg G,Sandermann H,et al.A simple and efficient protocol for isolation of high molecular weight DNA from filamentous fungi,fruit bodies,and infected plant tissues[J].Nucleic Acids Research,1992,20(22):6 115-6 116.
[4]Cota-Sánchez J H,Remarchuk K,Ubayasena K.Ready-touse DNA extracted with a CTAB method adapted for herbarium specimens and mucilaginous plant tissue[J].Plant Molecular Biology Reporter,2006,24:161-167.
[5]Tibbits J F G,Mcmanus L J,Spokevicius A V,et al.A rapid method for tissue collection and high-throughput isolation of genomic DNA from mature trees[J].Plant Molecular Biology Reporter,2006,24:81-91.
[6]Danilevich V N,Grishin E V.A new approach to the isolation of genomic DNA from yeast and fungi:preparation of DNA-containing envelopes and their use in PCR[J].Russian Journal of Bioorganic Chemistry,2002,28(2):136-146.
[7]Queipo-Ortuno M I,Tena F,Colmenero J D,et al.Comparison of seven commercial DNA extraction for the recovery of Brucella DNA from spiked human serum samples using real-time PCR [J].Eur J Clin Microbiol Infect Dis,2008,27:109-114.
[8]吴发红,黄东益,黄小龙,等.几种真菌DNA提取方法的比较[J].中国农学通报,2009,25(8):62-64.
[9]闫庆祥,黄东益,李开绵,等.利用改良CTAB法提取木薯基因组 DNA[J].中国农学通报,2010,26(4):30-32.
[10]李荣华,夏岩石,刘顺枝,等.改进的CTAB提取植物DNA 方法[J].实验室研究与探索,2009,28(9):14-16.
[11]谢大森,何晓明,彭庆务,等.冬瓜DNA提取方法的研究[J].中国蔬菜,2010(2):38-41.
[12]靖相密,褚云霞,汤庚国,等.不同保存方法对蜡梅总DNA提取效果的影响及ISSR-PCR验证 [J].分子植物育种,2008,6(2):387-392.
[13]Oliveira L F V,Wallau G L,Loreti E L S.Isolation of high quality DNA:a protocol combining"rennet"and glass milk[J].Electronic Journal of Biotechnology,2009,12(2):1-6.
[14]庞玉新,王文全,张影波,等.药用植物艾纳香基因组DNA 提取方法研究[J].广西植物,2009,29(6):763-767.
[15]曾大兴.适于RAPD分析的真菌DNA提取方法[J].生物技术,2003,13(2): 20-21.
[16]庄彩云,李潞滨,胡陶,等.适用rDNA ITS分析的兰属菌根真菌培养及DNA提取方法 [J].北京农学院学报,2007,22(3):4-6,31.
[17]廖芳,刘跃庭,崔铁军,等.苇状羊茅与多年生黑麦草内生真菌菌丝基因组DNA提取的优化及PCR初步检测[J].植物检疫,2006,20(5):265-268.
[18]郭得平,李曙轩,曹小芝.茭白黑粉菌(Ustilago esculenta)某些生物学特性的研究[J].浙江农业大学学报,1991,17(1):80-84.
[19]Hu Z,Zeng X,Wang A,et al.An efficient method for DNA isolation from red algae[J].Journal of Applied Phycology,2004,16:161-166.
