光致噻吨酮与胺类、酚类、醇类的电子转移和氢转移反应
2010-11-06王金婷张立敏杨茂萍
孙 倩 王金婷 张立敏 杨茂萍
(中国科学技术大学化学物理系,合肥 230026)
光致噻吨酮与胺类、酚类、醇类的电子转移和氢转移反应
孙 倩 王金婷 张立敏*杨茂萍
(中国科学技术大学化学物理系,合肥 230026)
利用激光闪光光解方法研究了一系列胺类、酚类、醇类在脱氧乙腈中猝灭噻吨酮(TX)三重态的反应,得到了相应的瞬态吸收光谱和猝灭速率常数(kq).通过对光谱演变特性的分析,推断出三重态噻吨酮与不含有活泼氢的胺发生了电子转移反应,与含有活泼氢的胺发生了电子-质子转移反应.三重态噻吨酮与酚类、醇类反应中观察到噻吨酮加氢自由基的生成,据此推断出三重态噻吨酮与酚类、醇类发生了氢转移反应.胺类的猝灭速率常数随着反应自由能变(△G)的增大而减小,说明电子转移影响了噻吨酮三重态的猝灭.酚类的猝灭速率常数先随△G增大而减小,后随酚阳离子的酸性增强逐渐增大,可能是猝灭过程中电子转移影响减弱的同时氢转移影响逐渐增强.醇类的猝灭速率常数随着醇的α-C—H键能的增大而减小,说明α-C—H键能是影响噻吨酮三重态猝灭的关键因素.比较以前研究的胺类、酚类、醇类与三重态呫吨酮(XT)、芴酮(FL)反应的结果可知,由于分子结构差异性的影响,相关的猝灭速率常数按照呫吨酮、噻吨酮、芴酮的顺序逐渐减小.
电子转移; 氢转移; 噻吨酮; 胺类 酚类; 醇类
芳香酮是光化学和光生物反应的重要物质,一直受到实验和理论计算的高度重视[1-4].光致胺类还原芳香酮的研究被报道得较多[5-9],并且胺类、酚类、醇类与芳香酮的氢转移反应也被广泛地研究过[10],此类氢转移反应产生的自由基常作为光聚合反应的引发剂应用于工业生产[6].噻吨酮(TX)及其衍生物的光敏活性在治疗肿瘤方面也有重要的应用,是一类在医药方面有重要发展前景的芳香酮[11-12].
最低三重态的电子结构是影响酮类化合物光致还原反应的重要因素.最低三重态电子结构为(π, π*)的酮类化合物容易发生电子转移反应,而最低三重态电子结构为(n,π*)的酮类化合物更容易发生氢转移反应[13].噻吨酮最低三重态电子结构为(π, π*)[14],(π,π*)和较低能量的(n,π*)容易发生电子-振动耦合[15],使激发三重态的噻吨酮同时具有电子转移和抽氢的能力.噻吨酮单重电子态和三重电子态系间窜跃系数较高[2],较高的三重态产率有利于提高反应产生的自由基的浓度,便于检测,所以噻吨酮是进行这类研究的重要分子.虽然利用激光闪光光解的方法研究噻吨酮与胺、醇、酚的反应已有报道[5-6,15-17],但据我们所知,噻吨酮与这三类物质系列性反应机理,尤其是猝灭常数的规律性研究,还没有被报道过.
本文的工作是利用激光闪光光解方法研究一系列的胺类、酚类、醇类与三重态噻吨酮的反应.通过时间分辨瞬态吸收光谱的变化,得到了相应的电子和氢转移产物的吸收峰,从吸收峰随时间的变化推测出相关的反应机理.研究了实验得到的猝灭速率常数与自由能变、酚阳离子酸性[18]、α-C—H键能[19]的关系.并且与以前研究的胺类、酚类、醇类与呫吨酮(XT)、芴酮(FL)三重态反应的结果[20]进行了比较.
1 实验部分
1.1 仪器和设备
本实验采用纳秒级的激光闪光光解装置.Nd: YAG激光器(GCR-170型,美国Spectra Physics公司,重复率10 Hz,光脉宽8 ns)经过三倍频的355 nm的激光作为光敏剂分子的激发光源.波长范围为300-900 nm的500 W的高压氙灯(XQ500型,中国电型器材公司)作为分析光源.分析光与激发光成垂直方向照射到光程10 mm的石英池上,经过聚焦镜,通过单色仪(WDG3-3,长春时代光电有限责任公司)分光,再由光电倍增管(GDB59)将光信号转换为电信号并放大后,用数字示波器(400 MHz,TDS380型,美国Tektronix公司)记录存储瞬态衰减曲线[21-22].瞬态吸收光谱通过A/D卡(50 MHz,SR245型,美国Stanford Research Systems公司)采集得到.根据中间体的寿命选择若干合适的采集时间门,A/D卡在每个时间门通过信号积分得到了不同时间吸收的强度,在有激光照射的情况下扫描单色仪波长可以获得各个时间门的瞬态吸收光谱(需减去无激光照射时的背景),通过对吸收光谱不同的吸收峰进行归属可以得到瞬态中间体自由基的信息.试剂除氧后通过恒流泵(HL-1S型,上海沪西分析仪器厂)到达石英循环池,以保证样品溶液不被过度照射,使实验结果更准确可靠.
1.2 试剂和样品
噻吨酮(TX)(98%)购自美国Alfa Aesar公司. 3,5,N,N-四甲基苯胺(TMA)(≥97%),三苯胺(TPA) (≥98%),4-甲基-N,N-二甲基苯胺(DMT)(≥99%),购自美国Fluka公司.二苯胺(DPA)(≥98%)、4-苯基苯酚(99%)、4-溴苯酚(99%)购自美国Aldrich公司.三乙烯胺(DABCO)(≥99%)购自美国Sigma公司.β-胡萝卜素(>97.0%)购自德国Merck公司.以上药品均未经进一步纯化直接使用.N,N-二甲基苯胺(DMA)、2-苯乙醇在使用前重新蒸馏两次.对苯二酚、间苯二酚、4-甲氧基苯酚、4-叔丁基苯酚、4-氯苯酚,使用前均用标准方法提纯.苯胺(AN)、苯酚、苯甲醇、乙醇、甲醇为分析纯,未经进一步纯化而直接使用.作为溶剂的乙腈为高效液相色谱纯级(≥99.9%).样品在光照之前通入高纯氩气(99.99%)20 min以除去氧气,所有实验均在室温下完成.
2 结果与讨论
2.1 三重态噻吨酮的瞬态吸收光谱及自猝灭速率常数
用波长为355 nm、脉宽为8 ns、脉冲能量为4 mJ的脉冲激光照射脱氧乙腈中浓度为0.4 mmol·L-1的噻吨酮,得到其瞬态吸收光谱,如图1(a)所示,可以看到最大吸收峰为620 nm,此峰在0.4 μs时达到最大,随着时间延长逐渐减小,35.0 μs时已经基本衰减完全.为了归属此峰,我们在乙腈中加入噻吨酮和不同浓度的β-胡萝卜素,经光照射后,在520 nm处有新物质的吸收,并随着β-胡萝卜素的浓度增加吸收增大,如图1(b)所示.根据前人报道[23],520 nm为β-胡萝卜素三重态的特征吸收,β-胡萝卜素三重态能量较低(85 kJ·mol-1),容易发生能量转移反应,我们判断其发生了三重态-三重态(T-T)能量转移反应.因此,我们把620 nm的峰归属为噻吨酮三重态(3TX*)的特征吸收峰.关于噻吨酮三重态吸收峰的位置,前人也做了大量工作,我们得到的结果与Yates[6]和Corrales[24]等的结果是一致的.三重态噻吨酮随着时间的衰减遵循一级反应动力学规律,如图2(a)所示.
单一浓度下激发三重态噻吨酮的猝灭速率由其随时间变化的衰减曲线单指数拟合得到,一般来说,噻吨酮浓度越大猝灭速率也越大.图2(b)给出了不同噻吨酮浓度下的自猝灭速率,猝灭速率常数计算公式为:


图1 355 nm激光照射脱氧乙腈中(a)TX(0.4 mmol· L-1)的瞬态吸收光谱及(b)TX(0.2 mmol·L-1)与β-胡萝卜素520 nm的衰减曲线Fig.1 (a)Transient absorption spectra of TX(0.4 mmol·L-1)and(b)decay time profiles of TX(0.2 mmol·L-1)and β-carotene at 520 nm irradiated with 355 nm laser pulse in deoxygen acetonitrileTX:thioxanthone
其中,k0为没有猝灭剂时不同浓度噻吨酮三重态的自猝灭速率,τ0为噻吨酮激发三重态的固有寿命, ksq为噻吨酮的自猝灭速率常数.在此实验条件下,我们得出了τ0和ksq的值分别为10.3 μs和3.0×107L·mol-1·s-1.
2.2 双分子反应速率常数
激发三重态的噻吨酮反应活性大大增强,可以与容易失去电子和氢原子的物质发生电子转移和氢转移反应.本实验选择620 nm作为分析波长,通过猝灭速率对猝灭剂的浓度作图,并由下式对数据进行拟合,得到的直线斜率即为双分子猝灭速率常数kq.

其中,kobs代表有猝灭剂时的噻吨酮三重态的猝灭速率,cQ代表猝灭剂浓度.由(2)式我们可以得到胺类、酚类、醇类分别猝灭噻吨酮三重态的速率常数.
2.3 三重态噻吨酮与胺类发生电子-质子转移反应

图2 355 nm激光照射脱氧乙腈中(a)TX(0.4 mmol·L-1) 620 nm的衰减曲线及(b)TX的自猝灭速率与浓度的关系Fig.2 (a)Decay time profiles of TX(0.4 mmol·L-1)at 620 nm band and(b)the relationship between the self quenching rate and TX concentration irradiated with 355 nm laser pulse in deoxygen acetonitrileInsetinFig.2(a)showsthelogarithmicplotsofabsorbance(lnA)vstime.
三重态噻吨酮与胺类的电子转移反应前人的研究已有所涉及[5-6,16].本实验通过噻吨酮和胺类反应的瞬态吸收光谱得到相应自由基的吸收峰,为胺类和噻吨酮反应通过电子转移或电子-质子转移的机理提供了强有力的证据.TPA是一种经常用来提供电子的胺,噻吨酮/乙腈中加入一定浓度的TPA,得到如图3(a)所示的瞬态吸收光谱,可以看到伴随着噻吨酮三重态吸收峰的衰减,在550 nm处有一个新的吸收峰生成.根据前人的报道,这个峰归属为三苯胺阳离子自由基(TPA+·)[25].同时,685 nm处也有一个较小的吸收峰生成,我们将它归属为噻吨酮阴离子自由基(TX-·).Scigalski等[16]曾报道过噻吨酮阴离子自由基的吸收为680 nm.根据前人报道[25],三苯胺阴离子在650 nm处也有吸收,由于噻吨酮三重态在650 nm处有一个吸收较大的背景,我们并没有观察到明显的瞬态吸收峰.TPA有一个大π键,不容易被抽氢,实验中没有观察到噻吨酮加氢自由基的生成.与TPA类似,DABCO的C—H键能较大,不容易断键,只发生了电子转移反应[5].据此,我们推测噻吨酮和TPA、DABCO发生了如下的光引发电子转移反应:
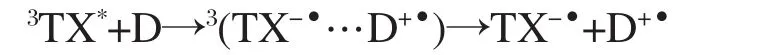
实验得到了DMT、TMA与噻吨酮在乙腈中反应的瞬态吸收光谱.在图3(b)所示的TX/DMT的瞬态吸收光谱中可以看到,随着噻吨酮三重态的衰减,在420、475和685 nm分别有三个新的吸收峰生成. 420 nm的峰应归属为噻吨酮加氢自由基(TXH·)[6], 475 nm的峰归属为DMT阳离子自由基(DMT+·), 685 nm的峰为噻吨酮阴离子自由基.在图3(c)所示的TX/TMA的瞬态吸收光谱中,我们得到了与TX/ DMT类似的结果,可以看到随着噻吨酮三重态吸收峰的衰减,在420、495和685 nm处得到了三个新的吸收峰,这三个峰分别归属为噻吨酮加氢自由基, TMA阳离子自由基(TMA+·),噻吨酮阴离子自由基. Pan等[13]研究认为DMT+·和TMA+·的特征吸收峰分别为480和510 nm.由此,我们判断以上反应产生了相应的阴阳离子和加氢自由基.
我们也测量了AN、DMA、DPA与噻吨酮在乙腈中反应的瞬态吸收光谱(文中没有给出).在AN与三重态噻吨酮反应中并没有观察到阴阳离子自由基生成,只观察到有噻吨酮加氢自由基生成,这可能与Schnabel等[5]报道的AN与三重态噻吨酮反应中阴阳离子自由基产率较低有关.在DMA、DPA与三重态噻吨酮反应的瞬态吸收光谱中观察到阴阳离子自由基和噻吨酮加氢自由基,这与Yates[6]、Scigalski[16]等人得到的结果相同.一般说来,电子转移后紧跟着质子转移的发生,据此推断出噻吨酮与以上胺类(TPA、DABCO除外)发生了以下反应:

2.4 三重态噻吨酮与酚类的电子转移和氢转移反应
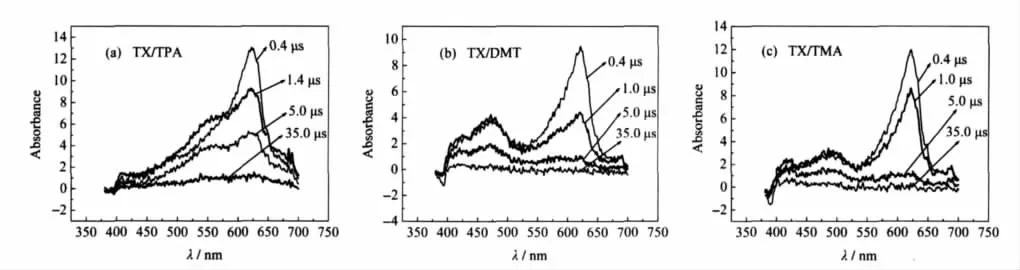
图3 355 nm激光照射脱氧乙腈中TX含有(a)TPA,(b)DMT及(c)TMA时的瞬态吸收光谱Fig.3 Transient absorption spectra of TX in the presence of(a)TPA,(b)DMT,and(c)TMA irradiated with 355 nm laser pulse in deoxygen acetonitrilecTX=0.4 mmol·L-1,cTPA=0.19 mmol·L-1,cDMT=0.14 mmol·L-1,cTMA=0.13 mmol·L-1

图4 355 nm激光照射脱氧乙腈中TX含有(a)对苯二酚,(b)4-溴苯酚及(c)4-苯基苯酚时的瞬态吸收光谱Fig.4 Transient absorption spectra of TX in the presence of(a)4-hydroxyphenol,(b)4-bromophenol,and (c)4-phenylphenol irradiated with 355 nm laser pulse in deoxygen acetonitrilecTX=0.4 mmol·L-1,c4-hydroxyphenol=0.25 mmol·L-1,c4-bromophenol=0.41 mmol·L-1,c4-phenylphenol=0.28 mmol·L-1
噻吨酮与酚类的反应前人的研究涉及较少.本实验中我们得到了噻吨酮与几种酚在脱氧乙腈中的瞬态吸收光谱.如图4(a)所示,是噻吨酮与对苯二酚在乙腈中的瞬态吸收光谱,可以看到光脉冲0.4 μs后,噻吨酮三重态很快生成,随着时间延长至1.0 μs时,对苯二酚对噻吨酮三重态有明显的猝灭,伴随着620 nm处吸收峰的衰减,在403、420、450-500 nm处分别生成了三个新的吸收峰.403 nm的峰应归属为对苯二酚自由基[26],420 nm的峰归属为噻吨酮加氢自由基,根据Yates等[6]在苯中得到的信息,我们把450-500 nm的吸收归属为噻吨酮加氢自由基,只不过此处的吸光系数小于420 nm处的.图4(b)和图4(c)分别为噻吨酮与4-溴苯酚和4-苯基苯酚的瞬态吸收光谱.与图4(a)类似,图4(b)中随着噻吨酮三重态吸收峰的衰减,在420和450-500 nm处产生了两个吸收峰,根据前人报道的4-溴苯酚自由基特征吸收峰为421 nm[26],我们认为此处420 nm的峰为4-溴苯酚自由基与噻吨酮加氢自由基的混合吸收峰.图4(c)中得到了420和500 nm两个吸收峰, 500 nm处的吸收峰较宽,我们把它归属为噻吨酮加氢自由基在450-500 nm处的吸收和4-苯基苯酚自由基的吸收,文献报道[26],4-苯基苯酚自由基的特征吸收是502 nm.所以,DMT和TMA阳离子自由基出现偏移,应归因于混入了噻吨酮加氢自由基在450-500 nm的吸收.
间苯二酚,4-甲氧基苯酚,4-叔丁基苯酚,苯酚, 4-氯苯酚与以上几种酚反应过程类似.由于只观察到噻吨酮加氢自由基而没有观察到噻吨酮阴离子自由基,所以判断三重态的噻吨酮与酚类并没有发生电子转移,而是通过碰撞和库仑作用生成具有电荷转移性质的激基络合物(exciplex),随后解离生成噻吨酮加氢自由基和相应的酚氧自由基[27].以上过程可表示如下:

2.5 三重态噻吨酮与醇类发生的氢转移反应
光诱导醌类、酮类和醇类的反应已有广泛的研究.噻吨酮在乙醇、甲醇溶剂中的瞬态吸收光谱也有报道[15].本实验在乙腈中加入苯乙醇得到时间分辨的瞬态吸收光谱,如图5(a)所示,可以看到随着620 nm处吸收的减弱,在420和450-500 nm处有两个吸收峰生成,这两个峰归属为噻吨酮加氢自由基,由此推断三重态噻吨酮与苯乙醇发生了氢转移反应.图5(b)给出了420 nm处苯甲醇与噻吨酮在乙腈中的衰减曲线,和纯的噻吨酮相比,此处明显有噻吨酮加氢自由基生成.

图5 355 nm激光照射脱氧乙腈中(a)TX含有2-苯乙醇时的瞬态吸收光谱及(b)TX(实线),TX/苯甲醇(点)420 nm的衰减曲线Fig.5 (a)Transient absorption spectra of TX in the presence of phenethyl alcohol and(b)decay time profiles of TX(solid),TX/benzyl alcohol(dot)at 420 nm irradiated with 355 nm laser pulse in deoxygen acetonitrilecTX=0.4 mmol·L-1,cphenethylalcohol=2.78 mol·L-1,cbenzylalcohol=2.42 mol·L-1
同为氢转移反应,醇类猝灭噻吨酮三重态的速率常数与酚类相比小了4-5个数量级(表1和表2),推断两者经历了不同的氢转移机理.酚的氧化电势较小,容易产生激基复合物,而醇类不易发生此类反应[10].从表1中数据可以看出随着醇类α-C—H键能增大,猝灭速率常数逐渐减小,并且α-C—H键与醇中其他C—H键相比有较低的键能,也最容易被抽取.由此推断醇类与噻吨酮发生了如下反应:
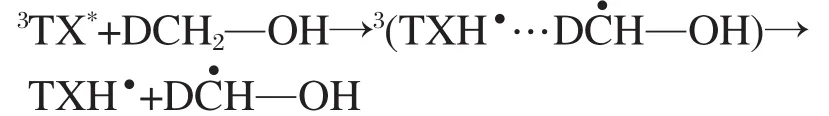
2.6 热力学结果讨论
为了进一步证明以上结论的可信性,我们根据Rehm-Weller方程[28]求算了上述反应的自由能变ΔG,以期得到ΔG与反应猝灭速率常数之间的关系. Rehm-Weller方程的表达式如下:

其中,Eox和Ered分别是电子给体的氧化电势和噻吨酮的还原电势,酚类(vs二茂铁标准电极[18],二茂铁标准电极电势(vs SCE)为0.307 V[29])、胺类(vs饱和甘汞电极(SCE))[30(a-d)]的氧化电势列于表2和表3中.噻吨酮在乙腈中的还原电势为-1.66V(vs SCE)[6]. q2/εr是产物离子在溶剂中遭遇距离的库仑能量项,纯乙腈溶液中此项为0.055 eV.ET为光敏剂激发三重态的能量(eV).对噻吨酮来说,ET为274.4 kJ· mol-1[31].由此得出的ΔG列于表2和表3中.对于胺类来说,ΔG<0可以发生电子转移反应,实验中也观察到了相应的阴阳离子自由基产生,猝灭速率常数随着ΔG的增大逐渐减小,电子转移影响了猝灭的速率.但是对TPA和DABCO来说,猝灭速率常数却不符合自由能变化的规律,从胺类与三重态噻吨酮发生反应的机理来看,这两种胺只发生电子转移而没有质子转移,质子转移会加速噻吨酮三重态的猝灭,导致DABCO和TPA猝灭速率显著变小.对于酚类来说,ΔG>0不能发生电子转移反应,实验中我们也没有观察到相应的阴阳离子自由基,猝灭速率常数随着ΔG的增大先减小后增大,究其原因可能是随着酚阳离子酸性(pKHA+)(表2)逐渐增大,带有部分正电荷的酚供氢能力逐渐增强,除了电荷作用,抽氢也对猝灭起较大作用.二酚的猝灭速率常数都高于其他苯酚的衍生物,这与之前报道的分子中质子氢的数目越多,氢转移反应活性越大是一致的[10].由于对苯二酚、间苯二酚的Hammett常数(以苯酚为参照)分别为-0.37和0.12[23],则对苯二酚中氧的电子云密度高于间苯二酚,有更强的供电子能力,我们得到对苯二酚猝灭噻吨酮三重态的速率常数大于间苯二酚,这也是符合电子转移的反应机理的.

表1 醇类猝灭TX三重态的速率常数kq及醇类α-C—H键能(EB)Table 1 Quenching rate constants(kq)for the triplets of TX by alcohols and the bonding energy(EB)of α-C—H in alcohols

表2 酚类猝灭TX三重态的速率常数kq,酚类在乙腈中的氧化电势Eox(vs二茂铁标准电极),TX三重态与酚类反应的自由能变ΔG及酚阳离子的酸性(pKHA+)Table 2 kqfor the triplets of TX by phenols,oxidation potentials(Eoxvs ferrocenium/ferrocene)of phenols in acetonitrile,free energy changes(ΔG)for the triplets of TX by phenols,the acidities of the phenol cations (pKHA+)
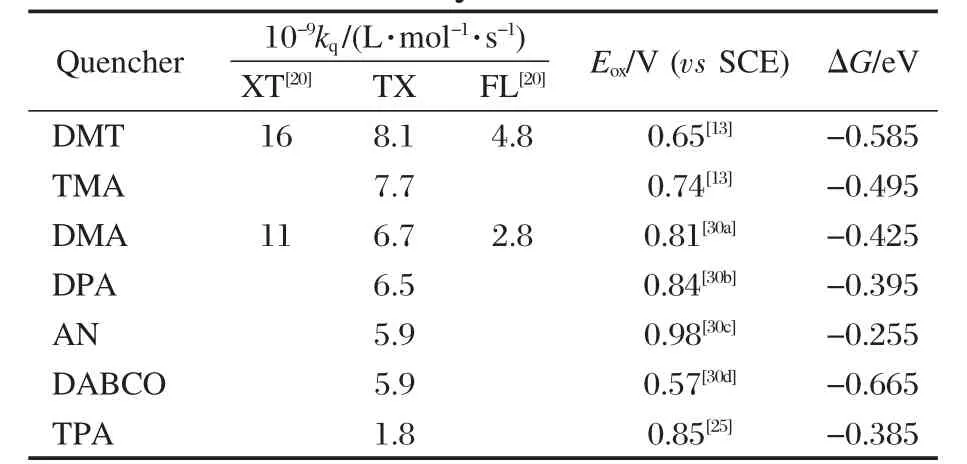
表3 胺类猝灭TX三重态的速率常数kq,胺类在乙腈中的氧化电势Eox(vs SCE),TX三重态与胺类反应的自由能变ΔGTable 3 kqfor the triplets of TX by amines,Eox(vs SCE)of amines in acetonitrile,ΔG for the triplets of TX by amines

图6 XT、TX、FL的分子结构Fig.6 Molecular configurations of XT,TX and FL
2.7 与胺类、酚类、醇类和呫吨酮、芴酮三重态反应[20]的比较
呫吨酮、噻吨酮、芴酮是分子结构比较类似的三个分子,如图6所示,连接两个苯环的分别是氧原子、硫原子和单键.氧原子和硫原子电负性分别为3.44和2.58,均表现出一定的吸电子能力[32],使激发双键氧原子的得电子能力加强,从表2、3中看到速率常数按照呫吨酮、噻吨酮、芴酮的顺序逐渐减小,进一步证明了电子或者电荷转移影响反应速率常数的机理.噻吨酮与醇类反应的速率常数比呫吨酮小2个数量级(表1),可能由于硫原子吸电子能力弱于氧原子,使双键氧原子对氢原子的作用力小于呫吨酮,减慢C—H键的断裂.
3 结 论
本实验得到了TPA、DMT、TMA、4-苯基苯酚、对苯二酚、4-溴苯酚、2-苯乙醇与三重态噻吨酮反应的瞬态吸收光谱,通过光谱上自由基吸收峰的时间演变及速率常数的变化,推断出如下反应机理:三重态噻吨酮与无活泼氢的胺类发生电子转移反应,与有活泼氢的胺类发生电子-质子转移反应.猝灭速率常数随着ΔG的增大逐渐变小,TPA、DABCO较小的猝灭速率常数可归因于相关的反应缺少质子转移的影响.与酚类反应的猝灭速率常数随着ΔG的增大先减小后增大,可以解释为发生电子转移后又发生了氢转移反应,由于酚阳离子酸性逐渐增大,其供氢能力逐渐增强,导致猝灭速率常数逐渐变大.与醇类反应的猝灭速率常数随着醇类α-C—H键能的增大而减小,表明发生了直接的氢转移反应.比较胺类、酚类、醇类分别猝灭XT、TX、FL三重态反应的结果可知,这些反应有相似的电子或电荷转移机理,但由于分子结构差异性的影响,分子中含有吸电子能力较强的原子猝灭速率常数较大,即相关反应的猝灭速率常数按照XT、TX、FL的顺序逐渐减小.
1 Morlet-Savary,F.;Ley,C.;Jacques,P.;Wieder,F.;Fouassier,J.P. J.Photochem.Photobiol.A-Chem.,1999,126:7
2 Allonas,X.;Ley,C.;Bibaut,C.;Jacques,P.;Fouassier,J.P.Chem. Phys.Lett.,2000,322:483
3 Okano,L.T.;Barros,T.C.;Chou,D.T.H.;Bennet,A.J.J.Phys. Chem.B,2001,105:2122
4 Satzger,H.;Schmidt,B.;Root,C.;Zinth,W.;Fierz,B.;Krieger,F.; Kiefhaber,T.;Gilch,P.J.Phys.Chem.A,2004,108:10072
5 Zhu,Q.Q.;Schnabel,W.J.Chem.Soc.Faraday Trans.,1991,87: 1531
6 Yates,S.F.;Schuster,G.B.J.Org.Chem.,1984,49:3349
7 Inbar,S.;Linschitz,H.;Cohen,S.G.J.Am.Chem.Soc.,1980, 102:1419
8 Guttenplan,J.B.;Cohen,S.G.J.Am.Chem.Soc.,1972,94:4040
9 Simon,J.D.;Peters,K.S.J.Am.Chem.Soc.,1981,103:6403
10 Wang,J.T.;Pan,Y.;Zhang,L.M.;Yu,S.Q.Chinese Journal of Chemical Physics,2007,20:395 [王金婷,潘 洋,张立敏,俞书勤.化学物理学报,2007,20:395]
11 Stevenson,J.P.;DeMaria,D.;Reilly,D.;Purvis,J.D.;Graham,M. A.;Lockwood,G.;Drozd,M.;O′Dwyer,P.J.Cancer Chemother. Pharmacol.,1999,44:228
12 Izbicka,E.;Lawrence,R.;Davidson,K.;Rake,J.B.;VonHoff,D. D.Invest.New Drugs,1999,16:221
13 Pan,Y.;Fu,Y.;Liu,S.X.;Yu,H.Z.;Gao,Y.H.;Guo,Q.X.;Yu, S.Q.J.Phys.Chem.A,2006,110:7316
14 Dalton,J.C.;Montgomery,F.C.J.Am.Chem.Soc.,1974,96: 6230
15 Ferreira,G.C.;Schmitt,C.C.;Neumann,M.G.J.Braz.Chem. Soc.,2006,17:905
16 Scigalski,F.;Paczkowski,J.Macromol.Chem.Phys.,2008,209: 1872
17 Das,D.;Nath,D.N.J.Phys.Chem.A,2008,112:11619
18 Bordwell,F.G.;Cheng,J.P.J.Am.Chem.Soc.,1991,113:1736
19 Denisov,E.T.;Denisova,T.G.Handbook of antioxidants.Boca Raton:CRC Press,2000:24
20 Wang,J.T.Laser flash photolysis studies on some organic molecules[D].Hefei:University of Science and Technology of China,2009 [王金婷.若干有机分子的激光闪光光解研究[D].合肥:中国科学技术大学,2009]
21 Pan,Y.;Sheng,Z.Y.;Ye,X.D.;Ao,Z.;Yu,S.Q.J.Photochem. Photobiol.A-Chem.,2005,174:98
22 Pan,Y.;Sheng,Z.Y.;Li,J.;Dai,J.H.;Chu,G.S.;Yu,S.Q.ActaChim.Sin.,2004,62:1293 [潘 洋,盛震宇,李 江,戴静华,储高升,俞书勤.化学学报,2004,62:1293]
23 Murov,S.L.;Carmichael,I.;Hug,G.Handbookofphotochemistry. 2nd ed.New York:Marcel Dekker,1993:111,346-348
24 Corrales,T.;Peinado,C.;Catalina,F.;Neumann,M.G.;Allen,N. S.;Rufs,A.M.;Encinas,M.V.Polymer,2000,41:9103
25 Bartholomew,R.F.;Davidson,R.S.;Lambeth,P.F.;Mckellar,J. F.;Turner,P.H.J.Chem.Soc.Perkin Trans.,1972,2:577
26 Das,P.K.;Encinas,M.V.;Steenken,S.;Scaiano,J.C.J.Am. Chem.Soc.,1981,103:4162
27 Yoshihara,T.;Yamaji,M.;Itoh,T.;Shizuka,H.;Shimokage,T.; Tero-Kubota,S.Phys.Chem.Chem.Phys.,2000,2:993
28 Rehm,D.;Weller,A.Isr.J.Chem.,1970,8:259
29 Bard,A.J.;Faulkner,L.R.Electrochemical methods,fundamentals and applications.New York:John Wiley,1980:701
30 (a)Nocera,D.G.;Gray,H.B.J.Am.Chem.Soc.,1981,103:7349 (b)Dvorak,V.;Nemec.I.;Zyka,J.J.Microchem.J.,1967,12:99 (c)Pan,Y.;Tang,W.J.;Yu,T.Q.;Wang,J.T.;Fu,Y.;Wang,G. W.;Yu,S.Q.J.Lumin.,2007,126:421 (d)Nelsen,S.F.;Hinz,P.J.J.Am.Chem.Soc.,1972,94:7114
31 Herkatroeter,W.G.;Lamula,A.A.;Hammond,G.S.J.Am.Chem. Soc.,1964,86:4537
32 Cao,X.Z.;Song,T.Y.;Wang,X.Q.Inorganic chemistry.3rd ed. Beijing:Higher Education Press,1994:114-116 [曹锡章,宋天佑,王杏乔.无机化学.北京:高等教育出版社,1994:114-116]
Photoinduced Electron and Hydrogen Transfer Reactions of Thioxanthone with Amines,Phenols and Alcohols
SUN Qian WANG Jin-Ting ZHANG Li-Min*YANG Mao-Ping
(Department of Chemical Physics,University of Science and Technology of China,Hefei 230026,P.R.China)
The quenching reactions of triplet thioxanthone(TX)by a series of amines,phenols,and alcohols were investigated by laser flash photolysis in deoxygenated acetonitrile.We obtained corresponding transient absorption spectra and quenching rate constants(kq).From changes in the transient absorption spectra,we determine that the electron transfer reactions occur between triplet TX and amines without an active hydrogen while electron/proton transfer reactions occur between triplet TX and amines with an active hydrogen.The appearance of hydrogenated radicals can be regarded as evidence for hydrogen transfer reactions in the TX/phenol and TX/alcohol systems.In the TX/amine systems,the quenching rate constants decreased with an increase in the free energy change(△G).This indicates that electron transfer reactions influence the quenching of triplet TX.In the TX/phenol systems,the quenching rate constants decreased with an increase in△G firstly,then increased with an increase in phenol cation acidity.This can be explained by considering that charge transfer and hydrogen transfer may play separate but important roles.In the TX/ alcohol system,the quenching rate constants decreased with an increase in the α-C—H bonding energy of alcohols, and this indicates that the α-C—H bonding energy is a key factor during triplet TX quenching.By comparison with previous studies about the quenching reactions of triplet xanthone(XT)and fluorenone(FL)by a series of amines, phenols,and alcohols,it is established that because of a discrepancy in molecular configurations the quenching rate constants decrease according to the following order:XT,TX,and FL.
Electron transfer;Hydrogen transfer;Thioxanthone;Amines;Phenols;Alcohols
O644
Received:April 12,2010;Revised:May 24,2010;Published on Web:July 19,2010.
*Corresponding author.Email:lmzha@ustc.edu.cn;Tel:+86-551-3601119.
The project was supported by the National Natural Science Foundation of China(20673108).
国家自然科学基金(20673108)资助项目
ⒸEditorial office of Acta Physico-Chimica Sinica
