CRH在正常与抑郁症大鼠皮质分布的研究
2010-11-02唐晓伟陈晓杰胡铁中刘晓庆
唐晓伟,陈晓杰,胡铁中,刘晓庆,刘 文
(安徽中医药高等专科学校 基础教学部,安徽 芜湖241000)
CRH在正常与抑郁症大鼠皮质分布的研究
唐晓伟,陈晓杰,胡铁中,刘晓庆,刘 文
(安徽中医药高等专科学校 基础教学部,安徽 芜湖241000)
以SD雄性大鼠为材料,采用慢性轻度不可预见性应激+孤养方法复制大鼠抑郁模型,比较促肾上腺皮质激素释放激素(CRH)免疫阳性神经元在大鼠大脑皮质的区域分布特征。结果显示:CRH免疫阳性神经元在皮层的各层均有分布;与对照组(NC组)相比,模型组(MC组)大鼠CRH免疫阳性细胞在大脑皮质的运动皮质(M)、感觉皮质(S)、听皮质(Au)、梨形皮质(Pir)显著增加,嗅皮质(Ol)也有增加但不明显。结论:CRH免疫反应阳性细胞在大脑皮层内广泛分布,抑郁大鼠CRH在皮质的表达增加,提示其可能参与应激反应。
促肾上腺皮质激素释放激素;慢性轻度不可预见性应激;孤养模型;免疫组织化学;大脑皮质;大鼠
下丘脑分泌的促肾上腺皮质激素释放激素(CRH),因其可能通过调节下丘脑-垂体-肾上腺轴(HPA)参与应激反应而受到人们的关注。但CRH在皮层内的区域分布及其在应激反应中的变化未见报道。本研究采用免疫组织化学方法,研究CRH免疫阳性神经元在大脑皮层的区域分布特征,对其在正常大鼠与抑郁模型大鼠运动皮质(M)、感觉皮质(S)、听皮质(Au)、嗅皮质(Ol)和梨形皮质(Pir)的分布进行比较,以希为进一步研究CRH与应激反应的相关性提供一定的理论和实验依据。
1 材料和方法
1.1 实验动物
SD大鼠,雄性,体重250-300g,由安徽省动物中心提供。
1.2 抑郁模型的建立及评价
1.2.1 动物分组
动物购回后在安静、室温20-22℃、自然光照、自由进食进水的环境中适应性喂养1周。通过敞箱试验将穿越格数加后肢直立次数不足30次或超过120次的大鼠剔除,随机分为NC和MC组,每组10只。
1.2.2 模型的建立
适应性喂养结束后,结合 Willner等[1]以及Forbe等[2]的方法,用慢性应激结合孤养的方式造模。MC组单笼饲养,给予7种不同的刺激,即:冰水游泳(4℃,5min)、夹尾(3min)、禁水(24h)、禁食(24h)、鼠笼倾斜45°(24h)、温箱(45℃,5min)、摇晃(3Hz/s,5min),每天随机安排 1种,每种刺激在实验全程中使用3次,共21d。NC组每笼5只喂养,不予任何刺激。
1.2.3 模型的评价
采用Open-field测试和液体消耗试验对抑郁模型进行评价。Open-field测试方法为:造模前1d及造模结束后,早8:30~12:00之间在安静的房间内,按Kennett等的方法[3],观察大鼠在5分钟内中央格停留时间、穿越格数、后肢直立次数和清洁运动次数,敞箱装置采用不透明黑色材料,底面为90cm×90cm的正方形,用白线划分为面积相等的16块,周围有高40厘米的墙壁。液体消耗试验测试方法为:造模前2d及造模结束后,按照Benelli等的方法[4],在24小时禁食禁水后,同时给予每只大鼠事先定量好的两瓶水:一瓶1%蔗糖水,一瓶纯水,120分钟后取走两瓶并称重,计算糖水偏爱(糖水偏爱= 糖水消耗/总液体消耗×100%)。
1.3 组织标本的制备
两组大鼠在规定时间点用7%水合氯醛(5ml/Kg)腹腔注射麻醉后开胸,升主动脉插管,快速灌注生理盐水冲洗后再灌注4%多聚甲醛(PFA)(4℃,PH7.4),取脑,4%PFA后固定,蔗糖水梯度脱水,恒冷冰冻切片机(Leica CM1900)连续冠状切片,片厚30μm,取 M区、S区、Au区、Ol区和Pir区互包平面,直接贴在处理过的玻片上。
1.4 CRH阳性细胞检测
采用ABC法标记CRH阳性细胞,具体步骤如下:4%PFA补固定10min;0.3%H2O2和1%Trion X100混合液孵育切片30min(避光);5%羊血清封闭30min(37℃);兔抗的CRH 血清(1:2000,Bachem 公司 T-4037)孵育60min(37℃)后4℃孵育12h;生物素化山羊抗兔的IgG(1:200,Vector公司 BA-1000)孵育60min(37℃);ABC液(1:200,Vector公司 CA94010)孵育60min(37℃);上述各步骤间均用PBS洗3次,每次5min。DAB硫酸镍铵加强呈色,梯度酒精脱水,二甲苯透明,中性树胶封片。显微镜观察并拍照。阴性对照组用PBS代替一抗。
1.5 CRH免疫阳性细胞在大脑皮质分布层次及区域的测定
选取正常对照组和模型组各10只大鼠相同皮质部位的3张30μm切片,在显微镜(10×20)下通过Camera lucida将CRH神经元描绘于白纸上。从皮层表面至白质在纸上标出宽为1mm的柱状范围,层次的边界通过邻近的H-E染色切片确定;计数每个层次的阳性细胞数,压在右、上线的细胞计数,而左、下线的细胞则不计。根据George Paxinos等的大鼠脑定位图谱,划分出M区,S区,Au区,Ol区及Pir区,计数每个区域的阳性细胞数,压在右、上线的细胞计数,而左、下线的细胞则不计。
1.6 统计方法
用SPSS11.0进行数据t检验处理。描述性统计值用平均值±标准差表示,显著性水平设置为α=0.05。
2 结果
2.1 open-field测试结果
与NC组相比,第21dMC组穿越格数、后肢直立次数、清洁运动次数及糖水偏爱度显著减少,中央格停留时间延长。(表1)

表1 正常组与抑郁症大鼠敞箱实验中运动行为及糖水偏爱度比较
2.2 细胞层次分布
CRH免疫反应性神经元散在地分布于皮层内Ⅰ~ Ⅵ层,其中Ⅱ、Ⅲ 层相对较多,Ⅰ 层次之,Ⅳ、Ⅴ层较少,Ⅵ层偶见分布(图1)。NC组每1000μm宽度的皮层范围内的平均阳性细胞数为3.83±0.35个,MC组每1000μm宽度的皮层范围内的平均阳性细胞数为10.6±0.69个。

图1 Camera lucida描绘的CRH细胞在大脑皮质的层次分布,切片30μm厚,1000μm宽的柱形方块内,CRH神经元见于Ⅰ~Ⅵ层,以Ⅰ~Ⅲ层较多。标尺示400μm
2.3 细胞的区域分布
CRH免疫反应阳性神经元在大鼠大脑皮质的M区,S区,Au区,Ol区及Pir区都有分布(表2)。其中 MC组大鼠与NC组相比,CRH在皮质分布的总数及在 M区,S区,Au区和Pir区均显著增加,Ol区增加但没有显著差异。
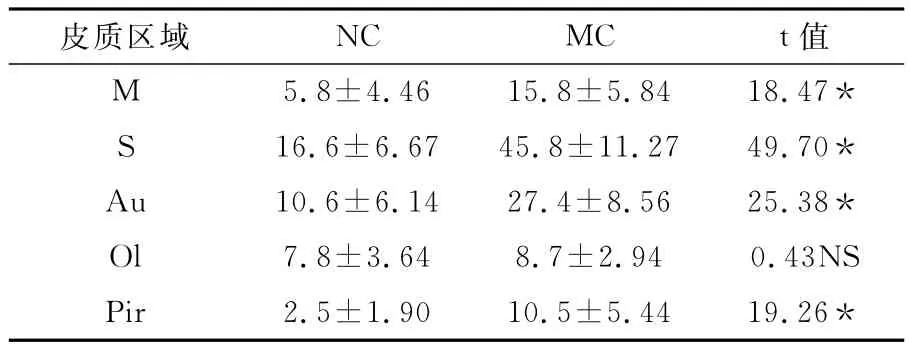
表2 两组大鼠CRH神经元在大脑皮质各区的表达
3 讨论
目前,国际上抑郁症病理生理研究较为理想的模型之一是CUMS模型[1],对已建立模型的评价,则采用液体消耗实验和Open-field测试,将液体消耗实验中糖水偏爱度显著降低作为测量快感缺乏的客观指标,Open-field测试中穿越方格数目的减少用以反映动物活动度的降低,后肢直立次数减少和中央格停留时间延长用以反映动物对新鲜环境好奇程度的降低,清洁动作次数减少用以反映动物对周围环境的要求及对自身的关注下降[4,5]。本实验中我们采用CUMS+孤养方式建立了抑郁模型,并对其进行了评价,结果显示,与NC组相比,MC组大鼠1%糖水偏爱度显著下降,后肢直立次数、穿越格数、清洁运动次数均显著减少,中央格停留时间显著增加,表明该模型反映了动物对幸福事件反应能力的下降、活动能力下降和兴趣丧失,与抑郁症临床表现中的精神运动性阻抑症状相似,符合相关国际标准,可用于研究抑郁症的发病机制[6]。
促肾上腺皮质激素释放激素(CRH)被认为是与抑郁症发病密切相关的物质。近年来的研究显示,CRH不仅存在于中枢神经系统,还广泛地存在于卵巢、睾丸、肾上腺髓质、心、肝、小肠、大肠等消化道以及胰腺等组织内。在受到应激刺激时,中枢神经系统内的CRH增多,其中下丘脑室旁核(PVN)分泌的CRH经垂体门脉血流到达垂体并刺激垂体分泌促肾上腺皮质激素(ACTH),后者经血液循环到达肾上腺,刺激肾上腺皮质的束状带-网状带合成、分泌以皮质醇为中心的糖皮质激素(GC),促使机体各组织发生应激防御反应,CRH还可通过植物神经系统协调心血管消化系统的运动及吸收功能,甚至可调控炎性反应和个体及行为,提示其可能具有强大的全面调控人体应激反应的功能[7,8]。
本实验中,我们通过免疫组化方法对CRH在NC组与MC组大鼠大脑皮质 M区、S区、Au区、Ol区和Pir区的表达量进行了比较,结果显示,CRH在MC组大鼠大脑皮质上述区域总表达量显著增加,其中在 M区、S区、Au区和Pir区的表达量均显著高于NC组,而在Ol区没有显著差异,提示大脑皮质CRH的表达与应激刺激有关。同时我们也注意到,大脑皮质部位CRH细胞轴突的走向与脑膜垂直,提示大脑皮质中的CRH即可能直接分泌到相应的部位发挥调控作用,也可能通过改变脑脊液中CRH的量而调节机体对应激的自主神经和情绪行为反应,应激刺激时中枢神经系统CRH增加的来源值的进一步关注。
[1]Willner P.Validation criteria for animal models of human mental disorders:learned helplessness as a paradigm case[J].Prog Neuro psychopharmaca Biol Psychiatry,1986,10(6):677-690.
[2]Forbes NF.Caroline A.Keith Matthews.et al.Chronic mild stress and sucrose consumption:validity as a mod el of depression[J].Physiology &Behavior,1996.60:1481-1484.
[3]Kennett GA,Dickinson SL,Curzon G.Enhancement of some 5-HT-dependent behavioural responses following repeated immobilization in rats[J].Brain Research,1985,330:253-263.
[4]Forbes NF,Caroline A.Keith Matthews,et al.Chronic mild stress and sucrose consumption:validity as a mod el of depression[J].Physiology &Behavior,1996,60:1481-1484.
[5]Yadid G,Nakash R,DeriI,et al.Elucidation of the neurobiology of depression:insights from a novel genetic animal model[J].Prog Neurobiol,2000,62:353-358.
[6]Marta K,Agicszaka B,Vladimir H,et al.Effect of mild chronic stress,as a model of depression,on the immunoreactivity of C57BL/6mice[J].International Journal of Immunopharmacology,1998,20:781-789.
[7]Drew E.Carlson,William C.Chiu Suzelle M.Fiedler et al.Central neural distribution of immunoreactive Fos and CRH in relation to plasma ACTH and corticosterone during sepsis in the rat[J].Experimental Neurology,2007,6:485-500.
[8]Culman J,Das G,Ohlendorf C,et al.Blockade of tachykinin NK1/NK2receptors in the brain attenuates the activation of corticotrophin-releasing hormone neurones in the hypothalamic paraventricular nucleus and the sympathoadrenal and pituitary-adrenal responses to formalin-induced pain in the rat[J].Neuroendocrinol,2010,22(5):467-476.
On Distribution of Corticotropin Releasing Hormone in Cortex of Normal and Depressed Rats
Tang Xiaowei,Chen Xiaojie,Hu Tiezhong,Liu Xiaoqing,Liu Wen
(Department of Basic Sciences,Anhui Junior College of Traditional Chinese Medicine,Wuhu 241000,China)
To explore distribution characteristics of immunopositive neurons for the corticotrophin releasing hormone(CRH)in the cerebral cortex of rats as well as changes in depressed rats.Methods:20 SD male rats were randomized into control group(NC group),model control group(MC group),with 10rats in each group.The depression model was achieved by chronic unpredictable mild stress plus solitary breeding.The immunohistochemistry method was used to observe immunopositive neurons for CRH in different regions of the cerebral cortex of the rats,comparing distribution differences of the neurons in cortex regions of rats in both groups.Results:Immunopositive neurons for CRH were distributed in all layers of the cortex.Compared to rats in the NC group,rats in the MC group significantly increased their expression of CRH in the cortex,particularly in the motor cortex(M),sensory cortex(S),auditory cortex(Au),and pyriform cortex(Pir).The CRH expression in the olfactory cortex(Ol)was also intensified but not significant.Conclusions:Immunopositive neurons for CRH were extensively distributed in the cerebral cortex of the rats and the depressed rats increased the expression of CRH in the cortex,suggesting their involvement with stress response.
corticotrophin releasing hormone;chronic unpredictable mild stress + solitary breeding model;immunohistochemistry;cerebral cortex;rat
R749.4
:A
:1673-1794(2010)05-0032-03
唐晓伟(1968-),女,副教授,主要从事抑郁症发病机制的基础研究。
安徽省教育厅自然科学基金(KJ2008B224)
2010-05-14
