反相高效液相色谱-电喷雾质谱法测定浒苔中的叶黄素
2010-10-19程红艳陈军辉赵恒强王小如臧家业
程红艳,陈军辉,*,赵恒强,史 倩,王小如,2,臧家业
(1.国家海洋局第一海洋研究所海洋生态研究中心,山东 青岛 266061;2.厦门大学化学化工学院,福建 厦门 361005)
反相高效液相色谱-电喷雾质谱法测定浒苔中的叶黄素
程红艳1,陈军辉1,*,赵恒强1,史 倩1,王小如1,2,臧家业1
(1.国家海洋局第一海洋研究所海洋生态研究中心,山东 青岛 266061;2.厦门大学化学化工学院,福建 厦门 361005)
建立反相高效液相色谱-电喷雾电离质谱法(RP-HPLC-DAD-ESI-MS)定性、定量测定绿潮藻浒苔中叶黄素的新方法。浒苔样品经超声辅助提取后,采用RP-HPLC-DAD-ESI-MS联用技术对其进行分离鉴定,HPLC采用Eclipse XDB-C18(150mm×4.6mm,5μm)色谱柱,以含0.2%乙酸的甲醇溶液-水为流动相,线性梯度洗脱,检测波长450nm。在选定的最佳仪器条件下,叶黄素与浒苔中的其他化合物分离良好,叶黄素在0.10~20.0mg/L质量浓度范围内具有良好的线性关系(R2=0.9994),能对浒苔提取液中的叶黄素进行准确定量;采用电喷雾质谱联用分析能快速获得叶黄素的分子量信息,可为浒苔中叶黄素的快速鉴别提供依据。
浒苔;叶黄素;高效液相色谱-电喷雾质谱法
Abstract:A reversed-phase high performance liquid chromatography-diode array detector-electrospray ionization mass spectrometry (RP-HPLC-DAD-ESI-MS) method was established for qualitative identification and quantitative determination of lutein inEnteromorpha prolifera. Lutein was extracted fromEnteromorpha proliferathrough ultrasound-assisted extraction,and then analyzed by RP-HPLC-DAD-ESI-MS. HPLC was carried out at the conditions of Eclipse XDB-C18 (4.6 mm × 150 mm) column, MeOH-0.2% acetic acid-water (V/V) as the mobile phase with linear gradient elution and detection wavelength of 450 nm. Results indicated that the developed method could be used for the determination of lutein inEnteromorpha proliferawith a good resolution and linear relationship in the range from 0.10 to 20.0 mg/L (R2=0.9994). Molecular weight of lutein was rapidly evaluated by ESI-MS detection. Combined with literature information, lutein inEnteromorpha proliferacould be rapidly identified. This developed method is specific, simple, fast, sensitive and feasible for rapid identification and quantification of lutein, which can eliminate the interference of other pigments and derivatives fromEnteromorpha prolifera.
Key words:Enteromorpha prolifera;lutein;HPLC-ESI-MS
叶黄素是类胡萝卜素的一种,广泛存在于蔬菜、花卉、水果及某些藻类生物中,在植物光合作用中起到保护作用[1]。近些年研究表明,叶黄素具有多种重要的生理功能[2-3],可治疗白内障,调节人体免疫力,预防癌症以及视黄斑退化,还具有明显的防辐射、护肤、润肤和抗衰老等作用,此外,叶黄素还是一个很好的天然着色剂,因而引起人们的重视。尽管大部分植物的叶片、花朵及果实中均含有叶黄素,但我国当前主要将万寿菊、金盏菊作为叶黄素分离提取的资源[4],来源有限,导致叶黄素的价格居高不下,开发新的资源尤为重要。
海洋植物中叶绿素和辅助色素的含量高于陆生植物,而且海洋植物生长快、产量大,是天然叶黄素开发的良好原料[5]。近两年青岛附近海域爆发的浒苔绿潮,打捞出大量浒苔藻,为天然叶黄素的开发提供了丰富的资源。然而目前国内还没有关于绿潮藻浒苔中叶黄素定性、定量测定的报道,也缺乏浒苔中叶黄素快速测定的有效方法。目前,对于叶黄素的分析和检测国内外已有一些方法[6],如分光光度法、薄层色谱法(TLC)、高效液相色谱法(HPLC)、质谱法(MS)等。其中HPLC法作为一种快速的分析方法,具有样品处理简单、分离效果好、选择性强、检测灵敏度高等优点[7-8]被应用于部分植物和食品的叶黄素的定量测定[9-10]。高效液相色谱-质谱(HPLC-MS)联用技术是天然产物有效成分定性、定量分析强有力的工具[11-12]。至今,采用LCMS法测定叶黄素的报道还极少,仅Lakshminarayana等[13]利用液相色谱-大气压化学电离质谱法分析人体内黄斑叶黄素的代谢产物。但对于利用高效液相色谱-电喷雾电离质谱法(HPLC-ESI-MS)法分析测定浒苔中的叶黄素研究国内外文献未见报道。本研究采用超声波辅助提取法对浒苔中的叶黄素进行高效快速提取,通过对色谱条件的系统优化,建立浒苔中叶黄素HPLC-DAD定量测定方法,并建立HPLC-ESI-MS鉴别浒苔中叶黄素的方法。
1 材料与方法
1.1 材料、试剂与仪器
浒苔样品为2008年7月份采自青岛海域近岸,在-76℃的超低温冰箱中冷冻保存。
甲醇、乙腈和丙酮(均为色谱纯) 德国Merck公司;乙酸(优级纯);抗坏血酸(VC)及其他试剂均为国产分析纯;芦丁(纯度98%,叶黄素标准品) 中国药品生物制品检定所;实验中所用溶液均用超纯水配制,HPLC用试剂均经过0.45μm微孔滤膜过滤及超声脱气处理。
1200高效液相色谱仪(配有二极管阵列检测器(DAD)、自动进样器、四元梯度泵)、G6320型电喷雾离子阱质谱仪、Eclipse XDB-C18色谱柱(150mm×4.6mm,5μm) 美国Agilent公司; KQ-400KDE 型高功率数控超声波仪 昆山市超声仪器有限公司;R201型旋转蒸发仪 上海申生科技有限公司;FA1104型电子天平 上海精天电子仪器厂;Milli-Q(18.2MΩ)超纯水处理系统 美国Millipore公司。
1.2 方法
1.2.1 色谱条件
Eclipse XDB-C18(150mm×4.6mm,5μm)色谱柱;流动相:水(A),含0.2%乙酸的甲醇溶液(B),梯度洗脱程序为:0~8min,98% B;8~10min,98%~100%B;10~25min;100% B。柱温25℃,流速0.8mL/min,DAD检测器在450nm波长处检测,进样量为50μL。
1.2.2 质谱条件
HPLC-MS条件:电喷雾离子源(ESI),正离子电离,参数设定方式:智能设定(Smart),干燥气温度350℃,喷雾气压40psi,干燥气(N2)流速10.0L/min,目标质荷比为m/z600,化合物稳定性100%,捕集效率100%,质量扫描范围m/z100~1000。
HPLC-MS2条件:电喷雾离子源(ESI),正离子电离,参数设定方式:智能设定(Smart),干燥气温度350℃,喷雾气压40psi,干燥气(N2)流速10.0L/min,目标质荷比为m/z600,化合物稳定性100%,捕集效率100%;检测方式:手动多级质谱检测(Manual MSn),二级质谱母离子m/z589,二级质谱碰撞电压1.00V,碰撞气体为氦气。
1.2.3 标准溶液的配制
准确称取叶黄素标准品5.0mg,置于100mL容量瓶中,用丙酮定容至100mL得到质量浓度为50mg/L的叶黄素标准储备液,取少量标准品储备液稀释至合适质量浓度,用于色谱条件的优化和标准曲线的绘制,标准品储备液密封后置于冰箱中-4℃冷藏保存。
1.2.4 供试品溶液的制备
将浒苔冷冻干燥,存放于冰箱冷藏状态下备用。平行精密称取3份干浒苔样品各0.05g,置于15mL玻璃离心管中,加入1mL的质量浓度不高于1.0g/L的VC溶液,避光浸润5min后,加入5mL丙酮,采用避光冰浴超声,超声功率320W,提取时间8min,用0.45μm微孔滤膜过滤,置于棕色进样瓶中,待测。
2 结果与分析
2.1 色谱条件的优化
2.1.1 色谱柱的选择
据文献[9-10]报道,反相HPLC技术较常用于叶黄素的分析测定,而甲醇-水-丙酮以及甲醇-丙酮混合液多作为分离叶黄素的流动相;考虑到叶黄素是一种极性较小、易于被反相柱保留的化合物,而浒苔粗提物所含的化合物又较为复杂,实验以不同比例的水-甲醇混合液为流动相,对4根不同特点的反相C18柱进行比较优化,结果发现,不同特点的色谱柱对浒苔中叶黄素分离结果差异较大,4根色谱柱当中Agilent公司的Eclipse XDB-C18所获得的分离结果最为理想(各峰分离度高,峰型对称),这就说明在浒苔中叶黄素的HPLC分析中,选择合适的色谱柱是非常关键的。
2.1.2 流动相的选择
在选定色谱柱之后,对以水-甲醇以及甲醇-水-丙酮为流动相进行比较,结果表明以水-甲醇为流动相时分离效果较好;在流动相中添加一定量的酸或缓冲盐可以改善分离效果以及色谱峰形。在本研究中分别将少量的磷酸、乙酸、乙酸氨、磷酸盐加入流动相中,结果表明在流动相中添加0.2%的乙酸就能获得理想的分离结果,并且使用乙酸配制流动相简单方便、不损坏柱子和仪器硬件,乙酸具有挥发性与质谱检测器兼容,利于液相色谱-质谱联用分析叶黄素方法的开发。
2.1.3 测定波长的选择

图1 叶黄素的DAD扫描光谱图Fig.1 DAD scan spectrum of lutein
叶黄素在可见光区有较强的特征吸收峰,为了使叶黄素能获得较高的灵敏度,本研究通过DAD全波段扫描(300~800nm),考察不同检测波长对叶黄素测定灵敏度的影响(叶黄素的扫描光谱图见图1),结果表明450nm为检测波长时,叶黄素检测的灵敏度较高,并且能排除其他化合物的干扰,因此选择450nm作为浒苔中叶黄素测定的最佳检测波长,与文献[10]报道结果一致。
2.2 超声波辅助提取条件的优化
2.2.1 超声功率对叶黄素提取效果的影响
常温条件下,称取浒苔干样品0.05g,置于15mL玻璃离心管中,加入1mL的超纯水,避光浸润5min后,加入5mL丙酮,超声波提取3min,进行测定,根据叶黄素峰面积考察超声功率对浒苔中叶黄素提取效果的影响。

图2 超声功率对叶黄素提取效率的影响Fig.2 Effect of ultrasonic power on extraction efficiency of lutein fromEnteromorpha prolifera
从图2可以看出,超声功率对叶黄素的提取效果的影响不大。随着功率的增加,叶黄素色谱峰峰面积逐渐升高,当超声波功率为320W时,叶黄素的峰面积升至最高,而后略有下降。超声波功率小,叶黄素提取不完全,功率太大可能造成叶黄素分解,含量下降。由此可知,采用超声波提取浒苔叶黄素,最适频率应选择在320W左右。
2.2.2 超声时间对叶黄素提取效果的影响
常温条件下,称取浒苔干样品0.05g,置于15mL玻璃离心管中,加入1mL的超纯水,避光浸润5min后,加入5mL丙酮,超声功率为320W,进行不同时间超声提取,进行测定,根据叶黄素峰面积考察超声时间对浒苔中叶黄素提取效果的影响。
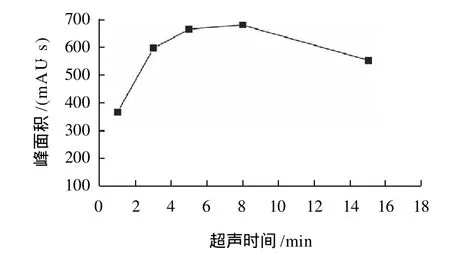
图3 超声时间对叶黄素提取效率的影响Fig.3 Effect of ultrasonic time on extraction efficiency of lutein fromEnteromorpha prolifera
从图3可以看出,超声时间对叶黄素的提取效果影响较大。随着提取时间的逐渐增大,浒苔叶黄素的提取量也逐渐增大。提取时间为8min时,叶黄素的峰面积最高;8min之后随着提取时间的延长,叶黄素的提取量反而逐渐下降。由此可知,采用超声波提取浒苔叶黄素,最适提取时间在8min左右。
2.2.3 超声方式对叶黄素提取效果的影响
常温条件下,称取浒苔干样品0.05g,置于15mL玻璃离心管中,加入1mL的超纯水,避光浸润5min后,加入5mL丙酮,超声功率为320W,超声提取8min,进行测定,根据叶黄素峰面积考察超声方式对浒苔中叶黄素提取效果的影响。

表1 不同超声方式叶黄素提取效率结果(n=3)Table 1 Extraction efficiency of lutein using different ultrasonic modes (n=3)
从表1可以看出,避光超声对浒苔中叶黄素提取优于不避光超声提取。冰浴超声提取可以提高叶黄素的提取效果。由此可知,采用避光冰浴超声提取浒苔叶黄素是最佳的超声提取方式。
2.3 浒苔提取液中叶黄素的稳定性考察
2.3.1 提取溶剂对叶黄素稳定性的影响
据文献[4]报道,由于叶黄素是一种抗氧化剂,在溶液中不稳定,且在不同溶液中的稳定性不同;本研究取3份0.05g的干浒苔,其中两份用1mL超纯水避光浸润后,再分别用15mL的甲醇、丙酮超声提取;另外一份用1mL VC溶液避光浸润后,用15mL的丙酮超声提取,按1.2.4节方法将其制成供试品溶液,按1.2.1节色谱条件,在0、2、4、8、12、24h分别进样测定,测得叶黄素的峰面积。根据叶黄素峰面积与其0h的面积相对值考察其稳定性。

图4 提取溶剂对叶黄素稳定性的影响Fig.4 Effect of different solvents on the stability of lutein
从图4可以看出,不同的提取溶剂对叶黄素的稳定性影响显著。在10h内,丙酮提取液中的叶黄素稳定性在90%以上,高于甲醇提取液中的叶黄素。超过10h后,甲醇和丙酮提取液中的叶黄素的稳定性都在90%以下,但甲醇的叶黄素提取液的稳定性稍好。而丙酮+VC作为提取溶剂得到的叶黄素在24h内其稳定性都达到90%以上。可见,VC可以作为叶黄素的稳定剂。所以,本实验选择丙酮+VC作为最佳的提取溶剂。
2.3.2 VC溶液的质量浓度对叶黄素稳定性的影响
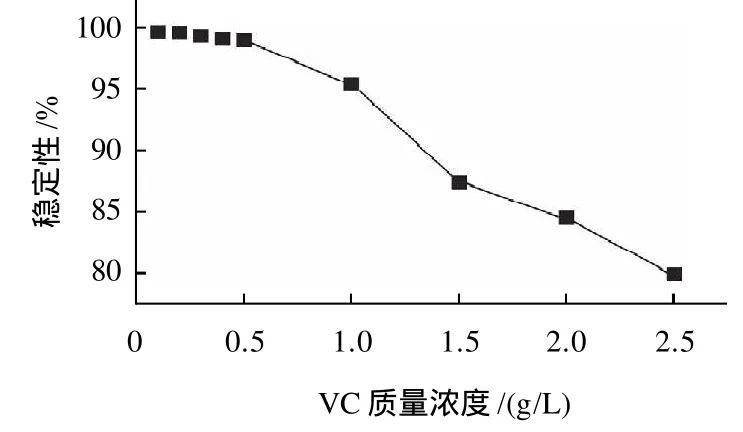
图5 VC质量浓度对叶黄素稳定性的影响Fig. 5 Effect of ascorbic acid concentration on the stability of lutein
由文献[14-15]可知,VC对叶黄素的存放有一定保护作用。配制从0.1~2.5g/L不同的9个质量浓度的VC溶液,按1.2.4处理方法将其制成供试品溶液,按1.2.1节色谱条件,在0、24h分别进样测定,测得叶黄素的峰面积。根据叶黄素峰面积的相对值考察其稳定性。
从图5可知,VC溶液质量浓度小于1.0g/L,叶黄素在24h内的稳定性在95%以上,质量浓度高于1.0g/L,叶黄素稳定性下降。可见,VC作为抗氧剂对叶黄素的稳定性有一定保护作用,但是其质量浓度不宜高于1.0g/L。
2.4 样品测定
2.4.1 浒苔中叶黄素的色谱测定
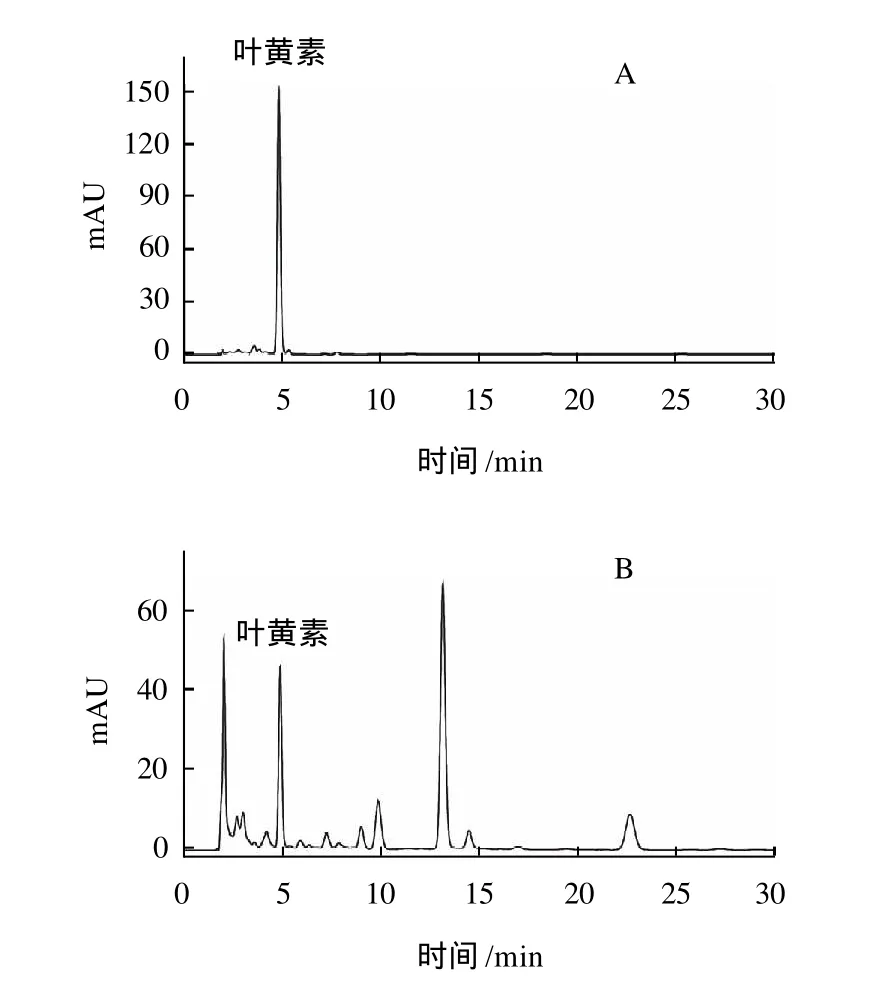
图6 叶黄素标准品(A)及浒苔提取液(B)高效液相色谱图Fig.6 HPLC chromatograms of lutein standard and the extract fromEnteromorpha prolifera
根据标准品的保留时间对浒苔中叶黄素的色谱峰初步定性,将样品测定色谱图与标准品色谱图进行比较,以确定叶黄素相应峰位。按1.2.1节色谱条件测定对照品溶液和供试品溶液,色谱图如图6所示,在选定色谱条件下叶黄素色谱峰对称性好,与其他组分达到基线分离,可准确测定其峰面积,以峰面积进行定量分析。
2.4.2 浒苔中叶黄素的质谱鉴别
对叶黄素标准品和浒苔提取液进行HPLC-MS检测,通过比较样品与标准品的色谱图(图6)和质谱图(图7)可以看出,浒苔提取液在同样的条件下该保留时间处的质谱碎片及其特征离子丰度(图7B)与标准品(图7A)一致,从而进一步证明该浒苔中含有叶黄素。叶黄素的分子量为568,电喷雾一级质谱分析特征离子为m/z589、306,其中m/z589峰为基峰,根据质量数确定m/z589离子为[M+Na-2H]+离子峰,而叶黄素分子离子峰m/z568[M]+信号十分微弱,没有看到准分子离子峰m/z569[M+H]+,说明采用电喷雾质谱分析叶黄素不易产生分子离子峰和准分子离子峰,易产生[M+Na-2H]+离子峰,另外,初步确定m/z306峰为[M+Na-2H]+离子峰的碎片峰。

图7 叶黄素标准品(A)和浒苔中叶黄素(B)HPLC-MS质谱图Fig.7 HPLC-MS spectra of lutein standard and lutein in the extract fromEnteromorpha prolifera

图8 叶黄素标准品(A)和浒苔中叶黄素(B)HPLC-MS2质谱图Fig.8 HPLC-MS-MS spectra of lutein standard and lutein in the extract fromEnteromorpha prolifera
为了进一步验证m/z306离子峰的来源,并探明叶黄素的电喷雾质谱分析裂解规律,以m/z589([M+Na-2H]+)离子峰为母离子,对叶黄素标准溶液和浒苔提取液中的叶黄素峰进行了二级质谱分析,样品和标准品的二级质谱见图8。样品在该保留时间处的二级质谱特征离子(图8B)与标准品(图8A)一致,确定m/z306([M+Na-C20H28O-H]+)峰为m/z589([M+Na-2H]+)离子峰的碎片峰,更进一步证明浒苔中含有叶黄素。根据叶黄素电喷雾一级和二级质谱特征,推断叶黄素电喷雾质谱分析可能的质谱裂解方式见图9。

图9 叶黄素裂解规律图Fig.9 Fragmentation pathways of lutein
2.5 方法学考察
2.5.1 标准曲线的绘制及检出限
本研究采用外标法对浒苔中叶黄素进行定量,用峰面积对质量做工作曲线,由试样峰面积求出其实际含量。取叶黄素标准液(质量浓度为50.00mg/L)再用色谱纯丙酮分别稀释成0.1、0.4、1.0、2.0、5.0、20.0mg/L,按1.2.1节色谱条件,以测定的峰面积为纵坐标,标准品的质量(ng)为横坐标绘制标准曲线,得叶黄素的标准曲线方程为:y=0.7281x-7.0804,R2=0.9994。
说明本方法测定叶黄素在0.10~20.0mg/L范围内线性关系良好。将标准溶液逐级稀释进样,测其峰高响应值及基线噪音强度,以RSN=3计算检出限。叶黄素的检出限为0.03mg/L。
2.5.2 精密度
取一份供试品溶液,重复测定5次(进样量为10μL),记录各次的峰面积和保留时间,叶黄峰面积的RSD值为1.13%,保留时间的RSD值为0.38%,表明仪器的精密度良好。
2.5.3 重复性
精密称取同一样品5份,按1.2.4节方法将其制成供试品溶液,分别进样测定,测得叶黄素的峰面积和保留时间,计算其相对标准偏差,叶黄素峰面积的RSD值为3.41%,保留时间的RSD值0.41%,表明该方法重复性良好。
2.5.4 稳定性
取一份供试品溶液,分别在0、0.5、1、1.5、2、2.5、3、8、16、24h进样测定,测得叶黄素的峰面积和保留时间,计算其相对标准偏差,叶黄素峰面积的RSD值为4.91%,保留时间的RSD值0.32%,显示供试品溶液至少在24h稳定。
2.5.5 加标回收率

表2 浒苔叶黄素加样回收率实验结果(n=3)Table 2 Recovery experiments for lutein fromEnteromorpha prolifera(n=3)
精密称取已知叶黄素含量的浒苔样品6份,加入一定量的叶黄素标准品溶液,然后按1.2.4节供试品溶液的制备方法处理,用1.2.1节色谱条件测定加样回收率。由表2可以看出,方法回收率较高,叶黄素的回收率均在97%以上,进一步说明本方法可用于浒苔样品中叶黄素含量的测定。
2.6 浒苔样品中叶黄素的含量测定
取5个不同采集地点的浒苔样品,每个样品取质量相等的3份,按1.2.4节方法将其制备成供试品溶液,按1.2.1节色谱条件测定供试品溶液,将测得的峰面积代入标准曲线方程,计算浒苔中叶黄素的含量,5个不同采集地点浒苔样品中叶黄素的测定结果见表3。

表3 浒苔样品中叶黄素的含量(n=3)Table 3 Lutein contents in differentEnteromorpha proliferasamples(n=3)
3 结 论
本研究建立反相高效液相色谱-电喷雾电离质谱法定性、定量测定绿潮藻浒苔中叶黄素的新方法。利用质量浓度不高于1.0g/L的VC溶液浸润浒苔样品,解决了叶黄素提取液不稳定的难题。经超声波提取优化选定提取浒苔中的叶黄素最佳条件,该方法简便易操作、提取效率高;所建立的HPLC-DAD测定浒苔中叶黄素的方法,在选定的色谱条件下,叶黄素分离度高,方法重复性好、回收率高,可作为浒苔中叶黄素含量快速测定的方法;采用HPLC-ESI-MS和HPLC-ESI-MS2可实现浒苔中叶黄素的快速鉴别,并由此推断出叶黄素的可能质谱裂解规律,该质谱分析方法专属性强,适用于天然产物中叶黄素快速鉴别。
[1] 王仁雷, 刘友良, 华春. 植物叶黄素循环的组成、功能和调节[J]. 亚热带植物学报, 2000, 29(4):59-66.
[2] ISLAM S. Sweetpotao (Ipomoea batatasL.) leaf:Its potential effect on human health and nutrition[J]. Journal of Food Science, 2006, 71(2):13-21.
[3] del CAMPO J A, MORENO J, RODRIGUEZ H, et al. Carotenoid content of chlorophycean microalgae:factor determining lutein accumulation inMuriellopsissp. (Chlorophyta)[J]. Journal of Biotechnology,2000, 76:51-59.
[4] 李大婧, 刘春泉. 万寿菊叶黄素的提取及分析方法的研究进展[J]. 食品科学, 2005, 26(9):582-585.
[5] 谌素华, 王维民, 蔡清. 绿藻石莼叶绿素提取工艺的研究[J]. 食品科技, 2008(2):172-175.
[6] 王琦, 许洪高, 高彦祥. 叶黄素分析方法研究进展[J]. 中国食品添加剂, 2007(6):100-104.
[7] 王克勤, 罗军武, 陈静萍, 等. 芹菜提取物中芹菜素HPLC和HPLC定量分析研究[J]. 食品科学, 2008, 29(4):291-295.
[8] 刘宏程, 万至飞, 黎其万, 等. 基质量固相分散-HPLC测定松花蛋中的苏丹红[J]. 食品科学, 2008, 29(3):400-402.
[9] 赵志红, 张逢秋, 朱慧. 反相高相液相色谱法测定食品中的叶黄素[J]. 食品科技, 2009, 34(1):261-263.
[10] 石晋, 栾雨时, 王静云, 等. HPLC法测定甘薯叶片中的叶黄素[J]. 植物研究, 2008, 28(6):767-769.
[11] 陈军辉, 李文龙, 王小如, 等. 高效液相色谱-电喷雾飞行时间质谱分析娑罗子中皂苷成分[J]. 分析化学, 2008, 36(3):285-291.
[12] 李文龙, 陈军辉, 王小如, 等. 加速溶剂萃取-高效液相色谱-电喷雾飞行时间质谱联用分析莲子心中生物碱[J]. 分析化学, 2008, 36(1):79-82.
[13] LAKSHMINARAYANA R, ARUNA G, SANGEETHA R K, et al.Possible degradation of luteinin vitroandin vivo:isolation and structural elucidation of lutein metabolites by HPLC and LC-MS[J].Free Radical Biology and Medicine, 2008, 45:982-993.
[14] 称志行, 王建平, 黄创兴. 叶黄素提取和稳定性研究[J]. 食品科学,2005, 26(9):264-287.
[15] 杜桂彩, 郭群群, 滕大卫, 等. 高纯度叶黄素的制备及其稳定性研究[J]. 精细化工, 2004, 21(6):447-449.
Determination of Lutein inEnteromorpha proliferaby Reversed-phase High Performance Liquid Chromatography-Diode Array Detector-Electrospray Ionization Mass Spectrometry
CHENG Hong-yan1,CHEN Jun-hui1,*,ZHAO Heng-qiang1,SHI Qian1,WANG Xiao-ru1,2,ZANG Jia-ye1
(1. Research Center for Marine Ecology, The First Institute of Oceanography, State Oceanic Administration People’ s Republic of China,Qingdao 266061, China;2. College of Chemistry and Chemical Engineering, Xiamen University, Xiamen 361005, China)
TS207.3
A
1002-6630(2010)18-0206-06
2009-12-09
国家自然科学基金项目(20905017);科技部海洋公益性行业科研专项(200705011;200805039);国家海洋局第一海洋研究所基本科研业务专项(GY-022008T32;2010G25);国家海洋局青年基金资助项目(2010140)
程红艳(1983—),女,硕士研究生,主要从事海洋天然产物研究。E-mail:chenghongyan710@163.com
*通信作者:陈军辉(1978—),男,助理研究员,博士,主要从事海洋天然产物研究。E-mail:jhchen@fio.org.cn
