梅花鹿鹿筋胶原蛋白提取工艺条件优化
2010-10-19徐云凤李芸彤赵大庆
张 鹤,赵 雨*,徐云凤,李芸彤,赵大庆
(长春中医药大学中医药与生物工程研发中心,吉林 长春 130117)
梅花鹿鹿筋胶原蛋白提取工艺条件优化
张 鹤,赵 雨*,徐云凤,李芸彤,赵大庆
(长春中医药大学中医药与生物工程研发中心,吉林 长春 130117)
为应用胃蛋白酶酶解法从鹿筋中提取制备胶原蛋白。采用单因素试验和正交试验筛选出鹿筋胶原蛋白提取的最佳条件为醋酸体积分数5.5%、料液比1:7(mL/g)、浸提时间14h,胃蛋白酶与底物比1:1000(g/g)、酶解时间24h。验证实验结果表明,采用本方法提取的鹿筋胶原蛋白收率为74.56%,蛋白含量为65.54%。本实验优选所得梅花鹿鹿筋胶原蛋白提取工艺,方法简便,提取率高。
鹿筋;胶原蛋白;胃蛋白酶;高效凝胶色谱
Abstract:Pepsin hydrolysis was used to extract and prepare collagen from deer tendons. The optimal extraction conditions were explored by single factor experiments and orthogonal experiments to be acetic acid concentration of 5.5%, material-to-liquid ratio of 1:9, extraction time of 10 h, pepsin-substrate ratio of 1:1000, and hydrolysis time of 24 h. The yield of deer tendon collagen was 74.56% and protein content was 65.54%. The optimized extraction method for deer tendon collagen was characteristic of simple operation and high extraction rate.
Key words:deer tendon;collagen;pepsin;HPGFC
鹿筋是鹿科动物梅花鹿(Cervus nipponTemminck)的四肢干燥筋,始载于《唐本草》[1],用于治疗肾虚手足无力、风湿关节痛、劳损、转筋等症。胶原(collagen)是细胞外基质的一种结构蛋白质,占人体内蛋白质总量的25%~30%,相当于人体质量的6%,是构成皮肤、韧带、软骨、肌腱等结缔组织或器官的主要成分,起着支撑器官、保护机体的功能。胶原具有完整的三螺旋结构,相对分子质量大约为30万,不溶于水;胶原蛋白是胶原的水解产物,具有较小的相对分子质量,可溶于冷水,并且易降解,易被人体消化吸收[2]。近年来胶原蛋白不仅在食品、化妆品、医药等领域应用广泛[3],现有研究表明其具有降血压、抗衰老、增加骨密度、降低甘油三酯和胆固醇的功能,并且可以补充体内某些必需的微量元素等多种生理活性[4-6]。目前,关于胶原蛋白提取工艺的研究报道很多[7-9],本实验主要研究酶法提取鹿筋中胶原蛋白,为揭示鹿筋的临床功效以及开发功能产品提供一定参考。
1 材料与方法
1.1 材料与试剂
梅花鹿鹿筋 吉林省长春市双阳区鹿乡镇;胃蛋白酶(1:3000)、牛血清白蛋白 北京鼎国生物技术有限责任公司;凝胶色谱柱标准分子量试剂(相对分子质量依次为6500、13700、29000、43000、75000) GE Healthcare公司;Folin酚试剂 上海荔达生物技术有限公司;磷酸氢二钠、磷酸二氢钠、硫酸钠 美国Fluka公司;其他试剂均为国产分析纯。
1.2 仪器与设备
1100型高效液相色谱仪 美国Aglient公司;TSKgelG2000SW(XL)凝胶色谱柱 Tosoh公司;Uvmini-1240紫外分光光度计 日本岛津仪器有限公司;PHS-25数显酸度计、PL230电子天平 梅特勒-托利多仪器有限公司;TGL-20B台式高速离心机 上海安亭科学仪器厂;LL3000冻干机 瑞典Jouna Nordic公司;DZKW恒温水浴箱 北京市永光明医疗仪器;WFO烘箱 上海爱郎仪器有限公司。
1.3 方法
1.3.1 鹿筋的处理
将新鲜鹿筋去脂肪、皮和筋膜后,切成0.5~1cm3的小块,然后用生理盐水反复清洗去除血和脂肪,再用蒸馏水冲洗干净,置-20℃冰箱中保存。
1.3.2 鹿筋胶原蛋白提取工艺
将鹿筋解冻,酸溶液浸泡好后,置于100℃沸水浸提至其完全溶解,将水解液离心(4000r/min、30min、30℃),向上清液中加入胃蛋白酶,37℃酶解,酶解得到胶原蛋白,加热使酶解液温度达到80℃以上10min,使胃蛋白酶失活。离心(4000r/min、30min、4℃)后的上清液用NaOH溶液调pH7~7.5,浓缩,0.45μm滤膜过滤,滤液冻干,所得为鹿筋胶原蛋白。
1.3.3 提取胶原蛋白的评价指标
当酸的量不足时,鹿筋在100℃沸水中不会完全溶解,结果导致胶原蛋白提取率降低;若酸的量适中时,鹿筋在100℃沸水中可以完全溶解;若酸的量过高时,则导致部分氨基酸结构破坏,如谷氨酰胺、天冬酰胺和色氨酸残基会被破坏,因此浸提液醋酸体积分数、料液比、浸提时间以鹿筋在100℃沸水中完全溶解所用时间作为评价指标;酶解条件的选择是应用高效凝胶色谱法,依据胶原水解后的相对分子质量分布确定最佳的胃蛋白酶用量及酶解时间。
1.3.4 蛋白含量测定
采用Folin-酚试剂盒测胶原蛋白含量。
1.3.5 单因素试验
1.3.5.1 不同醋酸体积分数对提取的影响
称取30g鲜鹿筋5份,加入配好的体积分数0.57%、1%、3%、5%、8%醋酸溶液500mL,4℃浸泡2d后,100℃沸水浸提,根据鹿筋在100℃沸水中完全溶解时间来确定浸提鹿筋的最佳醋酸体积分数。
1.3.5.2 不同料液比对提取的影响
称取30g鲜鹿筋5份,按料液比1:5、1:6、1:8、1:10、1:12(g/mL)加入体积分数5%的醋酸溶液,4℃浸泡2d后,100℃沸水浸提,根据鹿筋在100℃沸水中完全溶解时间来确定醋酸浸提鹿筋的最佳料液比。
1.3.5.3 浸提时间对提取影响
称取30g鲜鹿筋5份,按料液比1:8,加入体积分数5%的醋酸溶液置于4℃冰箱中,分别浸泡6、12、24、36、48h后,100℃沸水浸提,根据鹿筋在100℃沸水中完全溶解时间来确定醋酸浸提鹿筋的最佳浸提时间。
1.3.6 正交试验
根据单因素试验结果,对醋酸体积分数(A)、料液比(B)、浸提时间(C)3个因素,每个因素取3个水平,采用L9(34)正交表进行试验,对鹿筋胶原蛋白提取条件进行优化。
1.3.7 酶量、酶解时间的选择(高效凝胶色谱法)
1.3.7.1 高效凝胶色谱条件
色谱柱为TSKgelG2000SW(XL);流动相为0.1mol/L Na2HPO4、0.1mol/L NaH2PO4、0.1mol/L Na2SO4,pH6.6;流速为0.5mL/min;进样量为20μL;检测波长为230nm。
1.3.7.2 相对分子质量标准曲线
含有5种不同相对分子质量标准蛋白的溶液(相对分子质量依次为6500、13700、29000、43000、75000),按上述高效液相凝胶色谱条件进样。以相对分子质量为横坐标、保留时间为纵坐标,绘制标准曲线。回归方程为y=-0.0788x+21.36,r=0.9975。
1.3.7.3 酶量、酶解时间的试验设计
配制质量浓度为0.01g/mL胃蛋白酶溶液,用HCl溶液调pH1.90。取3mL鹿筋100℃沸水浸提液按酶与底物比为1:500、1:800、1:1000、1:1500(g/g),加入胃蛋白酶溶液,37℃酶解24h,分别在0、6、12、24h时取样100 μL,加100μL流动相溶液,混匀后,0.2μm滤膜过滤后进样。
2 结果与分析
2.1 单因素试验结果
2.1.1 醋酸体积分数的确定
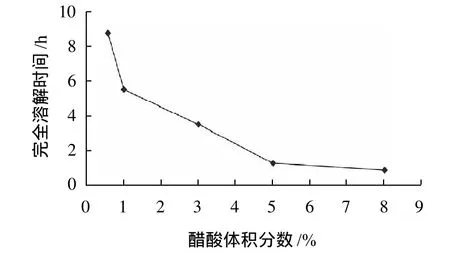
图1 不同醋酸体积分数对完全溶解时间的影响Fig.1 Effect of acetic acid concentration on deer tendon collagen extraction (reflected by required time for complete dissolution of deer tendon in 100 ℃ water, hereinafter the same)
根据图1可以看出,随着醋酸体积分数的增加鹿筋完全溶解时间减少,5%与8%完全溶解时间相差很小,因此采用醋酸体积分数为5%。
2.1.2 料液比的确定
从图2可以看出,料液比越低完全水解所用时间越短,增加醋酸会引入更多的盐,降低蛋白含量,综合考虑选取料液比为1:8。
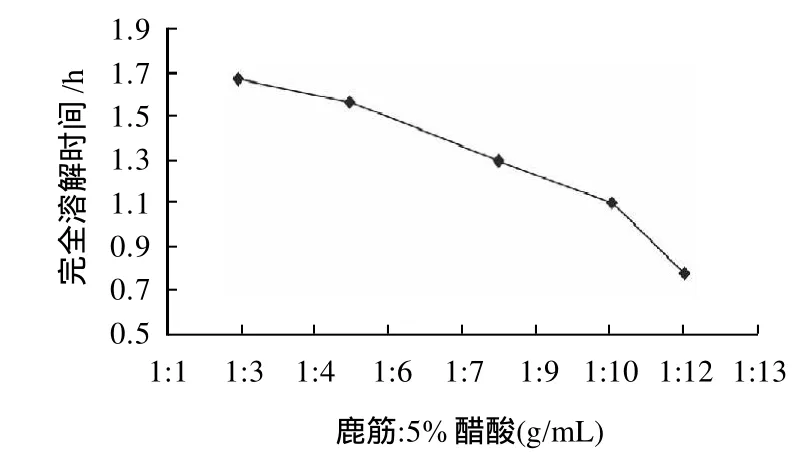
图2 不同料液比对完全溶解时间的影响Fig.2 Effect of material-to-liquid ratio on deer tendon collagen extraction
2.1.3 浸提时间的确定

图3 浸提时间对完全溶解时间的影响Fig.3 Effect of extraction time on deer tendon collagen extraction
从图3可以看出,6h水煮时间较长,而12、24、36h完全溶解时间相差很少,所以综合考虑选取浸提时间为12h。
2.2 正交试验结果
根据单因素试验结果,确定正交试验的因素和水平见表1。正交试验结果见表2,方差分析结果见表3。

表1 正交试验因素水平表Table 1 Factors and levels in the orthogonal array design
表2结果表明,影响鹿筋中胶原蛋白提取的各因素主次顺序是A>C>B;表3结果表明,A和C因素对鹿筋胶原蛋白提取影响有显著性(P<0.05),而B因素影响较小(P>0.05),对于料液比可根据实际情况加以选择,本实验选择的料液比为1:7。因此,优选出最佳的提取工艺为A3C3B1,即醋酸体积分数为5.5%、浸提时间为14h、料液比为1:7。

表2 正交试验设计及结果Table 2 Orthogonal array design layout and experimental results
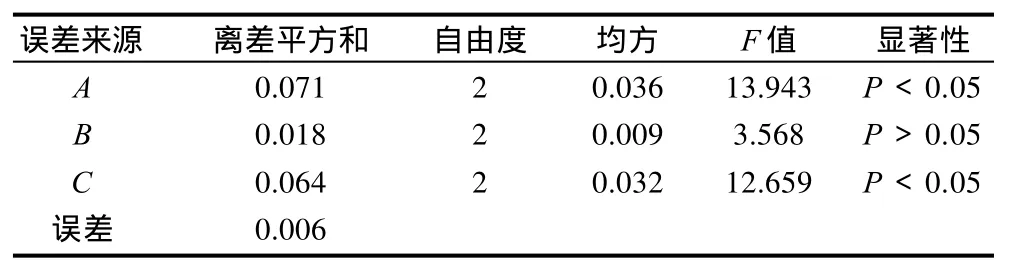
表3 方差分析结果Table 3 Results of variance analysis for deer tendon collagen extraction with various extraction conditions
2.3 酶量的确定

图4 不同酶量水解鹿筋胶原的高效凝胶色谱图Fig.4 HPGFC chromatograms of hydrolyzed collagen at different pepsin-to-substrate ratios
从图4可以看出,未酶解时样品洗脱峰的保留时间为20.50min;酶与底物比1:1500、24h样品峰的保留时间在22.71min;酶与底物比1:1000、24h样品峰的保留时间在24.70min和29.56min;酶与底物比1:800、24h样品峰的保留时间在24.03min和30.23min;酶与底物比1:500、24h样品峰的保留时间在24.20min和30.39min。从此数据可以看出,鹿筋胶原随着酶量的增加,酶解后胶原蛋白的相对分子质量逐渐降低,而1:1000、1:800和1:500样品水解程度相差较小。综合考虑选用酶与底物比1:1000。
2.4 酶解时间的确定

图5 不同酶解时间水解鹿筋胶原的高效凝胶色谱图(酶与底物比1:1000样品)Fig.5 HPGFC chromatograms of hydrolyzed collagen at different hydrolysis time points (1:1000 pepsin-to-substrate ratio)
从图5可以得出,未酶解时样品洗脱峰的保留时间为20.50min,由1.3.6.2节相对分子质量标准曲线方程可得,此时样品的相对分子质量主要为10910。随着酶解时间的延长,样品的水解程度不断增加,酶解24h样品峰的保留时间为24.70min和29.56min,此时样品的相对分子质量主要在6500以下,说明水解较好,大分子的胶原已完全水解成小分子的胶原蛋白。综合考虑最佳的酶解时间为24h。
2.5 验证实验
综上所得的最佳工艺为醋酸体积分数5.5%、料液比1:7(mL/g)、浸提14h,胃蛋白酶与底物比为1:1000(g/g)、酶解24h。称取已处理好的鲜鹿筋30g,按最佳提取工艺加入5.5%醋酸210mL浸提14h,将浸泡后的鹿筋于100℃沸水浸提至其完全水解,将水解液离心(4000r/min、30min、30℃),向上清液中加入胃蛋白酶0.03g,37℃酶解24h,酶解得到胶原蛋白,加热使酶解液温度达到80℃以上10min,使胃蛋白酶失活。离心(4000r/min、30min、4℃)后的上清液用NaOH溶液调pH7~7.5,浓缩,0.45μm滤膜过滤,滤液冻干,称量,计算胶原蛋白含量,结果见表4。
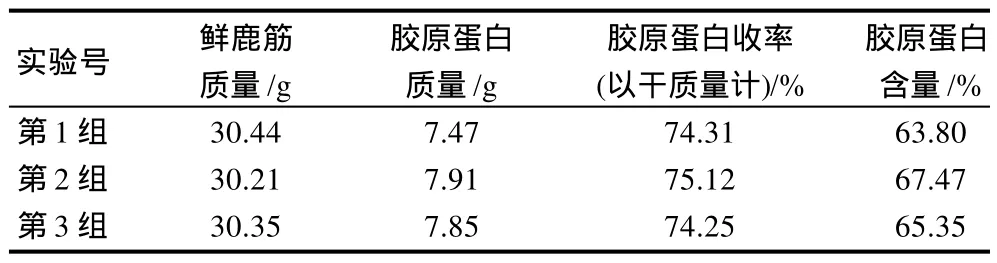
表4 验证实验结果Table 4 Verification of optimized extraction conditions of deer tendon collagen
从表4可以看出,3组样品平均胶原蛋白收率为74.56%,平均蛋白含量为65.54%。
3 讨 论
由于胶原是不溶于水的高分子质量物质,中性条件下将它直接通过鹿筋组织中提取出来较为困难,而胶原可在酸性或碱性条件下发生酸膨胀或碱膨胀,破坏胶原肽链间的氢键和离子键乃至共价键,使胶原结构松散,易溶于热水,并易被蛋白酶水解。在此过程中,pH值对其影响很大[10-11]。一般情况下,碱水解得到的大多数是D-氨基酸或外消旋氨基酸,得到的蛋白已失去了营养价值[12];酸水解时若酸的量过高时,则导致部分氨基酸结构破坏,如谷氨酰胺、天冬酰胺和色氨酸残基会被破坏。因此对于提取鹿筋中胶原蛋白选择适宜的浸提液条件很重要。醋酸为弱酸,低浓度的醋酸对氨基酸结构影响较小,且有报道表明采用醋酸提取胶原蛋白,提取率较高[13]。
在人体中,胃蛋白酶是一种消化性蛋白酶,由胃中的胃黏膜主细胞分泌,酶切蛋白质中芳香族氨基酸或酸性氨基酸所形成的肽键,可将食物中的蛋白质分解成易被人体吸收的小肽段。本实验采用胃蛋白酶水解鹿筋胶原,模拟胃液环境,使水解得到的胶原蛋白更易被人体消化吸收[14-15]。
高效凝胶色谱柱是根据分子筛原理,测定蛋白分子质量分布。本实验酶解鹿筋胶原时胃蛋白酶的酶量和酶解时间都是应用高效凝胶色谱法,得到水解样品洗脱峰的保留时间,依据相对分子质量标准曲线,确定最佳的胃蛋白酶用量及酶解时间。此方法确定样品酶解条件方法简单、准确度高。
本实验对鹿筋胶原蛋白的提取工艺进行了研究,得到最佳工艺是醋酸体积分数为5.5%、料液比为1:7(g/mL)、浸提14h、胃蛋白酶与底物比是1:1000(g/g)、酶解时间为24h,酶解得到鹿筋胶原蛋白收率为74.56%,蛋白含量为65.54%。在酶解后的浓缩,调中性过程中有少量的盐和灰分等成分引入,对产品的纯度产生了一定的影响。因此在实际生产中还应对产物进行进一步的纯化处理。
[1] 苏敬. 唐本草[M]. 上海:上海卫生出版社, 1957:210.
[2] 蒋挺大, 张春萍. 胶原蛋白[M]. 北京:化学工业出版社, 2001:29.
[3] 薛艳丽. 胶原蛋白与美容[J]. 中国实用医药, 2006, 1(9):84.
[4] 陈静涛, 徐政, 顾其胜. 胶原蛋白研发的最新进展[J]. 上海生物医学工程, 2004, 25(2):52-55.
[5] 任俊莉, 付丽红, 邱化玉. 胶原蛋白应用及其发展前景[J]. 中国皮革,2004, 33(1):36-38.
[6] 李彦春, 程宝箴, 靳立强. 胶原蛋白的应用[J]. 皮革化工, 2002, 19(3):11-14.
[7] 王信苏, 汪之和. 草鱼鱼鳞胶原蛋白的提取[J]. 现代食品科技, 2006(4):148-150.
[8] 赵胜年. 酶解鲜猪皮提取水解胶原蛋白的研究[J]. 食品工业科技,1998(5):16-17.
[9] 王建辉, 李琦, 刘在群, 等. 鹿皮胶原的提取与性质[J]. 吉林大学自然科学学报, 2001(1):106-108.
[10] 位绍红, 许永安. 明胶提取工艺及其应用的研究进展[J]. 福建水产,2007(2):67-71.
[11] 吕坪, 杜玉枝, 魏立新. 酶法制备明胶的研究进展[J]. 明胶科学与技术, 2006, 26(4):170-175.
[12] 张应年, 李生英, 朱彦荣. 人体必需氨基酸消旋化作用分析及应用[J]. 中国食品与营养, 2005(11):26-28.
[13] 罗发兴, 薛新顺, 罗志刚. 酸溶液对猪皮中胶原蛋白溶出率的影响[J]. 中国酿造, 2006(9):9-11.
[14] 王川, 李燕, 马志英, 等. 几种酶法从猪皮中提取胶原蛋白的对比研究[J]. 食品科学, 2007, 28(1):201-204.
[15] 菅景颖, 张志胜. 酶解胶原蛋白研究进展[J]. 肉类研究, 2005(5):26-28.
Optimization of Extraction Conditions for Deer Tendon Collagen
ZHANG He,ZHAO Yu*,XU Yun-feng,LI Yun-tong,ZHAO Da-qing
(Chinese Medicine and Bio-engineering Research Center, Changchun University of Chinese Medicine, Changchun 130117, China)
R284.2
A
1002-6630(2010)18-0014-04
2009-12-23
“十一五”国家科技支撑计划项目(2007BAI38B06);吉林省科技支撑计划项目(20096042)
张鹤(1985—),女,硕士研究生,主要从事中药有效成分研究。E-mail:zhang_he_19850123@163.com
*通信作者:赵雨(1972—),男,教授,博士,主要从事蛋白质结构与功能研究。E-mail:cnzhaoyu@yahoo.com.cn
