不同佐剂对含S+PreS1融合抗原的乙型肝炎病毒颗粒疫苗免疫原性的影响
2010-10-16陈红邓瑶谭文杰王文殷霄管洁王文玲阮力
陈红,邓瑶,谭文杰,王文,殷霄,管洁,王文玲,阮力
中国疾病预防控制中心病毒病预防控制所 病毒病应急技术中心,北京 100052
不同佐剂对含S+PreS1融合抗原的乙型肝炎病毒颗粒疫苗免疫原性的影响
陈红*,邓瑶*,谭文杰,王文,殷霄,管洁,王文玲,阮力
中国疾病预防控制中心病毒病预防控制所 病毒病应急技术中心,北京 100052
本研究在前期工作基础上,用CHO细胞表达的含PreS1+S融合抗原的新型基因工程HBV颗粒疫苗(HBSS1)与Al(OH)3、CpG及CpG+Al(OH)3等佐剂配伍,在Balb/C小鼠模型上研究不同佐剂对HBV颗粒疫苗肌肉注射后免疫应答的影响,主要包括抗体滴度、抗体亚型分类及特异性细胞免疫(γ-IFN ELISpot检测)。结果表明:CpG佐剂结合HBSS1颗粒疫苗可快速诱导(单针免疫)高水平的抗PreS1及S抗体,IgG2a/IgG1比率>1,同时可诱导较高抗原特异的细胞免疫应答;Al(OH)3+CpG双佐剂组一次免疫后可诱导产生最高的抗S抗体滴度(1:105),其产生的抗体亚类包括IgG1、IgG2a与IgG2b;在S抗原N端(13~49 aa)存在优势CTL表位。结论:CpG佐剂结合HBSS1颗粒疫苗应是发展新型治疗性乙肝疫苗的较佳选项。
乙型肝炎病毒,病毒颗粒,疫苗,CpG佐剂
Abstract:We previous reported the development of novel hepatitis B virus(HBV)vaccine containing the surface antigen(S)plus PreS1 fusion derived from Chinese hamster ovary(CHO)cells system.In this study, we analyzed the impact of different adjuvants on immunogenicity of the HBV particle vaccine in Balb/C mice, including alum alone, CpG oligodeoxynucleotides(CpG-ODN)alone and CpG-ODN in combination with alum adjuvant.We first detected the antigen specific humoral response in mice, including total IgG antibody and IgG subtyping.Then, we characterized the specific cell-mediated immune(CMI)response by detection of γ-interferon secreting splenocytes after stimulating with S or PreS1 peptide pool.Our results showed that: CpG-ODN adjuvanted vaccine could rapidly induce higher level of anti-PreS1 and anti-S antibodies, and a higher ratio of IgG2a/IgG1 antibody than that of alum adjuvanted vaccine.At the same time, CpG-ODN adjuvanted vaccine induced robust antigen-specific cellular immune responses in mice, which was superior to that of alum adjuvanted vaccine and CpG-ODN in combination with alum adjuvantedvaccine; however, the vaccine candidate with CpG-ODN in combination with alum adjuvant induced highest anti-S antibody and mixed IgG subclasses in mice after twice immunization.There exists dominant HBV CMI epitopes in the N-terminal of S antigen.These results provided important evidence that CpG-ODN adjuvanted HBSS1 particles vaccine may serve as a novel candidate in the development of new preventive and therapeutic agents against hepatitis B infection.
Keywords:hepatitis B virus(HBV), viral particles, vaccine, CpG-ODN
乙型肝炎病毒(HBV)不仅可引起急慢性肝炎,而且与肝硬化、肝癌的发生密切相关,尽管乙肝疫苗的使用已逾20年,目前HBV仍是传播最为广泛的病原之一[1]。据 WHO 分析,全世界每年仍有 50~120万人死于HBV感染[1]。HBV疫苗在中国已纳入计划免疫,使用最为广泛的为酵母或CHO细胞表达含S全长的颗粒亚单位疫苗[2]。HBV疫苗长期使用的效果表明,该疫苗加Al(OH)3佐剂后三针免疫可有效保护人群HBV感染与传播,但仍有5%~10%的人群不能产生保护性anti-HBS抗体,且近年来,S变异流行株呈增长趋势[2]。因此,为进一步提高现有乙肝疫苗的保护效果,许多学者从新型抗原设计及新的佐剂配伍方面进行了有益的探索[2-10]。本研究组前期研发了含PreS1+S融合抗原的HBV颗粒疫苗[3],对其纯化工艺、生物学性状及安全性等进行了系统研究[3];同时采用Al(OH)3、CpG及CpG+Al(OH)3等佐剂配伍,在小鼠模型上探讨了不同佐剂对现有市售乙肝疫苗(CHO表达S抗原)免疫效果的影响[4]。
本研究在前期工作基础上[3-4],着重研究不同佐剂配伍对CHO表达的含PreS1+S融合抗原的新型基因工程HBV颗粒疫苗免疫效果的影响,主要包括抗体滴度、抗体亚型分类及细胞免疫。
1 材料和方法
1.1 疫苗与佐剂
CHO表达的含 S+PreS1融合抗原的颗粒疫苗(HBSS1)的制备及生物学性状参见文献[3]。疫苗纯度>95%,抗原含量为 100 μg/mL。Al(OH)3佐剂为北京华尔盾科技服务公司提供,浓度为2 mg/mL,CpG-ODN 1826[4-6]由NEB公司合成,全链硫代修饰纯度>95%,由上述抗原与佐剂分别配伍成3种免疫制剂,即HBSS1+Al(OH)3、HBSS1+CpG、HBSS1+Al(OH)3+CpG,其中每剂中抗原含量皆为 2 μg,Al(OH)3含量为1 mg/mL,CpG含量为10 μg。
1.2 动物与试剂
Balb/C小鼠,雌性,6~8周龄,购自中国医学科学院实验动物繁殖中心,HPR标记的羊抗小鼠IgG1,羊抗小鼠 IgG2a与羊抗小鼠 IgG2b均购自Sigma公司,HBV S抗体与PreS1抗体检测ELISA试剂盒购自上海科华公司。用于HBV ELISpot检测用合成肽由NEB公司合成,序列见表1,纯度皆大于90%;γ-IFN ELISpot检测用试剂盒购自BD公司。
1.3 动物免疫
按3种免疫制剂分成4个组,每组6只,即生理盐水对照组(A)、HBSS1+Al(OH)3组(B)、HBSS1+CpG组(C)与 HBSS1+Al(OH)3+CpG组(D),免疫及检测时间参见图1,免疫途径采用肌肉注射[4],每只抗原注射量均为 2 μg/200 μL。
图1 免疫及检测时间Fig.1 Schedule for immunalization and detection in mice.
1.4 体液免疫应答检测
眼眶采血检测抗体,参照试剂盒说明进行,其中总抗体检测中酶标二抗改为HRP标记的羊抗小鼠IgG+M+A多价抗体。抗体亚型分析中则采用相应的酶标二抗,采用S抗体检测试剂盒,每组血清混合后皆从1:10稀释到1:106。
1.5 IFN-γ ELISpot检测
将合成肽分别分成 S1(PreS1)组,S-1,S-2组(表1),分别与小鼠脾细胞(5×105)孵育,具体操作按试剂盒说明书进行[5-6],反应终止后在ELISpot读数仪上计数分析,每组小鼠以106脾细胞中Spots(减去无关肽孔)计数求均值。
2 结果
2.1 不同疫苗制剂所引起的体液免疫应答
单针免疫后,颗粒疫苗+铝佐剂(B)中有 2只(2/6)抗 PreS1与抗S抗体阳转,而颗粒疫苗+CpG组(C)与颗粒疫苗+铝佐剂+CpG 组(D)抗 PreS1皆阳转(6/6),其中C组(6/6)抗S抗体全阳转,但D组抗S抗体仅有2只(2/6)阳转(表2)。
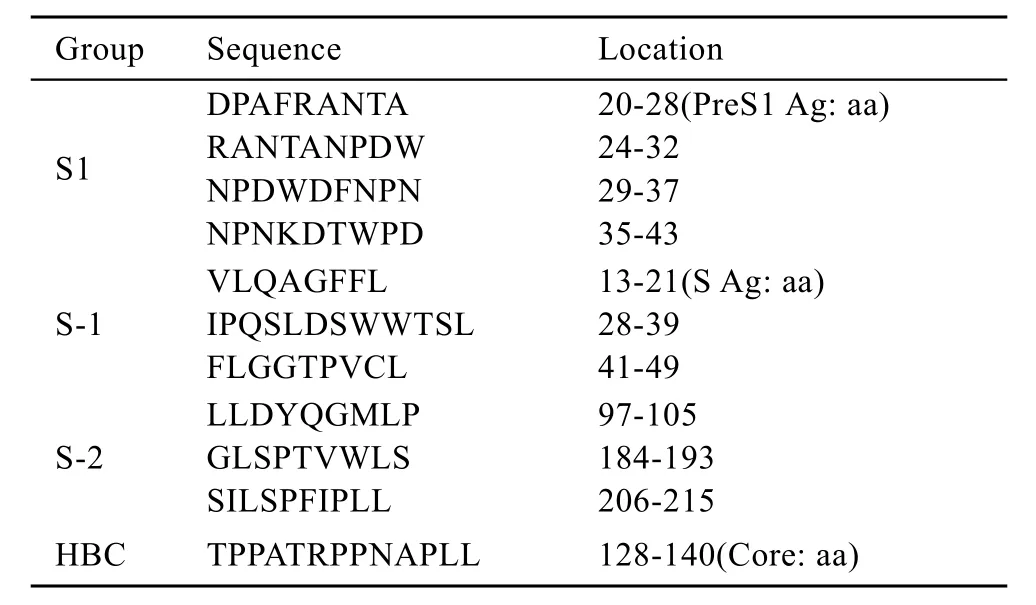
表1 用于ELISpot检测的合成肽序列Table 1 Peptide sequences used for IFN-γ ELISpot assay
二针免疫后,B、C、D组抗S1与抗S抗体皆100%阳转,其抗体滴度见表2,其中抗PreS1抗体滴度在3组间无明显差异,皆为1:104,而抗S抗体滴度则存在差异,以HBSS1+CpG+Al(OH)3组最高,可达到1:105。
2.2 不同疫苗制剂所引起的细胞免疫应答及抗体亚型
二针免疫后,不同疫苗制剂所诱导的 γ-IFN ELISpot计数如图2所示,以HBSS1+CpG组(C组)诱导的细胞免疫应答最强,Al(OH)3佐剂的加入(D组)减少了免疫小鼠脾细胞中特异的IFN-γ的分泌,降低了细胞免疫应答水平。此外,如图2所示,S-1肽库刺激可产生较高的 γ-IFN分泌,明显高于 S-2肽库刺激与 S1(PreS1)肽库刺激所产生的 γ-IFN分泌,表明在S抗原N端(13~49 aa)存在优势的CTL表位,同时我们也注意到含Al(OH)3或CpG佐剂的HBSS1颗粒疫苗也能产生较弱的针对PreS1的细胞免疫应答。
不同佐剂对 HBSS1抗原引起的抗体亚型应答见图3,单纯使用Al(OH)3佐剂时,以IgG1类抗体占优势,为105,IgG2b抗体为102,无IgG2a抗体存在;单纯使用CpG佐剂时,则IgG1与IgG2a抗体皆显著存在,以IgG2a抗体为主(IgG2a/IgG1>1),IgG2b抗体检出较低;若CpG与Al(OH)3佐剂共同使用,则IgG1抗体变化与单纯使用CpG佐剂相近,IgG2a抗体滴度低于单纯使用CpG佐剂组,但IgG2b抗体增高。

表2 单针及二针免疫后的总抗体IgG阳转率及滴度Table 2 Total antibody positive rate and titer of different groups after single or twice immunization
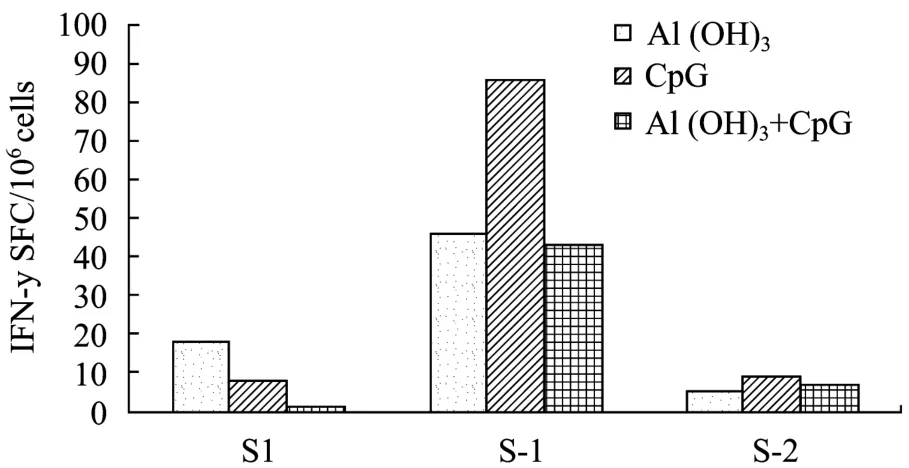
图2 含不同佐剂的HBSS1颗粒疫苗所诱导的细胞免疫应答Fig.2 Characterization of cellular immune responses induced by HBSS1 particle vaccines with different adjuvant by IFN-γ ELISpot assay.
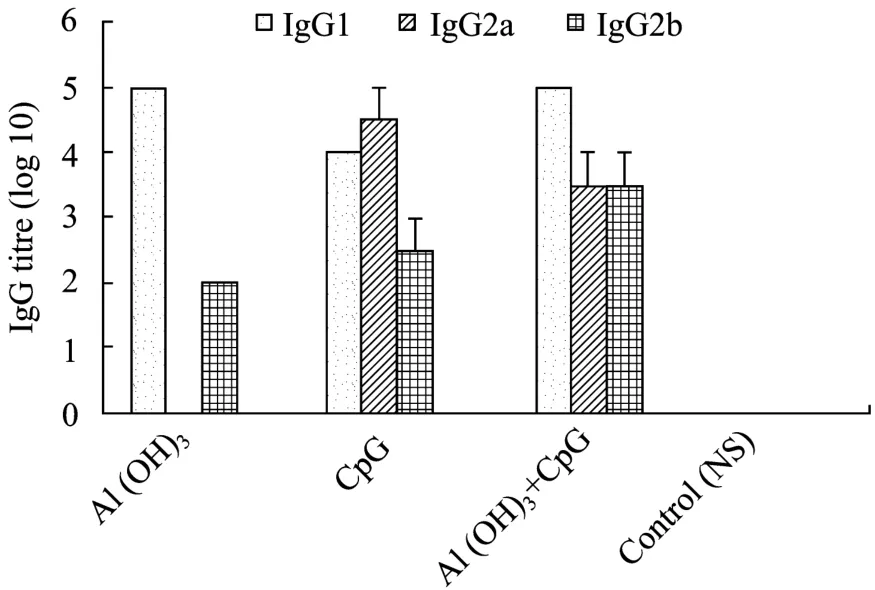
图3 含不同佐剂的HBSS1颗粒疫苗所诱导的IgG 抗体亚型Fig.3 The subtype class of IgG antibody induced by HBSS1 particle vaccines with different adjuvant by ELISA.
3 讨论
接种乙肝疫苗是目前预防乙肝的有效措施[1,2],从 2002年起我国将乙肝疫苗纳入计划免疫。乙肝疫苗的大量使用已经明显降低了我国儿童乙肝病毒的感染率,但是现有疫苗仍存在两个比较突出的问题[2]:1)大约5%~10%的接种者完成全程免疫后对疫苗无反应或低反应,不能产生有效的免疫保护。2)部分接种者虽然能够产生高水平的抗体,但仍然会感染乙肝病毒。对这些个体中的乙肝病毒基因序列分析发现,HBsAg 主要保护性抗原决定簇“a”决定簇发生变异可能为其主要原因。而且中国疾病预防控制中心的大规模流行病学调查结果也表明,在我国乙肝疫苗纳入计划免疫后的强大免疫选择压力之下,这种免疫逃逸变异株的检出率有增加的趋势(内部资料)。因此,进一步优化疫苗组分,研制免疫效果更好的新一代乙肝疫苗制剂十分必要。
现有市售基因工程乙肝疫苗除法国巴斯德公司的基因工程乙肝疫苗含有PreS2和S以外[7],其余的只含S,但含PreS2的基因工程乙肝疫苗并未显示出更强的免疫效果[7]。随着对乙肝病毒表面抗原的结构与功能的深入研究发现,HBV的前 S1区抗原决定簇比S区域更为丰富,相应的特异性抗体能中和乙肝病毒,保护机体免受病毒攻击[8]。HBV与肝细胞受体结合的位点位于PreS1(21~47)[8],针对这一区域的抗体能阻断HBV与肝细胞的结合,从而阻止病毒进入肝细胞。同时 PreS1抗体出现早,可能对阻断 HBV母婴传播十分有利[3]。本实验室前期应用Adr亚型乙肝表面抗原 S+PreS1融合基因研制了新型HBV颗粒疫苗[3],对其生物学活性进行了全面检定。动物免疫结果表明该疫苗既产生S抗体,又能产生PreS1抗体,PreS1抗体的产生早于S抗体,这对母婴阻断更为有益[3]。含有PreS1的乙肝疫苗能使对S不反应的小鼠重新对S产生抗体反应,这对于现有乙肝疫苗不应答的人群(约 5%~10%)来说很有意义。这反映出HBSS1Ag免疫效果要优于单纯含乙肝表面S抗原的疫苗。面对我国大约1亿人口为乙肝表面抗原携带者,发展治疗性乙肝疫苗,将疫苗的使用从预防乙肝扩展到治疗乙肝病毒携带者,也应是基因工程乙肝疫苗研究的另一个重要发展趋势[2],在这方面含PreS1的乙肝疫苗和增强细胞免疫佐剂(CpG ODN)的结合使用将是这类疫苗研究开发的重要途径。
本实验结果表明:含单纯 Al(OH)3佐剂的HBSS1颗粒疫苗二针免疫后即可诱导较强的S抗体与S1抗体,其抗体亚类主要为IgG1型,即Th2型反应,而含单纯CpG佐剂的HBSS1颗粒疫苗则可加速S抗体的阳转(表2),单次免疫后其抗S1抗体的阳转率亦高于含单纯Al(OH)3佐剂疫苗组,同时,抗体亚型除 IgG1外,还产生了 IgG2a且IgG2a/IgG1>1,表明以 Th1应答为主,Th1型应答有利于机体对胞内病原体的清除避免持续性感染的发生,平衡的 Th1/Th2应答有利于克服机体对抗原的不应答性。γ-IFN ELISpot结果亦表明:含单纯Al(OH)3佐剂疫苗组虽可诱导特异性细胞免疫应答,但含单纯CpG组佐剂组所诱导的细胞免疫应答明显高于含单纯 Al(OH)3佐剂疫苗组,亦明显高于含CpG+Al(OH)3混合佐剂疫苗组,表明CpG佐剂可增强 HBSS1颗粒疫苗的细胞免疫应答水平,含Al(OH)3+CpG混合佐剂的HBSS1颗粒疫苗二针肌肉注射后可产生最强的抗S抗体应答,但其细胞免疫应答强度较含CpG佐剂疫苗低,IgG2a类抗体高于含Al(OH)3佐剂疫苗,低于含CpG佐剂疫苗组,同时产生了较高 IgG2b类抗体,是较平衡的 Th1/Th2类应答。
γ-IFN ELISpot实验表明,3类佐剂结合HBSS1颗粒亚单位疫苗肌肉注射皆可诱导小鼠产生明显的细胞免疫应答,且在S抗原N端(13~49 aa)存在优势CTL表位。
通过比较含3类佐剂的HBSS1颗粒疫苗的免疫应答特点,可以得知CpG佐剂结合HBSS1颗粒疫苗可快速产生高水平的抗 S1及 S抗体及较高的IgG2a/IgG1比率,同时可诱导较高抗原特异的细胞免疫应答,该类疫苗免疫应答特点明显优于含Al(OH)3佐剂疫苗组。而含混合佐剂疫苗组二针免疫后可产生最强的体液免疫应答及混合的IgG亚类。
REFERENCES
[1]Lavanchy D.Worldwide epidemiology of HBV infection,disease burden, and vaccine prevention.J Clin Virol, 2005,34(S1): S1−3.
[2]TanWJ, Ruan L.Progress on combination strategies of therapeutic vaccine approaches for the treatment of chronic HBV infection.Chin J Virol, 2006, 22(5):407−411.谭文杰, 阮力.HBV病毒慢性感染疫苗治疗的组合策略及研究进展.病毒学报, 2006, 22(5): 407−411.
[3]Tian SF, Zong F, Chen H, et al.The physicochemical and biological properties of SS1 fusion antigen of HBsAg secreted by mammalian cells.Chin J Virol, 2002, 18(4):312−316.田淑芳, 宗芳, 陈红, 等.哺乳动物细胞分泌的乙型肝炎病毒表面S+PreS1融合抗原的理化和生物学性状.病毒学报, 2002, 18(4): 312−316.
[4]Wang SQ, Xu HL, Ruan L, et al.Effects of CpG on the immune response to recombinant hepatitis B virus vaccine.Chin J Virol, 2002, 18(2): 108−112.王四清, 许洪林, 阮力, 等.CpG 对乙型肝炎基因重组(CHO细胞)疫苗免疫效果的影响.病毒学报, 2002,18(2): 108−112.
[5]Davis HL, Weeratna R, Waldschmidt TJ, et al.CpG DNA is a potent enhancer of specific immunity in mice immunized with recombinant hepatitis B surface antigen.J Immunol, 1998, 160(2): 870−876.
[6]Xu HL, Wang SF, Guo F, et al.CpG-ODN is a potential candidate adjuvant for human vaccines.Chin J Med, 2002,82(8): 553−556.许洪林, 王世峰, 郭斐, 等.CpG 寡脱氧核苷酸作为人用疫苗佐剂的初步研究.中华医学杂志, 2002, 82(8):553−556.
[7]Kuroda S, Fujisawa Y, Iino S, et al.Induction of protection lever of anti-preS antibodies in humans immunized with a novel hepatitis B vaccine consisting of M(preS2+S)protein particles(a third generation vaccine).Vaccine, 1991, 9(3): 163−169.
[8]Dash S, Rao KV, Panda SK.Receptor for pre-S1(21-47)component of hepatitis B virus on the liver cell: role in virus cell interaction.J Med Virol, 1992, 37(2): 116−121.
[9]Halperin SA, Van Nest G, Smith B, et al.A phase I study of the safety and immunogenicity of recombinant hepatitis B surface antigen co-administered with an immunostimulatory phosphorothioate oligonucleotide adjuvant.Vaccine, 2003,21(19/20): 2461−2467.
[10]Zhang W, Du X, Zhao G, et al.Levamisole is a potential facilitator for the activation of Th1 responses of the subunit HBV vaccination.Vaccine, 2009, 27(36):4938−4946.
Impact of different adjuvants on immunogenicity of the HBV particle vaccine containing the S + PreS1 fusion antigen in Balb/C mice
Hong Chen*, Yao Deng*, Wenjie Tan, Wen Wang, Xiao Yin, Jie Guan, Wenling Wang, and Li Ruan
Institute for Viral Disease Control and Prevention, Chinese Center for Disease Control and Prevention, Beijing 100052, China
Received:August 16, 2009;Accepted:October 9, 2009
Supported by:National Major Special Program of New Drug Research and Development(No.2009ZX09102-237).
Corresponding author:Wenjie Tan.Tel: +86-10-63552140; Fax: +86-10-63552140; E-mail: tanwj28@yahoo.com Li Ruan.Tel: +86-10-63552140; Fax: +86-10-63552140; E-mail: ruanl@public3.bta.net.cn*These authors contributed equally to this study.重大新药创制科技重大专项(No.2009ZX09102-237)资助。
