N-烷基-N,N-二(2-羟乙基)-N-甲基溴化铵与牛血清白蛋白的相互作用
2010-10-14胡晓环游金宗雷群芳
邵 爽 胡晓环 游金宗 雷群芳,*
(1浙江外国语学院化学系,杭州 310012; 2浙江大学化学系,杭州 310027)
N-烷基-N,N-二(2-羟乙基)-N-甲基溴化铵与牛血清白蛋白的相互作用
邵 爽1,*胡晓环2游金宗1雷群芳2,*
(1浙江外国语学院化学系,杭州 310012;2浙江大学化学系,杭州 310027)
用荧光光谱法在298 K研究了Tris-HCl缓冲溶液(pH=7.1)中系列N-烷基-N,N-二(2-羟乙基)-N-甲基溴化铵(烷基链长为C12到C16)与牛血清白蛋白(BSA)的结合作用,考察了表面活性剂结构、BSA浓度对结合作用的影响,分别用Stern-Volmer方程、虚拟结合常数模型探讨了表面活性剂在浓度较低区域与BSA的作用机制.结果表明:三种季铵盐表面活性剂均对BSA内源荧光有猝灭作用,并导致其最大发射波长蓝移;表面活性剂的烷基链越长,Stern-Volmer猝灭常数和虚拟结合常数越大,表面活性剂与BSA的结合作用也越强.
季铵盐表面活性剂; 牛血清白蛋白; 荧光猝灭; 疏水作用; 虚拟结合常数
Abstract:Interactions between a series of N-alkyl-N,N-di(2-hydroxyethyl)-N-methylammonium bromides with alkyl chain from dodecyl to cetyl and bovine serum albumin(BSA)in Tris-HCl buffer solution(pH=7.1)were studied by fluorescence spectroscopy at 298 K.Effects of the surfactant structure and BSA concentration on the interactions were examined.The interaction mechanism between BSA and surfactants at a relatively low concentration range was discussed using the Stern-Volmer equation and a model of the pseudo association constant.Each of the quaternary ammonium surfactants has a fluorescence quenching effect on BSA and leads to a blue shift of the maximum emission wavelength.The Stern-Volmer quenching constant and the pseudo association constant increase,which indicates that the interactions between surfactants and BSA become stronger,as the hydrophobic chain lengths increase.
Key Words: Quaternary ammonium surfactant;Bovine serum albumin;Fluorescence quenching;Hydrophobic interaction; Pseudo association constant
表面活性剂与蛋白质等生物大分子相互作用的研究一直是人们十分感兴趣的课题,其主要包括表面活性剂-蛋白质复合物结构、蛋白质结构变化以及相互作用机制;表面活性剂结构、浓度、溶剂、pH值、离子强度和温度等因素对相互作用有影响.表面活性剂与蛋白质的结合作用常常引起蛋白质构象及某些氨基酸残基周围微环境的改变[1-2].离子型表面活性剂与蛋白质的作用类型主要有特异性结合作用(包含静电作用和疏水作用)和协同性结合作用[3-4]等,表面活性剂的烷基链长度及头基类型对结合作用的影响已多见报道[5-7].研究这些作用的方法不仅有传统的表面张力法、电导法、电化学法和黏度法等,更有现代不断发展的光谱法、圆二色谱法、小角X射线散射法、电子自旋共振光谱法和量热法等[5-10].荧光法因其分析快捷、灵敏度高已成为最常用的方法之一,该方法是基于蛋白质中某些氨基酸残基周围微环境极性的变化引起荧光发射强度的改变,从而分析表面活性剂与蛋白的结合机制并监测蛋白质三维结构的变化.
牛血清白蛋白(BSA)具有较为清楚的组成和结构,且易于分离、提纯,成为最常用的模型蛋白质之一,它与表面活性剂主要形成BSA(native)-表面活性剂及BSA(unfolded)-表面活性剂复合物[8].季铵盐表面活性剂因其结构简单、高效、低毒,成为应用最广泛的一类阳离子表面活性剂之一.不同烷基链长或以不同基团取代甲基可形成丰富的季铵盐类表面活性剂,其新的功能和用途也不断被发现,例如通过调节表面活性剂烷基链及取代基可以改善抗疟疾、抗感冒类药物的活性[11];用N-十二烷基-N,N-二甲基-N-乙基溴化铵改善玉米蛋白的溶解性,可提高营养价值[3];N-十二烷基-N,N-二(2-羟乙基)-N-甲基氯化铵可作为插入试剂用于制备有机蒙脱石[12];以铑-N-十二烷基-N-(2-羟乙基)-N,N-二甲基氯化铵复合体系可作为有机相转移催化剂[13];N-十二-N-十八烷基-N,N-二(2-羟乙基)-N-甲基溴化铵具有液晶性质[14].
为了深入考察季铵盐表面活性剂与蛋白质的相互作用,本文用荧光光谱法研究系列N-烷基-N,N-(2-羟乙基)-N-甲基溴化铵(烷基链长为C12到C16)与牛血清白蛋白(BSA)的相互作用,运用理论模型处理实验数据得到猝灭常数、结合常数、平均结合位点数等重要相互作用参数,以阐明表面活性剂与BSA的结合机制及作用规律,特别是表面活性剂结构对二者结合作用的影响.
1 实验部分
1.1 仪器与试剂
FP-6200型荧光分光光度计(日本,Jasco公司);Finnpipette移液器(上海雷勃分析仪器有限公司)5-50 μL,20-200 μL;TB-85型超级恒温器(日本,Shimadzu公司);UPWS-10T超纯水器(杭州永洁达净化科技有限公司);AB265-S电子分析天平(瑞典,METTER TOLEDO公司).
牛血清白蛋白(BSA)购于上海伯奥生物科技有限公司,氮含量≥13.5%;三种季铵盐表面活性剂N-十二烷基-N,N-(2-羟乙基)-N-甲基溴化铵(DDHAB)、N-十四烷基-N,N-(2-羟乙基)-N-甲基溴化铵(TDHAB)和 N-十六烷基-N,N-(2-羟乙基)-N-甲基溴化铵(CDHAB)为本实验室合成[15];三羟基氨基甲烷(Tris)(纯度≥99.9%)、HCl(浓度为 36%-38%)、NaCl(含量≥99.5%)均为分析纯;实验用水为超纯水器处理的超纯水.
配制pH=7.1的Tris-HCl缓冲溶液(内含0.1 mol·L-1的NaCl以维持离子强度),用上述Tris-HCl缓冲溶液分别配制以下溶液备用:4.0、8.0、12.0、15.0 μmol·L-1BSA 溶液;1.5×10-2mol·L-1DDHAB 溶液;5.0×10-3mol·L-1TDHAB 溶液;1.5×10-3mol·L-1CDHAB溶液.
1.2 实验方法
BSA荧光激发和发射光谱的测定:移取一定量BSA溶液于石英比色皿中,设置发射波长为280 nm,狭缝宽度为5 nm,在室温(298 K)下绘制250-350 nm的荧光激发光谱,测得其最大激发波长为282 nm;并在其最大激发波长处设置狭缝宽度为5 nm,在室温(298 K)下绘制300-400 nm的荧光发射光谱,得到荧光发射光谱的最大发射波长为345 nm.
三种季铵盐型表面活性剂对不同浓度下BSA的荧光滴定:分别移取上述不同浓度的BSA溶液(每次3.0 mL)于石英比色皿中,用移液器分别逐次滴加一定量的上述三种表面活性剂溶液(累计体积<200 μL)进行荧光滴定.测定时荧光激发和发射最大宽度均为5 nm,最大激发波长为282 nm,记录最大荧光强度.
2 结果与讨论
BSA有三个类似的结构域,每个结构域又包含两个亚结构域,且以槽口相对的方式形成圆筒状结构,每个亚结构域又分成三个螺旋(X,Y,Z)[16].几乎所有的疏水性氨基酸都包埋在圆筒腔内,从而结构域内易形成疏水表面.疏水区可结合小分子,特别是长链脂肪酸、表面活性剂、药物分子及含有脂环族类化合物等[17].由于BSA分子中色氨酸(Trp)和酪氨酸(Tyr)、苯丙氨酸(Phe)等氨基酸残基可吸收270-300 nm紫外光产生荧光,从而成为内源性荧光物质.BSA的内源荧光主要由Trp产生,其荧光最大激发波长在282 nm附近.
2.1 表面活性剂对BSA的荧光猝灭
2.1.1 荧光猝灭光谱
荧光猝灭是由于分子间的碰撞、激发态与基态分子之间的反应、分子重排、能量转移以及形成基态复合物等引起的荧光强度逐渐减小的过程.其猝灭机理通常划分为两类:一是动态猝灭,随着温度升高,猝灭速率加快;二是静态猝灭,随温度变化不大,主要是与猝灭剂分子形成复合物所致[18].为了更好地理解其作用机理,按照上述实验方法,固定BSA浓度,逐渐增大表面活性剂的浓度,在最大激发波长(282 nm)下,测得298 K时三种表面活性剂分别对BSA的荧光猝灭光谱.图1示出TDHAB对BSA(4.0 μmol·L-1)的荧光猝灭光谱及对BSA最大发射波长的影响,另两种表面活性剂情况类似.
由图1可知,在实验条件下,随着表面活性剂的加入,BSA的荧光强度逐渐减小,呈现规律性猝灭(图1(a)).实验中,表面活性剂浓度均在其临界胶束浓度(cmc)之下(298 K时DDHAB,TDHAB和CDHAB的 cmc值分别为 13.0、3.25和 0.756 mmol·L-1[19]),它为BSA的荧光猝灭剂,这与其它阳离子表面活性剂[7]类似.同时,BSA的最大发射波长发生明显蓝移(如图1(b),TDHAB从345 nm蓝移到334 nm),这是因为随着表面活性剂的加入,BSA结构发生解折叠,Trp逐步暴露到表面,Trp周围的微环境发生了变化,疏水性增强[1,8].实验结果表明,三种表面活性剂与BSA之间均存在明显的相互作用,蓝移现象说明在溶液中存在着不同形态的BSA-表面活性剂复合物,这些复合物的形成都将使Trp残基周围的微环境疏水性增强.
2.1.2 表面活性剂结构对BSA荧光猝灭的影响
根据实验测得的表面活性剂-BSA荧光猝灭光谱,得到荧光强度比(I0/I)随表面活性剂浓度([S])的变化,I0为未加入猝灭剂(表面活性剂)时荧光物质(BSA)的荧光强度,I为猝灭剂(表面活性剂)浓度等于[S]时BSA的荧光强度,如图2所示,其中BSA浓度为4.0 μmol·L-1.从图2可以看出:(1)三种表面活性剂对BSA的荧光猝灭效应与烷基链长相关,烷基链越长,对BSA的荧光猝灭效应越强,该结果类似文献报道[5-7,20-22].在低浓度区,离子型表面活性剂与BSA的相互作用主要有表面活性剂的头基部分与BSA中氨基酸带电离子部分的静电作用和表面活性剂中的疏水碳链与蛋白质中疏水基团之间的疏水作用[3,23].同种类型表面活性剂与BSA的静电作用差异不大,因此影响二者相互作用的主要因素取决于疏水作用的强弱.显然对于同一类型的表面活性剂,烷基链越长,疏水作用越强,其疏水强弱顺序为CDHAB>TDHAB>DDHAB.(2)三种表面活性剂对BSA的猝灭情况存在差异.在本实验浓度范围,烷基链相对较长的CDHAB,其I0/I-[S]浓度曲线出现拐点,并随浓度增大变化趋缓出现平台;TDHAB有出现拐点迹象,但未出现平台;烷基链相对最短的DDHAB未出现拐点.曲线拐点,特别是平台的出现,是表面活性剂与BSA结合趋于完全或表面活性剂在BSA表面聚集逐渐趋于饱和的一种表现[24];拐点的位置和形状与结合常数的大小有关,后续还要采用理论模型进行计算和讨论.
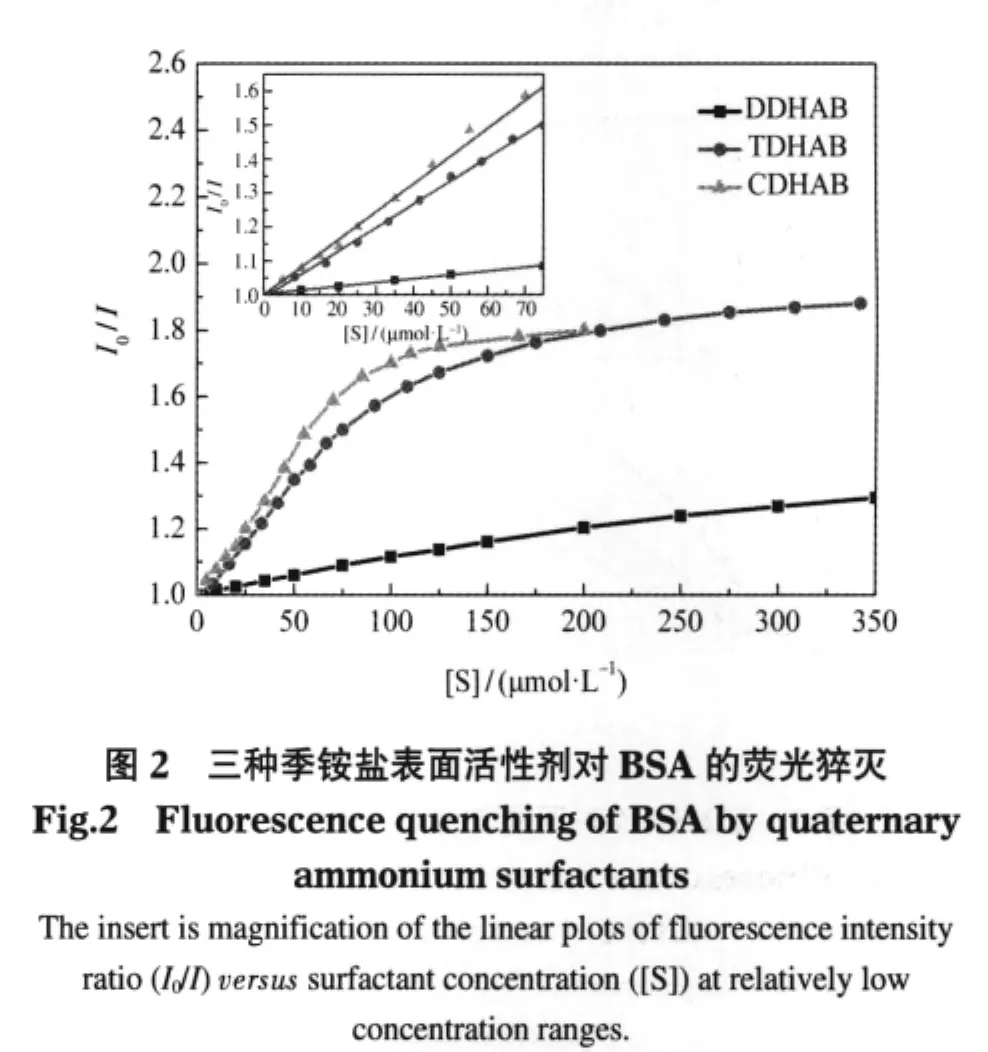
2.1.3 BSA浓度对荧光猝灭的影响
图 3 为不同 BSA 浓度(4.0、8.0、12.0、15.0 μmol·L-1)时TDHAB对BSA荧光猝灭的影响,其它两种表面活性剂的情况类似.
此实验结果表明,TDHAB对BSA的荧光猝灭效应与BSA浓度有关:BSA浓度越小,表面活性剂对其的猝灭效应越强,且在本实验浓度范围内出现拐点;BSA浓度较大时,表面活性剂对其的猝灭效应较弱,达到相同I0/I值时所需表面活性剂的量要大.另两种表面活性剂实验结果有类似规律.结合图2可知,[S]/[BSA]值越大,表面活性剂对BSA的猝灭作用越强,二者的结合作用越大,较易达到作用完全或饱和,相应的I0/I-[S]曲线可在相对较低的表面活性剂浓度区内出现拐点甚至出现平台.
2.2 Stern-Volmer猝灭常数
对于低浓度线性区(如图2和图3的插入图),三种表面活性剂对BSA荧光猝灭效应较好地符合Stern-Volmer方程[1]:

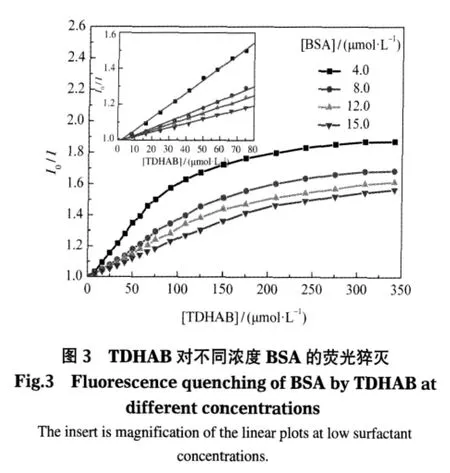

表1 不同BSA浓度体系的Stern-Volmer猝灭常数(Ksv)值Table 1 Stern-Volmer constants(Ksv)of the system with different BSA concentrations
式中,Ksv称为Stern-Volmer猝灭常数.表2列出表面活性剂浓度低于 80 μmol·L-1时,按式(1)拟合得到不同BSA浓度时体系的Stern-Volmer猝灭常数.
猝灭常数Ksv在一定程度上反映了表面活性剂与BSA相互作用的大小.从Ksv值(表1)可看出,在相同BSA浓度下,表面活性剂的烷基链越长,Ksv值越大,其与BSA的作用越强;同种表面活性剂,随着BSA浓度增大,Ksv减小,这主要是因为表面活性剂与BSA结合时,其单体有一个重新分布到蛋白质分子可键合位点的过程,但不与Trp发生作用,BSA浓度的增大,对表面活性剂相当于起到一个“稀释作用”,从而导致Ksv减小[25].
与甲基未被羟乙基取代的季铵盐表面活性剂(DTAB、TTAB和CTAB)相比[7],上述三种表面活性剂(DDHAB、TDHAB 和 CDHAB)与 BSA 的 Ksv值明显增大,这表明甲基被极性的羟乙基取代导致其与BSA的结合作用增强.
2.3 虚拟结合常数
表面活性剂与BSA之间的相互作用可用“虚拟结合常数”[6,24]来进一步分析与度量.定义虚拟结合常数Kb:

式中,[S]b为与BSA结合部分的表面活性剂浓度,[S]f为溶液中自由的表面活性剂浓度.
定义平均结合数n为每个BSA分子结合表面活性剂的平均分子数,n=[S]b/[BSA],代入(2)式则有:

若[S]t为表面活性剂总浓度,存在关系:[S]t=[S]b+[S]f,则表面活性剂与BSA结合平衡时有:

以[S]t对[BSA]线性拟合,由直线的斜率和截距可得n和[S]f,从而按式(3)可得Kb.
根据实验得到的三种表面活性剂分别与不同浓度BSA混合体系的相对荧光强度与表面活性剂浓度的关系,读取I0/I分别为一定值时所对应的表面活性剂浓度,然后将表面活性剂浓度对BSA浓度按式(4)作线性拟合,求出在不同 I0/I下的[S]f、n、Kb.I0/I=1.20的拟合结果列于表2.
表2数据表明:在同一荧光强度比(I0/I=1.20)时,三种表面活性剂(DDHAB、TDHAB和CDHAB)的虚拟结合常数Kb值依次增大,这归结于表面活性剂烷基链越长,对BSA的猝灭作用越强,即与BSA的结合作用越强;平均结合数n则依次减小,这可能是由于空间效应所致.结合作用越强,结合数越小,使得I0/I在相对较低的表面活性剂浓度时即趋于结合平衡,从图2中可观察到曲线I0/I-[S]出现拐点.
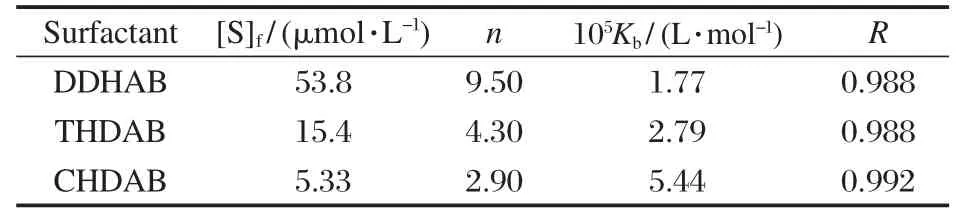
表2 I0/I为1.20时表面活性剂的浓度[S]f及其与BSA的结合参数Table 2 [S]fand binding parameters of surfactants on BSA at I0/I=1.20
3 结 论
用荧光光谱法研究Tris-HCl缓冲溶液(pH=7.1)中系列 N-烷基-N,N-二(2-羟乙基)-N-甲基溴化铵(烷基链长为C12到C16)与牛血清白蛋白(BSA)体系的光谱特征.结果表明:季铵盐表面活性剂对BSA有荧光猝灭作用,并且导致最大发射波长蓝移.三种季铵盐表面活性剂结构对上述过程的影响表现在:随着烷基链的增长,其对BSA的荧光猝灭效应增强;表面活性剂对BSA的猝灭效应与BSA浓度有关,BSA浓度小则猝灭效应强.表面活性剂对BSA的猝灭常数Ksv与其烷基链长度正相关;对于同种表面活性剂,BSA浓度越小,其Ksv越大.在相同I0/I时,烷基链越长,表面活性剂自由浓度越小,虚拟结合常数越大,说明表面活性剂与BSA作用越强,疏水作用在表面活性剂与BSA的相互作用中占主导地位.
1 De,S.;Girigowwami,A.;Das,S.J.Colloid Interface Sci.,2005,285:562
2 Wu,D.;Xu,G.Y.;Sun,Y.H.;Zhang,H.X.;Mao,H.Z.;Feng,Y.J.Biomacromolecules,2007,8:708
3 Mehta,S.K.;Bhawna;Bhasin,K.K.;Kumar,A.Colloids Surf.A,2009,346:195
4 Pi,Y.Y.;Shang,Y.Z.;Peng,C.J.;Liu,H.L.;Hu,Y.;Jiang,J.W.Biopolymers,2006,83:243
5 Lu,R.C.;Cao,A.N.;Lai,L.H.;Xiao,J.X.Colloids Surf.A,2006,278:67
6 Abuin,E.;Cristian,C.;Lissi,E.J.Photochem.Photobiol.A,2008,195:295
7 Madaeni,S.S.;Rostami,E.Chem.Eng.Technol.,2008,31:1265
8 Bordbar,A.K.;Taheri-Kafrani,A.Colloids Surf.B,2007,55:84
9 Gull,N.;Chodankar,S.;Aswal,V.K.;Sen,P.;Khan,R.H.;Kabirud-Din.Colloids Surf.B,2009,69:122
10 Li,Y.J.;Wang,X.Y.;Wang,Y.L.J.Phys.Chem.B,2006,110:8499
11 Calas,M.;Ancelin,M.L.;Cordina,G.;Portefaix,P.;Piquet,G.;Vidal-Sailhan,V.;Vial,H.J.Med.Chem.,2000,43:505
12 Wang,J.C.;Chen,Y.H.J.Appl.Polym.Sci.,2008,107:2059
13 Mevellec,V.;Leger,B.;Mauduit,M.;Roucoux,A.Chem.Commun.,2005:2838
14 Arkas,M.;Tsiourvas,D.;Paleos,C.M.;Skoulios,A.Chem.Eur.J.,1999,5:3202
15 Wang,Y.Y.;Tong,W.;Shao,S.;Lei,Q.F.;Fang,W.J.;Lin,R.S.Acta Chimica Sinica,2010,68:379 [王艳玉,童 威,邵 爽,雷群芳,方文军,林瑞森.化学学报,2010,68:379]
16 He,X.M.;Carter,D.C.Nature,1992,358:209
17 Gelamo,E.L.;Silva,C.H.T.P.;Imasato,H.;Tabak,M.Biochim.Biophys.Acta Proteins Proteomics,2002,1594:84
18 Li,L.;Wang,Y.X.;Song,G.W.;Wu,S.L.;Chu,P.K.;Xu,Z.S.J.Fluorine Chem.,2009,130:870
19 Zheng,Q.Calorimetric studies on the interaction between DNA and cationic surfactants[D].Hangzhou:Zhejiang University,2007[郑 青.DNA-阳离子表面活性剂相互作用的量热学研究[D].杭州:浙江大学,2007]
20 Gelamo,E.L.;Tabak,M.Spectrochim.Acta-Part A,2000,56:2255
21 Reynolds,J.A.;Herbert,S.;Polet,H.;Steinhardt,J.Biochemistry,1967,6:937
22 Diaz,X.;Abuin,E.;Lissi,E.J.Photochem.Photobiol.A,2003,155:157
23 Lakowiccz,J.R.Principle of fluorescence spectroscopy.2nd ed.New York:Plenum Press,1999:237-248
24 Lissi,E.;Abuin,E.;Lanio,M.E.;Alvarez,C.J.Biochem.Biophys.Methods,2002,50:261
25 Schweitzer,B.;Felippe,A,C.;Dal Bo,A.;Minatti,E.;Zanette,D.Macromol.Symp.,2005,229:208
Interactions between N-Alkyl-N,N-di(2-hydroxyethyl)-N-methylammonium Bromide and Bovine Serum Albumin
SHAO Shuang1,*HU Xiao-Huan2YOU Jin-Zong1LEI Qun-Fang2,*
(1Department of Chemistry,Zhejiang International Studies University,Hangzhou 310012,P.R.China;2Department of Chemistry,Zhejiang University,Hangzhou 310027,P.R.China)
O647;O657
Received:April 13,2010;Revised:July 5,2010;Published on Web:August 25,2010.
*Correspondingauthors.SHAOShuang,Email:sshao@zjei.net;Tel:+86-571-88802847.LEIQun-Fang,Email:qflei@zju.edu.cn;Tel:+86-571-88208655.
The project was supported by the National Natural Science Foundation of China(20673098)and Natural Science Foundation of Zhejiang Province,
China(Y4080201).
国家自然科学基金(20673098)和浙江省自然科学基金(Y4080201)资助项目
