人源血管紧张素转化酶-C结构域在毕赤酵母中的表达
2010-10-11赵钰岚徐珏许传莲
赵钰岚,徐珏,许传莲
浙江理工大学生命科学学院蛋白质组学与分子酶学研究室,杭州 310018
医学与免疫生物技术
人源血管紧张素转化酶-C结构域在毕赤酵母中的表达
赵钰岚,徐珏,许传莲
浙江理工大学生命科学学院蛋白质组学与分子酶学研究室,杭州 310018
血管紧张素转化酶 (ACE,EC3.4.15.1) 在调节血压方面具有重要作用,研究证实,ACE-C结构域是体内使血管紧张素I (AngI) 分解的主要活性位点。PCR扩增ACE-C结构域基因片段,克隆至分泌表达载体pPIC9K,转化毕赤酵母GS115,阳性克隆再次电转,用G418筛选高拷贝的酵母菌落进行表达条件优化,获得0.5 g/L的蛋白表达量及7.178 U/mL的酶活力。经Ni+亲和层析纯化,获得纯度大于97%的目的蛋白。Captopril对酶的抑制试验证明ACE-C结构域可望成为新一代抗高血压药物ACE抑制剂筛选的理想酶靶。
血管紧张素转化酶,催化结构域,毕赤酵母,卡托普利
Abstract:Angiotensin I-converting enzyme (ACE, EC3.4.15.1) plays an important role in regulating blood pressure. The C-domain of ACE has been identified as the main catalytic site of angiotensin I cleavageinvivo. The ACE gene fragment of the C-domain was amplified by PCR and cloned into the pPIC9K secretory expression plasmid. The recombinant plasmid was transformed intoPichia pastorisstrain GS115. Positive clones were selected and subject to electroporation. Antibiotic G418 was used for the screening of multicopy inserts. After optimization of the expression system, the protein yield reached 0.5 g/L by flask-shaking culture fermentation, and enzyme activity reached 7.178 U/mL in the fermentation supernatant. The purity of the target protein obtained was 97% after Ni+affinity chromatography. Enzyme inhibitory activity assay using Captopril showed that it is promising to use ACE-C domain as new generation of target for screening ACE inhibitor antihypertensive drugs.
Keywords:angiotensin converting enzyme, catalytic domain,Pichia pastoris, Captopril
血管紧张素转化酶 (Angiotensin-converting enzyme,ACE) 是一种通过肾素-血管紧张素系统和激肽释放酶-激肽系统,参与血管紧张素II (Ang II)的生成和缓激肽 (BK) 的失活过程,对血压调节,肾脏和心血管功能起关键作用的锌离子依赖蛋白水解酶[1-5]。研究发现,ACE由两个同源的活性结构域 (C-结构域和 N-结构域) 组成,C-结构域主要与 AngII 的生成相关,N-结构域主要涉及出血调节[6-7]。体内实验表明,N-结构域对血压的调节没有显著影响,因此,ACE-C结构域与全长序列ACE生成Ang II的能力几乎相同[8]。
血管紧张素转化酶抑制剂 (ACEI) 是临床主要降压药物。目前,ACEI的设计均以全长序列 ACE为靶蛋白,这种相对非选择性的ACEI在抑制AngⅡ生成的同时也抑制了缓激肽的降解,易产生咳嗽、肾功能不全等副作用[9]。而ACE-C结构域的特异性抑制剂在有效抑制 AngⅡ生成的同时,又不完全抑制缓激肽的降解,稳定缓激肽浓度,能够有效减轻不良反应。最近在收缩前猪冠状微动脉模型中采用新一代ACE-C结构域特异性抑制剂 (RXPA380) 和ACE-N结构域抑制剂 (RXP407),该抑制剂是在这两种区域之间结构差异的基础上设计的,更具选择性,在增强安全性的同时,改善了对不同生理过程的控制[10-13]。靶向ACE-C结构域的ACEI药物有望成为降血压药物的新选择。
目前,用于 ACEI药物筛选的酶靶主要是提取自猪肾、兔肺的天然ACE全酶。本研究采用毕赤酵母表达系统,以完整的人源ACE开放阅读框为模板,克隆了 ACE胞外的 C结构域,实现了具有活性的ACE-C结构域可溶性表达,并通过Captopril对其酶活性的抑制分析,为ACE-C结构域特异性抑制剂筛选提供了新的靶点。
1 材料与方法
1.1 材料
1.1.1基因、菌株与试剂
Pichia pastoris菌株GS115、大肠杆菌DH12S、pPIC9K质粒为本实验室保存。含完整人源血管紧张素转化酶ORF的质粒GC-T7349购于广州复能基因公司。EcoRⅠ、NotⅠ和SacⅠ限制性内切酶,T4 DNA连接酶,TaqDNA聚合酶,蛋白分子量标准 (低) 为TaKaRa公司产品。KOD-Plus-DNA Polymerase为日本 TOYOBO公司产品。普通质粒小提试剂盒、DNA分子量标准 (MarkerⅢ,D15000) 为上海天根生物工程有限公司产品。胶回收试剂盒购自博大泰克。酵母提取物 (Yeast extract) 购自Oxoid公司。蛋白胨 (Polypepton) 购自日本Nihon Seiyaku公司。YNB购自 Amresco公司。Captopril、Hippuryl-His-Leu acetate salt (HHL) 购自美国 Sigma公司。Hippuric acid马尿酸标准品为Alfa Aesar公司产品。生物素 Biotin为 BBI公司产品。层析介质 Ni+Sepharose High Performance购自Amersham公司。DNA测序由上海英骏生物技术有限公司完成。
1.1.2PCR引物
所有引物均由上海生工生物工程有限公司合成。5′端引物 Primer1:5′-GGGGAATTCTCCCAACAG GTGACAGTCAC-3′ (下划线为EcoRⅠ酶切位点);3′端引物 Primer2:5′-GGGCGGCCGCTTAATGATG ATGATGATGATGGGAGTTCGGCGTCCAGTTGT-3′(下划直线为NotⅠ酶切位点;下划波浪线为 6个(CAT) 的His标签;黑体为引入的终止密码子)。
1.1.3培养基
活化培养基:YPD (10%酵母抽提物,20%蛋白胨,20%葡萄糖);
生长培养基:BMGY (10%酵母抽提物,甘油适量,20%蛋白胨,1 mol/L磷酸盐缓冲液,13.4%YNB,4×10−5%生物素);
表达培养基:BMMY (10%酵母抽提物,甲醇适量,20%蛋白胨,1 mol/L 磷酸盐缓冲液,13.4%YNB,4×10−5%生物素)。
1.2 方法
1.2.1pPIC9K-ACE-C载体的构建
以质粒GC-T7349为模板,上下游引物扩增ACE的C结构域片段,扩增条件为:94℃热变性2 min;94℃15 s,47℃30s,68 ℃ 2 min ,25个循环;68℃延伸 10 min。PCR 产物经过回收纯化以后,用EcoRⅠ、NotⅠ双酶切,连接入pPIC9K载体,连接产物转化 DH12S,提取阳性转化子的重组质粒pPIC9K-ACE-C,做酶切鉴定。
1.2.2重组质粒的电击转化及高抗性转化子的筛选
限制性内切酶SacⅠ将测序鉴定正确的高浓度重组质粒线性化,与电转化感受态细胞GS115混合转入0.2 cm电转杯,电击4 s左右,参数为:电压1 500 V;电容25 µF;电阻200 Ω。电击后,经孵育,涂布于MD平板,30℃培养2 d,至单克隆转化子出现,挑取菌落进行PCR鉴定。阳性菌落制备成电转化感受态细胞,进行2次电转,刮下MD板上生长的菌落分别涂布于含抗生素G418 3 mg/mL的YPD平板上,30℃培养2~3 d,筛选抗性强的转化子。
1.2.3重组质粒在酵母GS115中的表达与条件优化
从含3 mg/mL G418的YPD平板上挑取单克隆接种于 25 mL BMGY培养基,30℃培养 2 d至OD600= 2~6,离心收集菌体重新悬浮于 200 mL BMMY培养基,30℃培养,每隔24 h添加甲醇至终浓度为1%,诱导目的蛋白表达,分别在诱导后0、6、12、18、24、30、36、42、48、60、72、84、96 h取样,取上清进行12% SDS-PAGE电泳,并用Bradford法测总蛋白浓度和酶活力。
从含3 mg/mL G418的YPD平板上挑取单克隆接种于BMGY培养基,30℃培养2 d至OD600=2~6,离心收集菌体重新悬浮于BMMY (不添加甲醇与磷酸缓冲液) 培养基,2 mL分装于灭菌试管,一组添加磷酸缓冲液 (pH 6.0) 和不同浓度的甲醇至终浓度分别为0.5%、0.75%、1%、1.25%、1.5%、1.75%、2%、2.25%;一组添加甲醇至终浓度为1%和不同pH值的磷酸缓冲液,pH值分别为3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5。30℃诱导 2 d,取上清进行SDS-PAGE电泳,并用Bradford法测总蛋白浓度和酶活力。
重组酵母在 25 mL BMGY培养基中培养至OD600= 2~6,离心收集菌体,重悬于200 mL BMMY培养基,30℃诱导96 h (甲醇诱导浓度1.75%) 后,上清进行12% SDS-PAGE、Western blotting鉴定蛋白质,Bradford法测定蛋白浓度,薄层凝胶扫描分析蛋白质纯度。
1.2.4表达蛋白的纯化
甲醇诱导表达的ACE-C分泌到毕赤酵母胞外,培养基于12 000 r/min离心30 min去除菌体,上清调pH值至7.4,NaCl浓度至500 mmol/L。取处理后的上清 600 mL以 3 cm/min的线速度加入Ni+-NTA层析柱中,收集流出液,得蛋白峰 1。首先用30 mL 上样缓冲液洗涤,得蛋白峰2,然后用含20 mmol/L、40 mmol/L咪唑的洗涤缓冲液分步洗涤 3次,每次 3 mL,分别得到蛋白峰 3、4。用含200 mmol/L咪唑的洗脱缓冲液洗脱5次,收集流出液共15 mL,得蛋白峰5。最后将经Ni+-NTA层析柱得到的蛋白液用10 kDa透析袋除盐12 h,收集后真空干燥。SDS-PAGE检测纯化效果。
1.2.5表达蛋白的活性测定
三肽HHL (马尿酰-组氨酰-亮氨酸,N-Hippuryl-His-Leu) 在 ACE的催化作用下快速分解产生马尿酸和二肽His-Leu,可通过HPLC测定马尿酸的生成量来评价ACE的酶活性。0.5 mL离心管中加入70 µL Tris缓冲液 (100 mmol/L Tris-HCl;300 mmol/L NaCl;10 µmol/L ZnCl2,pH 8.3),10 µL 培养基上清于 37℃恒温 5 min,随后加入 12.5 mmol/L HHL 20 µL,37℃恒温 30 min后沸水浴 10 min,15 000×g高速离心10 min,转移80 µL上清于HPLC管用作进样分析。HPLC检测条件为:0.1%乙酸溶液-乙腈(95.5∶4.5),维持0~5 min;在5~35 min流动相比例线性改变至 (85∶15);35~65 min流动相比例线性改变至 (68∶32),流速1.0 mL/min;检测波长330 nm;进样量20 µL。使用Agilent ZORBAX SB-C18分析柱 (4.6 m×150 mm,5 µm)。马尿酸做标准曲线计算马尿酸的生成量。酶活力定义:在上述条件下每分钟水解HHL生成1 nmol/L马尿酸所需要的酶量为一个单位 (U)。
1.2.6Captopril对表达产物ACE C-端结构域的抑制作用
精密称取2.17 mg Captopril,去离子水溶解并定容至10 mL容量瓶,即为1 mmol/L Captopril母液。稀释母液浓度至 102、10、1、10−1、10−2、10−3µmol/L。取 10 µL Captopril稀释液与 20 µL Tris缓冲液 (pH 8.3)、50 µL 0.5 µmol/L 酶液混匀,37℃孵育5 min后加20 µL HHL启动反应。按“1.2.5”方法测定不同浓度的 Captopril对 ACE-C结构域的抑制活性。空白对照加10 µL去离子水,计算IC50值,即抑制50% ACE-C结构域酶活性的Captopril浓度。
计算公式:Inhibition (%) = (a−b)/a×100%。
a为空白对照组中马尿酸的峰面积 (mAU×s);b为添加Captopril组中马尿酸的峰面积 (mAU×s)。
2 结果与分析
2.1 pPIC9K-ACE-C载体的构建与鉴定
重组质粒抽提,用 Primer1/Primer2引物进行PCR鉴定,得到约2 kb的片段 (图1),与目的基因大小 (1 915 bp) 相符,用限制性内切酶EcoRⅠ和NotⅠ进行双酶切,出现约9 kb和2 kb片段,与载体 (9.3 kb) 和目的基因 (1 915 bp) 条带大小相符,说明表达载体构建成功。重组质粒的测序结果 (测序图略) 也与NCBI的RNA库中查得的序列相符,未发生碱基突变。
2.2 酵母重组子的鉴定和筛选
毕赤酵母GS115为His−菌株,不能合成组氨酸,因此只有含HIS4基因的重组质粒整合入GS115后,与宿主进行互补,才能在不含组氨酸的培养基MD板上生长。SacⅠ线性化后的重组质粒转化GS115后,产生 His+Mut+重组子,挑取单克隆用GS115基因组上 5′AOX1引物和 3′AOX1引物进行PCR鉴定 (图2),可见两条带,一条为目的基因约2.5 kb,另一条为AOX基因约2.2 kb,野生菌GS115扩增出一条带,为AOX基因,空载体对照扩增出一条大小约500 bp的带。为增加目的基因在酵母基因组中的拷贝数,提高表达量,对阳性重组子进行了2次电转,并用高浓度G418筛选高拷贝数转化子,最终获得能抗G418 3 mg/mL的酵母转化子。
2.3 ACE-C结构域的诱导表达和鉴定
2.3.1甲醇浓度对蛋白表达量和酶活力变化的影响
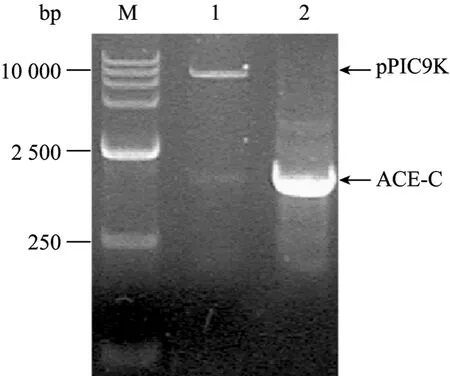
图1 重组质粒的PCR鉴定与双酶切鉴定Fig.1 PCR amplication of ACE-C gene and restrication analysis of the expression vector pPIC9K-ACE-C. M: DNA marker; 1: pPIC9K-ACE-C/EcoRⅠ+NotⅠ; 2: PCR of ACE-C gene.
本菌种为Mut+型,对甲醇的消耗能力较强。结果如图3所示,甲醇浓度1.75%时,总蛋白量和酶活力都是最高的。
2.3.2pH条件对蛋白表达量和酶活力变化的影响
pH值降低会影响细胞的膜通透性,进而影响蛋白的分泌。结果如图4所示,不同pH值对酶活力的影响较大;酸性环境明显不利于ACE-C结构域的表达,在pH 5.5时,蛋白表达量和酶活力最高。

图2 PCR鉴定毕赤酵母整合Fig.2 PCR analysis of recombinant strain. M: DNA marker;1,2: the expression strain of pPIC9K; 3,4: wild strain; 5: the expression strain of pPIC9K-ACE-C.
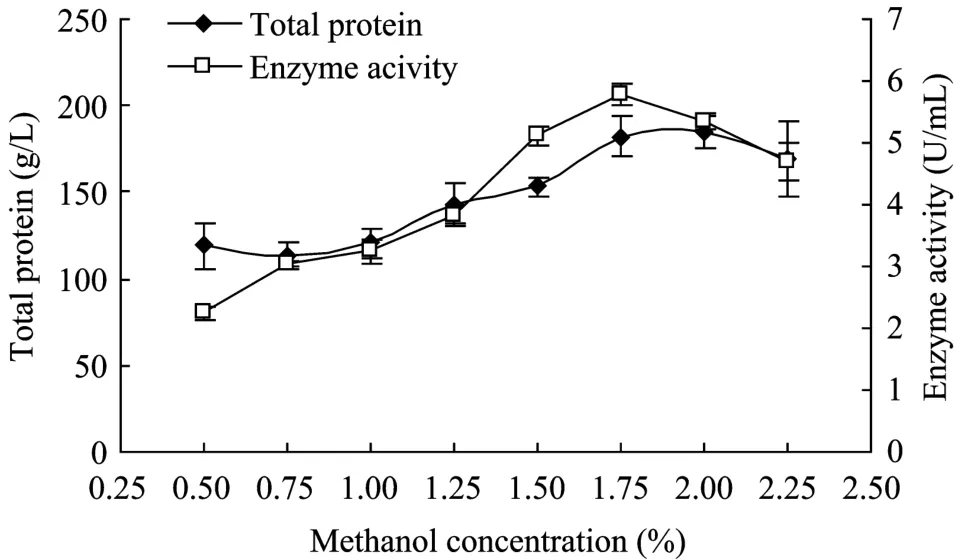
图3 不同甲醇浓度诱导下的总蛋白和酶活力变化Fig.3 Yield of protein and enzyme activity in the fermentation supernatant induced by different concentration of methanol.

图4 不同pH条件下甲醇诱导的总蛋白和酶活力变化Fig.4 Yield of protein and enzyme activity in the fermentation supernatant of different pH condition.
2.3.3诱导时间对蛋白表达量和酶活力变化的影响
pH 5.5、1.75%甲醇诱导条件下发酵96 h,不同时间段的总蛋白和酶活力变化结果如图5所示。
2.3.4重组蛋白的鉴定
上述结果可见pH 5.5和1.75%甲醇终浓度诱导96 h后能获得高表达有活力的酶蛋白,表达总蛋白为0.5 g/L,平均酶活力为5.235 U/mL,分子量约为97.2 kDa。12% SDS-PAGE和Western blotting鉴定结果见图6和图7。
2.4 表达产物的纯化
表达上清液经Ni+Sepharose High Performance亲和柱一步纯化后,用40 mmol/L咪唑浓度的洗脱液洗脱获得高纯度的目的蛋白,结果见图 8。薄层凝胶扫描分析蛋白质纯度为97%。
2.5 卡托普利对表达产物 ACE-C结构域的抑制作用
应用 ACE抑制剂卡托普利对表达产物 ACE-C结构域的抑制活性进行考察,其浓度与抑制率关系
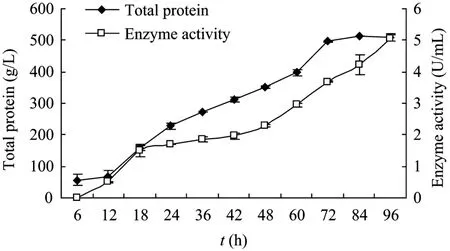
图5 不同时间段的总蛋白和酶活力变化Fig.5 Yield of protein and enzyme activity in the fermentation supernatant at different stages after induced in culture.
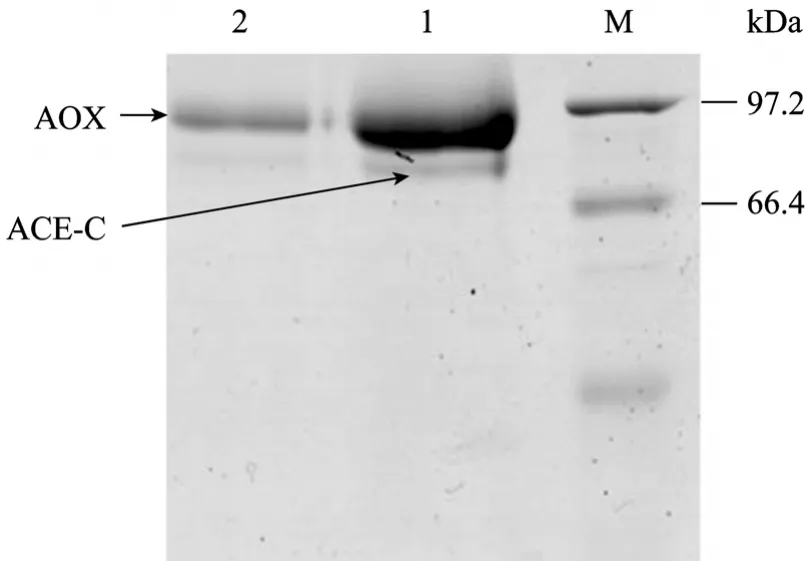
图6 酵母菌表达重组蛋白的SDS-PAGE分析Fig.6 SDS-PAGE analysis of the expression. M: protein marker; 1: control of pPIC9K; 2: ACE-C domain.
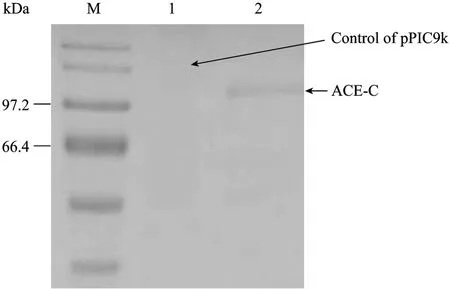
图7 ACE-C结构域的Western blotting鉴定Fig.7 Western blotting analysis of the expression. M: protein marker; 1: control of pPIC9K; 2: ACE-C domain.
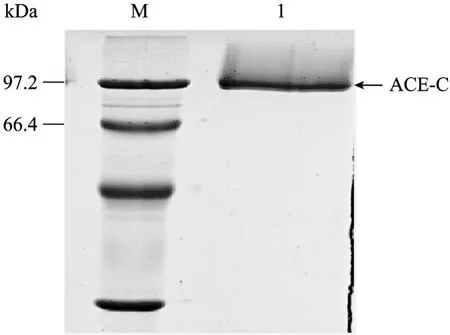
图8 ACE-C结构域纯化的SDS-PAGE分析Fig.8 Purification of the ACE-C domain. M: protein marker;1: ACE-C domain.
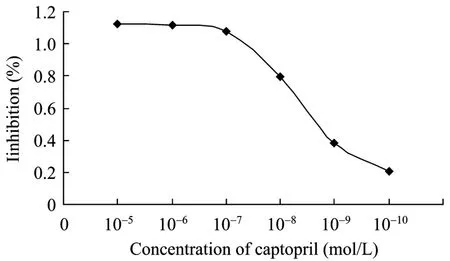
图9 Captopril对ACE-C结构域的抑制Fig.9 Inhibition of ACE-C domain by captopril.
如图9所示,卡托普利的浓度范围在10−8~10−9mol/L之间浓度与抑制率成线性关系。计算 IC50值为7.38×10−9mol/L。
3 讨论
肾素-血管紧张素系统药物在高血压的治疗中表现突出,广泛用于临床的两大类是血管紧张素转化酶抑制剂和非肽类血管紧张素受体拮抗剂 (沙坦类),这两类药物是近年来发展较快的降压药物。目前国内外心血管药品市场中的血管紧张素转化酶抑制剂药物主要有 Enalapril、Benaze-pril、Benazepril、Lisinopril、Quinapril,它们具有卓越的疗效和良好的耐受性,遗憾的是存在不良反应,尤其干咳现象较为突出。
因为传统的 ACEI能够抑制强效的血管收缩物质血管紧张素的生成,同时也能抑制了缓激肽的降解。浓度升高的缓激肽虽然起到了舒张血管的作用,但也会引起干咳等不良反应。在对ACE的两个结构域的研究中发现针对ACE-C结构域的抑制剂可以抑制血管紧张素II的生成,但又不能完全抑制缓激肽的降解,有望减轻药物带来的副作用。
本实验中克隆的ACE-C结构域含有丰富的二硫键及糖基化位点,在大肠杆菌中表达不能正确折叠,形成无活性的包涵体[14-15]。本研究采用毕赤酵母表达系统后,成功并且高效地表达了ACE-C结构域。表达策略主要包括:在外源蛋白基因的 5′端去掉了天然信号肽;采用pPIC9K载体上的a交配因子信号肽和KEX2酶切位点序列,它们可将外源蛋白分泌至胞外并将a交配因子信号肽切除;采用EcoRⅠ和NotⅠ双酶切位点;在表达蛋白基因的3′端去掉了原蛋白的膜锚定区和胞内结构域,Tracy等实验证实,3′端是否去掉ACE-C结构域的膜锚定区,对增加分泌性 ACE-C结构域的表达量有较大影响[16];在 3′端增加了 His6-tag序列以便纯化;在外显子选择方面采用了sACE与tACE共同的基因序列,以便更好地反映ACE整体特征;为提高外源蛋白表达量,用2次电转来增加高拷贝菌株概率,筛选获得高拷贝菌株。
对发酵诱导条件中 pH、甲醇诱导浓度、诱导时间的进行优化,使蛋白表达量增加到0.5 g/L,平均酶活力达到5.235 U/mL,最高酶活力达到7.178 U/mL,适合工业化发酵生产,由于摇瓶发酵导致的目的蛋白及蛋白酶活力的不稳定有望在高密度发酵水平得到改善。由于外源蛋白融合了His6-tag,经一步纯化即可达到纯度为97%。卡托普利作为抑制剂标准品,考察了卡托普利对ACE-C结构域的抑制动力学,不同文献报道的卡托普利对 ACE的抑制活性各不相同,IC50值为 7.5×10−10~2.2×10−8mol/L[17],这可能与不同的酶来源、不同的测试底物等因素有关。Nicolas等最新报道,在其发现的一系列次磷酸三肽化合物中,8F2化合物对ACE-C结构域及ACE-N结构域的Ki值分别为 6.5×10−10mol/L和 1500×10−10mol/L,显示出良好的ACE-C结构域选择性,同时,对内皮素转化酶抑制剂也具有抑制作用[18]。8F2对ACE-C结构域的IC50为7.31 nmol/L,半抑制浓度与卡托普利相接近;如能同时测定8F2与卡托普利对本研究所表达的ACE-C结构域半抑制浓度,将更有意义。同时,由于次磷酸三肽分子量较卡托普利大,结构较卡托普利复杂,作为临床用药,卡托普利无疑更具有优势。
综上所述,ACE-C结构域在毕赤酵母中的成功表达为ACE-C结构域抑制剂的高通量筛选提供了特异性的酶靶。
REFERENCES
[1] Erdös EG. Angiotensin I converting enzyme and the changes in our concepts through the years: Lewis K. Dahl memorial lecture.Hypertension, 1990, 16: 363−370.
[2] Bhoola KD, Figueroa CD, Worthy K. Bioregulation of kinins: kallikreins, kininogens, and kininases.Pharmacol Rev, 1992, 44(1): 1−80.
[3] Gavras H. Corcoran lecture: angiotensin-converting enzyme inhibition and the heart.Hypertension, 1994, 23:813−818.
[4] Linz W, Wiemer G, Gohlke P,et al. Contribution of kinins to the cardiovascular actions of angiotensin-converting enzyme inhibitors.Pharmacol Rev, 1995, 47(1): 25−49.
[5] Dzau VJ. Theodore Cooper lecture: tissue angiotensin and pathobiology of vascular disease: a unifying hypothesis.Hypertension, 2001, 37: 1047−1052.
[6] Soubrier F, Alhenc F, Hubert C,et al. Two putative active centers in human angiotensin I-converting enzyme revealed by molecular cloning.Proc Natl Acad Sci USA,1988, 85(24): 9386−9390.
[7] Wei L, Alhenc F, Corvol P,et al. The two homologousdomains of human angiotensin I-converting enzyme are both catalytically active.J Biol Chem, 1991,266: 9002−9008.
[8] Sebastien F, Hong DX, Christine H,et al. Angiotensinconverting enzyme C-terminal catalytic domain is the main site of angiotensin I cleavagein vivo.Hypertension,2008, 51: 267−274.
[9] Zhao YL, Xu CL. Structure and function of angiotension converting enzyme and its inhibitors.Chin J Biotech,2008, 24(2): 171−176.
赵钰岚, 许传莲. 血管紧张素转换酶的结构功能及相关抑制剂. 生物工程学报, 2008, 24(2): 171−176.
[10] Georgiadis D, Beau F, Czarny B,et al. Roles of two sites of somatic angiotensin-converting enzyme in the cleavage of angiotensin Ⅰand bradykinin: insight from sel ective inhibitors.Circ Res, 2003, 93: 148−154.
[11] Van Esch JHM, Tom B, Dive V,et al.Selective angiotensin-converting enzyme C-domain inhibition is sufficient to prevent angiotensinⅠ-induced vasoconstriction.Hypertension, 2005, 45: 120−125.
[12] Junot C, Gonzales MF, Ezan E,et al. A selective inhibitor of the N-domain of angiotensinⅠ-converting enzyme,blocksin vivothe degradation of hemoregulatory peptide acetyl-Ser-Asp-Lys-Pro with no effect on angiotensinⅠhydrolysis.J Pharmaco Exp Ther, 2001, 297: 606−611.
[13] Dive V, Cotton J, Yiotakis A,et al. RXP407, a phosphinic peptide, is a potent inhibitor of angiotensin Ⅰconverting enzyme able to differentiate between its two active sites.Proc Natl Acad Sci USA. 1999, 96: 4330−4335.
[14] Vassileva A, Chugh DA, Swaminathan S,et al. Effect of copy number on the expression levels of hepatitis B surface antigen in the methylotrophic yeastPichia pastoris.Protein Expr Purif, 2001, 21(1): 71−80.
[15] Cereghino J, Cregg JM. Heterologous protein expression in the methylotrophic yeastPichia pastoris.FEMS Microbiol Rev, 2000, 24: 45−66.
[16] Tracy W, Gouttaya M, Tougard C,et al. Cleavagesecretion of angiotensin I-converting enzyme in yeast.Mol Cell Endocrinol, 1997, 128(1): 39−45.
[17] Vermeirssen V, Camp VJ, Verstraete W. Optimisation and validation of an angiotensin-Ⅰ converting enzyme inhibitor assay for the screening of bioactive peptides.J Biochem Biophys Methods, 2000, 51: 75−87.
[18] Nicolas J, Anastasios M, Dimitris G,et al. Phosphinic tripeptides as dual angiotensin-converting enzyme C-domain and endothelin-converting enzyme-1 inhibitors.J Med Chem, 2010, 53(1): 208−220.
Expression of human angiotensin converting enzyme-C domain inPichia pastoris
Yulan Zhao, Jue Xu, and Chuanlian Xu
Laboratory of Proteomics & Molecular Enzymology,College of Life Science,Zhejiang Sci-Tech University,Hangzhou310018,China
Received:December 14, 2009;Accepted:March 22, 2010
Supported by:Key Project of Zhejiang Education Department (No. Z200804057), Project of Scientific and Technological Innovation Promotion for Student of Zhejiang Province (No. 14080131380912).
Corresponding author:Chuanlian Xu. Tel: +86-571-86843566; Fax: +86-571-86843745; E-mail: chuanlianxu@163.com
浙江省教育厅重点项目 (No. Z200804057),浙江省大学生科技创新推广项目 (No. 14080131380912) 资助。
