甲型H5N1流感病毒M2与HA双基因载体疫苗在小鼠体内的免疫学评价
2010-10-11郭建强姚立红陈爱珺徐一刘晓宇舒跃龙张智清
郭建强,姚立红,陈爱珺,徐一,刘晓宇,舒跃龙,张智清
1 中国疾病预防控制中心病毒病预防控制所 病毒基因工程国家重点实验室,北京 100052
2 中国疾病预防控制中心病毒病预防控制所 传染病预防控制国家重点实验室 国家流感中心,北京 100052
医学与免疫生物技术
甲型H5N1流感病毒M2与HA双基因载体疫苗在小鼠体内的免疫学评价
郭建强1,姚立红1,陈爱珺1,徐一1,刘晓宇1,舒跃龙2,张智清1
1 中国疾病预防控制中心病毒病预防控制所 病毒基因工程国家重点实验室,北京 100052
2 中国疾病预防控制中心病毒病预防控制所 传染病预防控制国家重点实验室 国家流感中心,北京 100052
高致病性H5N1亚型禽流感病毒 (AIV) 严重威胁到人类健康,因此研制高效、安全的禽流感疫苗具有重要意义。以我国分离的首株人H5N1亚型禽流感病毒 (A/Anhui/1/2005) 作为研究对象,PCR扩增基质蛋白2 (M2) 和血凝素 (HA) 基因全长开放阅读框片段,构建共表达H5N1亚型AIV膜蛋白基因M2和HA的重组质粒pStar-M2/HA。此外,还通过同源重组以293细胞包装出表达M2基因的重组腺病毒Ad-M2以及表达HA基因的重组腺病毒Ad-HA。用间接免疫荧光 (IFA) 方法检测到了各载体上插入基因的表达。按初免-加强程序分别用重组质粒pStar-M2/HA和重组腺病毒Ad-HA+Ad-M2免疫BALB/c小鼠,共免疫4次,每次间隔14 d。第1、3次用DNA疫苗,第2、4次用重组腺病毒载体疫苗,每次免疫前及末次免疫后14 d采集血清用于检测体液免疫应答,末次免疫后14 d采集脾淋巴细胞用于检测细胞免疫应答。血凝抑制 (HI) 实验检测到免疫后小鼠血清中的 HI活性。ELISA实验检测到免疫后小鼠血清中抗H5N1亚型流感病毒表面蛋白的IgG抗体。ELISPOT实验检测到免疫后小鼠针对M2蛋白和HA蛋白的特异性细胞免疫应答。流感病毒M2与HA双基因共免疫的研究,为研究开发新型重组流感疫苗奠定了基础。
H5N1亚型流感病毒,基质蛋白2,血凝素,联合免疫
Abstract:We developed vectors expressing two antigen of H5N1 influenza virus. Based on the human H5N1 avian influenza virus strain A/Anhui/1/2005 isolated in China, we amplified the matrix protein 2 (M2) and Hemagglutinin (HA) genes by PCR and subcloned them into pStar vector to construct two genes co-expressing recombinant DNA vaccine pStar-M2/HA. After transfection of293 cells with the plasmid, we confirmed with indirect immunofluorescence assay (IFA) thatM2andHAgenes cloned on plasmid pStar co-expressed successfully. Using Ad-Easy adenovirus vector system, by homologous recombination in bacteria and packaging in 293 cells, we constructed two recombinant adenoviruses, namely Ad-M2 and Ad-HA. After infection of 293 cells with the recombinant adenoviruses, we confirmed with IFA thatM2andHAgenes cloned into adenoviruses expressed successfully. We then combined the recombinant DNA vaccine and adenoviral vector vaccines in immunization of BALB/c mice with a prime-boost regime. On day 0 and day 28, we immunized the mice with DNA vaccine and on day 14 and day 42, with recombinant adenovirus vaccines. We took blood samples before each injection and 14 days after the final injection. On day 56, we collected splenocytes from the mice. ELISA and hemagglutination inhibition (HI) assay showed that the vaccines successfully induced specific IgG antibodies against HA protein in serum of the immunized mice. ELISPOT confirmed that the vaccines successfully induced the special cellular immune response to M2 and HA protein of H5N1 influenza virus. The study on combined immunization withM2andHAgenes provided basis for development of novel influenza vaccine.
Keywords:H5N1 influenza virus, matrix protein 2 (M2), hemagglutinin (HA), combined immunization
禽流感 (Avian influenza,AI) 于1878年首发于意大利,后证实是由正粘病毒科流感病毒属A型流感病毒引起。禽流感不仅给畜牧业带来巨大的经济损失,而且严重威胁到人类的健康和生命。1997年我国香港首次发现 H5N1亚型禽流感病毒 (Avian Influenza Virus,AIV) 感染人的病例,2005年10月,我国安徽省发生首例确诊的人感染H5N1亚型AIV病例[1],并分离到我国首株人 H5N1亚型 AIV(A/Anhui/1/2005)。目前已有多个国家出现H5N1亚型AIV感染人的情况。AIV在公共卫生学上的意义,使得研制高效、安全、生产工艺简单、适合人用的AI疫苗成为病毒学工作者的重要任务。
血凝素 (Hemagglutinin,HA) 是流感病毒颗粒表面的一种糖蛋白,具有凝集红细胞的能力,它可以识别靶细胞受体并与之结合,在病毒吸附和膜融合过程中起着重要作用,HA能诱导保护性中和抗体的产生,是流感疫苗的重要组成部分。流感病毒基质蛋白2 (Matrix protein 2,M2) 大量表达于感染细胞的表面,具有对病毒脱壳和出芽起重要作用的离子通道活性。M2蛋白不仅可以诱导机体产生抗体,而且是细胞毒性T淋巴细胞的靶抗原,因此可作为研究流感亚单位疫苗的靶蛋白。
DNA疫苗作为一种新型疫苗,可有效刺激体液和细胞免疫应答,适合在联合免疫时作为初免疫苗使用,是一种非常安全的候选疫苗。pStar载体具有巨细胞病毒 (Cytomegalovirus,CMV) 强启动子和内部核糖体进入位点序列 (Internal ribosome entry site,IRES),IRES上游和下游各有一个多克隆位点(Multiple cloning site,MCS),可用于构建双基因共表达DNA疫苗。腺病毒载体在哺乳动物中可高效表达外源蛋白,已经广泛应用于疫苗研究。与复制型腺病毒相比,非复制型腺病毒更为安全,而且因非复制型腺病毒以低剂量产生抗原蛋白,不裂解细胞,有利于激发长期的免疫反应[2]。已有文献报道使用腺病毒载体表达流感病毒的 HA蛋白并获得了较好的动物免疫效果[3-4]。
本实验构建了重组质粒pStar-M2/HA以及重组腺病毒Ad-HA、Ad-M2,将其作为疫苗联合免疫小鼠,对免疫效果进行评价。
1 材料和方法
1.1 材料
灭活 H5N1亚型流感病毒 (A/Anhui/1/2005)、M2及HA基因模板、马红细胞 (Horse red cells,HRC)、火鸡红细胞 (Turkey red cells,TRC)、受体破坏酶 (Receptor destroying enzyme,RDE) 由国家流感中心提供;双基因共表达pStar载体、Ad-Easy腺病毒载体系统、293细胞由本室保存;表达HA单基因的重组pStar-HA由本室构建;引物合成及测序由三博远志公司完成;各种限制性内切酶、Pyrobest DNA聚合酶、去磷酸化酶CIAP购自TaKaRa公司;pGEM-T Easy Vector购自Promega公司;DNA片段回收试剂盒、质粒DNA小量快速提取试剂盒、去内毒素质粒大量提取试剂盒购自 Qiagen公司;大片段质粒提取试剂盒购自Omega公司;DMEM培养基、胎牛血清、OPTI-MEM 购自 Gibco公司;Lipofectamine 2000购自Invitrogen公司;鼠抗H5N1 M2多克隆抗体、鼠抗H5N1 HA多克隆抗体由本室制备;FITC标记的羊抗鼠IgG购自中杉金桥公司;4~6周龄雌性 BALB/c小鼠购自北京维通利华实验动物技术有限公司;DNA疫苗免疫添加 CpG基序作为佐剂,序列为:5′-TCCATGACGTTCCTGACGTT-3′,由 TaKaRa公司合成,中国疾病预防控制中心病毒病预防控制所蒋涛博士惠赠;包含 H5N1亚型流感病毒HA蛋白所有氨基酸残基的肽库 (含77条多肽) 及M2蛋白所有氨基酸残基的肽库 (含11条多肽) 由英国 Sigma公司合成,英国剑桥大学Medical Research Council的Chris Li博士惠赠;流感病毒 (A/Anhui/1/2005) M2蛋白完整胞外区多肽(Extracellular domain of M2 protein,M2e) 由北京华大中生科技发展有限公司合成;小鼠脾淋巴细胞分离液EZ-SepTM购自深圳达科为生物技术有限公司;ELISPOT试剂盒购自BD公司。
1.2M2和HA基因的扩增及pStar-M2/HA的构建
设计合成两组引物分别扩增 H5N1亚型 AIV(A/Anhui/1/2005)M2及HA基因完整开放阅读框(Open reading frame,ORF):引物 M2-NheI-FP (5′-CTAGCTAGCATGAGTCTTCTAACCG-3′) 与 M2-EcoR I-RP (5′-CGGAATTCTTACTCCAATTCTATGT T-3′) 用于扩增M2基因;引物 HA-BamH I-FP(5′-C GGGATCCATGGAGAAAATAGTGC-3′) 与 HA-SalIRP(5′-ACGCGTCGACTTAAATGCAAATTCTGC-3′)用于扩增HA基因。将M2基因和pStar载体分别用NheI及EcoR I双酶切后纯化回收相应片段,连接、转化大肠杆菌、酶切鉴定,重组载体命名为pStar-M2/(“/”表示 IRES序列)。再将HA基因和pStar-M2分别用BamH I、SalI双酶切后,纯化回收相应片段、连接、转化、酶切鉴定,重组载体命名为pStar-M2/HA。使用去内毒素质粒DNA大量提取试剂盒大量制备质粒。使用 Lipofectamin 2000将pStar-M2/HA和pStar分别转染293细胞,转染24 h后,分别使用鼠抗M2及鼠抗HA多克隆抗体,采用间接免疫荧光 (Indirect immunofluorescence assay,IFA) 法检测M2及HA基因的表达。
1.3 重组腺病毒载体疫苗的构建及鉴定
首先PCR扩增M2及HA基因片段 (两组引物上游酶切位点均为SalI,下游酶切位点均为NotI),将M2与HA基因分别克隆到穿梭载体pShuttle-CMV的 MCS,鉴定正确的重组载体分别命名为pShuttle-M2、pShuttle-HA。将这两个载体线性化后电转化含有pAd-Easy骨架载体的BJ5183感受态细菌,采用大片段质粒提取试剂盒提取质粒并酶切鉴定,重组腺病毒载体命名为pAd-M2、pAd-HA。将它们线性化后,使用 Lipofectamine 2000转染 293细胞,通过显微镜观察细胞病变效应 (Cytopathic effect,CPE),出现明显CPE (++~+++) 时收集细胞,细胞沉淀用PBS重悬,冻融4次,上清即为Ad-M2、Ad-HA病毒原液。按1∶10的比例感染新的293细胞,如此反复制备出4代重组腺病毒。将293细胞培养至90%饱和度,感染重组腺病毒,24 h 后固定细胞,分别使用鼠抗M2及鼠抗HA多克隆抗体进行IFA检测。
1.4 小鼠实验及免疫效果评价
将4~6周龄雌性BALB/c小鼠随机分为3组 (5只/组):1)M2、HA双基因共免疫组 (M2HA),分别免疫pStar-M2/HA、AD-M2及Ad-HA;2)HA单基因免疫对照组 (HA),分别免疫pStar-HA和Ad-HA;3) 空载体阴性对照组 (NC),分别免疫 pStar及AD-easy。采用DNA疫苗与腺病毒载体疫苗联合免疫的方式,左右腓肠肌部位注射,100 μL/只。共免疫4次,每次间隔14 d。第1、3次用DNA疫苗,添加CpG佐剂 (重组pStar质粒为100 μg/只,CpG为10 μg/只)。第2、4次用重组腺病毒载体疫苗 (HA组与 NC组只免疫一种重组腺病毒,病毒量为2.5×108TCID50/只,M2HA组同时免疫2种重组腺病毒,Ad-M2、Ad-HA 病毒量均为 1.25×108TCID50/只)。4次免疫间隔均为 14 d,在每次免疫前和末次免疫后的 14 d采集血清用于 ELISA和血凝抑制(Hemagglutination inhibition,HI) 实验。全程免疫结束后 14 d,处死实验小鼠并取脾细胞样本用于ELISPOT实验。通过在线表位预测工具 (http://bio.dfci.harvard.edu/Tools/antigenic.pl) 对蛋白抗原多肽进行分析。
2 结果
2.1M2和HA基因ORF的克隆及pStar-M2/HA的构建
以我国首株分离到的人 H5N1亚型 AIV (A/Anhui/1/2005) 的cDNA作为模板,PCR扩增M2及HA基因。H5N1流感病毒M2和HA基因片段长度分别为294 bp、1 704 bp,电泳结果显示,两种PCR产物大小分别与M2和HA基因片段长度一致 (图略)。M2基因用NheI/EcoR I双酶切后插入pStar载体IRES上游MCS,HA基因用BamH I/SalI双酶切后插入 pStar载体 IRES下游 MCS。重组后的pStar-M2/HA用NheI/MluI双酶切可得到约300 bp的M2基因片段 (因为HA基因中含有EcoR I位点,所以使用MCS上EcoR I外侧的MluI切点代替);用BamH I/SalI双酶切,可得到约1700 bp的HA基因片段 (图1)。表明M2基因和HA基因分别插入到了pStar载体IRES上游及下游的MCS。

图1 pStar-M2/HA的酶切鉴定Fig.1 Identification of pStar-M2/HA by restriction endonuclease digestion. 1: DNA marker (DL2000); 2: pStar-M2/HA digested withNheI andMluI; 3: pStar-M2/HA digested withBamH I andSalI; 4: DNA marker (DL15000).
将pStar-M2/HA转染293细胞,24 h后,分别使用鼠抗M2多克隆抗体及鼠抗HA多克隆抗体进行IFA,检测到pStar-M2/HA中的M2及HA双基因共表达 (图2)。
2.2 重组腺病毒Ad-M2、Ad-HA的构建
用PCR方法分别扩增出M2及HA基因片段 (上游酶切位点换为SalI,下游酶切位点换为NotI),并分别将其插入到 pShuttle-CMV上,转化 DH5α感受态细胞,鉴定正确的重组载体分别命名为pShuttle-M2、pShuttle-HA。分别将两种重组载体用PmeI酶切、CIAP去磷酸化后,电穿孔转化含有pAd-Easy骨架载体的 BJ5183感受态细胞,进行同源重组。鉴定正确的重组腺病毒载体分别命名为pAd-M2、pAd-HA,将其用PacI酶切后转染293细胞,8 d后显微镜下可观察到CPE。将细胞收集、冻融、PBS重悬,上清即为pAd-M2、pAd-HA病毒原液,将其继续感染293细胞,3 d后可出现明显CPE(图3)。使用相同方法构建包装出不含外源基因的对照腺病毒,命名为Ad-easy。
2.3 IFA检测M2及HA基因的表达
Ad-M2、Ad-HA以及Ad-easy分别感染293细胞,进行IFA检测。使用鼠抗M2多克隆抗体可检测到感染Ad-M2的293细胞明显的黄绿色荧光,使用鼠抗HA多克隆抗体可检测到感染Ad-HA的293细胞明显的黄绿色荧光 (图 4),而感染 Ad-easy的293细胞使用两种抗体均未检测到特异性黄绿色荧光,表明两种重组腺病毒的外源基因在 293细胞中均成功地获得表达。
2.4 红细胞凝集抑制实验检测免疫小鼠血清中特异性HI抗体
将免疫前及每次免疫后 14 d采集的小鼠血清(共5批) 进行预处理,以灭活的流感病毒A/Anhui/1/2005 (H5N1) 作为抗原,用1%新鲜TRC悬液进行HI实验,免疫前及第1次免疫后14 d,各免疫组的小鼠血清中均未检测到 HI活性。在第 2次免疫后14 d,M2HA免疫组检测到了HI活性,并且随加强免疫的进行,其HI活性逐渐升高 (P<0.05) (图5A)。M2HA免疫组同HA单基因免疫对照组相比,各时间点两个免疫组之间HI效价比较接近,无统计学差异 (P>0.05)。阴性对照组各时间点的血清均未检测到HI活性。此外还用1%新鲜HRC悬液和1%新鲜TRC悬液进行HI对比实验。结果显示,全程免疫后的 M2HA免疫组使用两种红细胞均检测到了 HI活性,并且使用HRC测定HI的敏感性更高 (图5B)。M2HA免疫组同HA单基因免疫对照组相比,HI效价比较接近,无统计学差异 (P>0.05)。
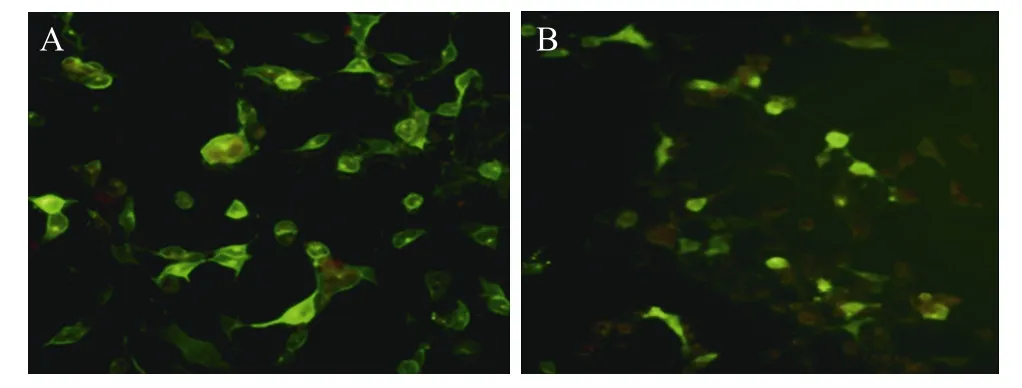
图2 IFA法检测pStar-M2/HA的双基因共表达 (200×)Fig.2M2gene andHAgene of pStar-M2/HA co-expression detected by IFA (200×). (A) Detection ofM2gene expression.(B) Detection ofHAgene expression.

图3 重组腺病毒感染293细胞的CPE (200×)Fig.3 CPE of 293 cells infected with recombinant adenovirus(200×). (A) Control 293 cells. (B) 293 cells infected with Ad-easy. (C) 293 cells infected with Ad-M2. (D) 293 cells infected with Ad-HA.

图4 IFA法检测重组腺病毒M2或HA基因表达 (200×)Fig.4M2orHAgene expression detected by IFA (200×). (A)M2gene expression of Ad-M2. (B)HAgene expression of Ad-HA.
2.5 ELISA检测免疫小鼠血清中抗H5N1亚型流感病毒IgG抗体
以灭活的流感病毒 A/Anhui/1/2005 (H5N1) 作为抗原,将全程免疫后的小鼠血清预处理后进行ELISA,测定吸光度值 (OD450)。结果显示,在血清稀释400倍和3 200倍的条件下,M2HA免疫组吸光度值明显大于NC组 (P<0.05),表明M2HA免疫组小鼠血清中产生了针对流感病毒表面蛋白 (HA)的抗体 (图6)。M2HA组与HA对照组吸光度值无明显差异 (P>0.05)。

图5 HI滴度检测Fig.5 Detection of HI titers. (A) HI titers of different groups(TRC). (B) HI titers with different red blood cells.
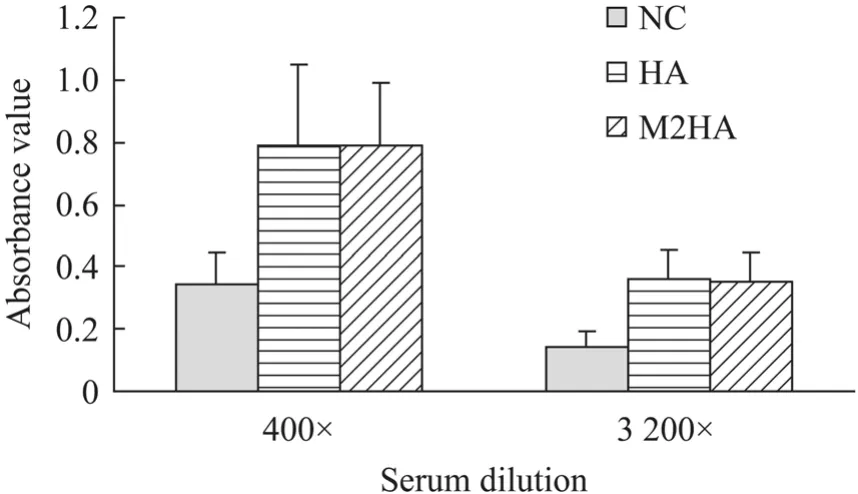
图6 ELISA检测抗流感病毒A/Anhui/1/2005 IgG抗体Fig.6 Detection of anti-influenza virus A/Anhui/1/2005 IgG antibodies.
2.6 HA表位筛选
首先通过ELISPOT实验,从包含H5N1亚型流感病毒HA蛋白所有氨基酸残基的肽库 (含77条多肽,每条肽16~18个氨基酸,每两条相邻的肽有10个氨基酸残基的重叠) 中初步筛选出 HA-20、HA-21、HA-22、HA-23、HA-74和 HA-75共 6条多肽。进而使用HA免疫组脾淋巴细胞通过ELISPOT实验对这 6条多肽进行了比较。结果显示 (图 7),HA-74、HA-75刺激产生IFN-γ的能力最强,其次为HA-22号、HA-23,HA-20、HA-21刺激能力最弱。HA-22、HA-23、HA-74、HA-75这4条多肽均具有较强的刺激T淋巴细胞分泌IFN-γ的能力。通过在线表位预测工具对流感病毒 (A/Anhui/1/2005) HA蛋白的抗原表位进行分析,结果显示,该蛋白中存在23个抗原指数较高的抗原多肽,本实验中筛选出的HA-22/23/74/75四条多肽均位于抗原性较强的位置,其序列分别对应预测的8号、9号、23号多肽序列。HA-22/23/74/75四条多肽与预测的HA蛋白表位一致性比较见表 1 (阴影部分为相应的一致性序列)。
使用刺激能力最强的 HA-74、HA-75进行ELISPOT实验,结果显示,M2HA免疫组小鼠均成功刺激出针对 H5N1 HA-74、HA-75的细胞免疫应答,M2HA免疫组与HA单基因免疫对照组之间无明显差异 (P>0.05) (图8)。
2.7 M2表位筛选
由于流感病毒 M2蛋白胞外区疫苗在多种亚型的流感病毒感染中都有广谱的保护作用,所以含M2基因的 DNA疫苗及腺病毒载体疫苗联合免疫后是否能够产生针对 M2蛋白胞外区的细胞免疫应答具有重要意义。为检测这种免疫应答,合成了 H5N1(A/Anhui/1/2005) M2蛋白全长胞外区 (M2e),并与M2(H5N1) 蛋白肽库 (11条多肽) 一起进行ELISPOT检测。结果显示,M2e以及M2蛋白肽库中的M2-2、M2-3和M2-6均可以较好地刺激M2HA免疫组脾淋巴细胞产生IFN-γ (图9),表明M2HA免疫组成功刺激出针对H5N1-M2蛋白的细胞免疫应答。通过在线表位预测工具对流感病毒 (A/Anhui/1/2005) M2蛋白的抗原表位进行分析,结果显示,该蛋白中存在2个抗原指数较高的抗原多肽,本实验中筛选出的M2e及 M2-2/3/6四条多肽均位于抗原性较强的位置,其序列对应预测的1号抗原多肽序列。M2e及M2-2/3/6四条多肽与预测的M2蛋白抗原多肽一致性比较见表2 (阴影部分为相应的一致性序列)。
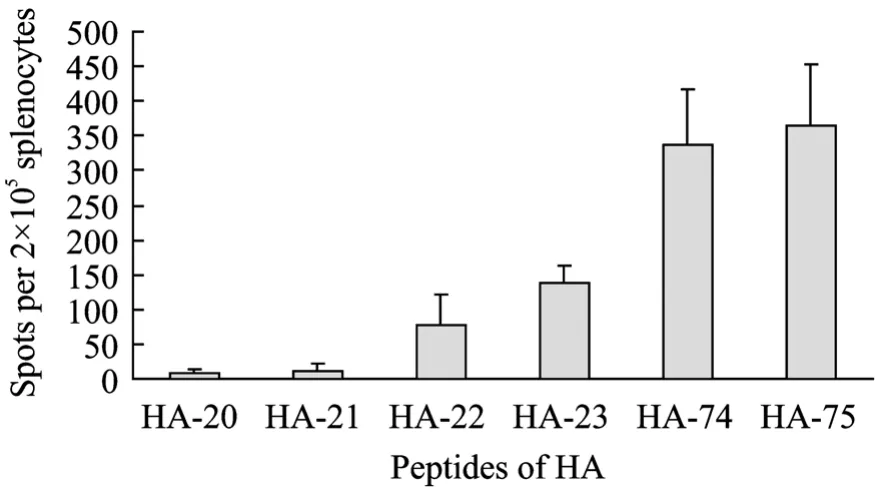
图7 ELISPOT检测HA多肽刺激能力Fig.7 Comparison of HA peptides for ELISPOT.

图8 不同免疫组ELISPOT比较Fig.8 Comparison of ELSPOT results among different groups.
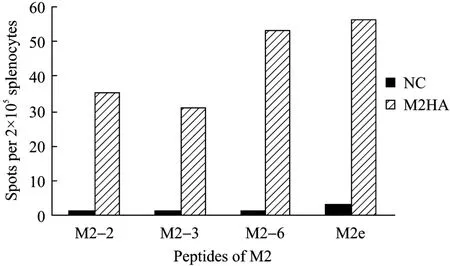
图9 M2多肽ELISPOT结果Fig.9 ELISPOT result of M2-Pep.
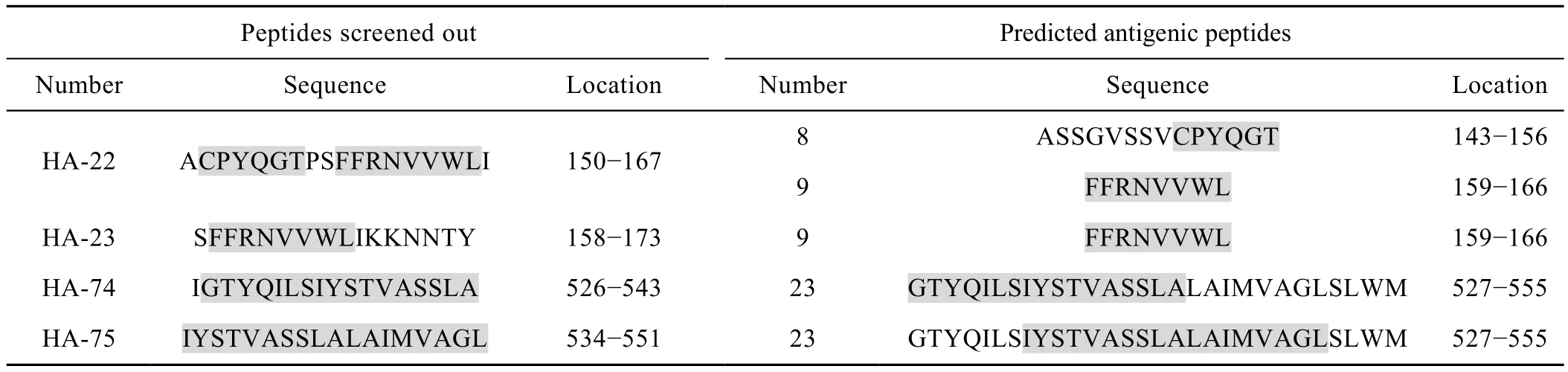
表1 HA-22/23/74/75四条多肽与预测的HA蛋白抗原多肽一致性比较Table 1 Comparability between HA-22/23/74/75 and predicted antigenic peptides

表2 M2e及多肽M2-2/3/6与预测的M2蛋白抗原多肽一致性比较Table 2 Comparability between M2e/M2-2/M2-3/M2-6 and predicted antigenic peptides
3 讨论
目前使用的流感灭活疫苗不能刺激产生细胞免疫应答,并且需要在鸡胚中传代,生产工艺复杂,无法及时生产足够的疫苗来应对新出现的毒株以阻止流感大流行[5]。所以寻求一种能更有效地预防流感病毒感染的新型疫苗迫在眉睫,而DNA疫苗和腺病毒载体疫苗就是其中比较有发展前景的流感疫苗策略。DNA疫苗和腺病毒载体疫苗作为新的疫苗策略,不需鸡胚传代,能够诱导体液免疫应答和细胞免疫应答,并且构建方法简单,性质稳定。它们带有的抗原成分在机体内合成,能进行正确的翻译后修饰和折叠,以天然构象的形式呈递给免疫系统。目前许多研究表明,采用 DNA疫苗与腺病毒载体疫苗联合免疫的方法,能诱导较强的免疫反应,并有助于减弱病毒载体所导致的非特异反应,增强由目的蛋白所诱导的特异性细胞免疫反应。因此本实验采用了 DNA疫苗与腺病毒载体疫苗联合免疫的方式。
本研究中应用的人5型腺病毒 (Ad5) 载体天然宿主是人,Ad5在人群中的感染率较高,预先存在的Ad5特异性抗体可能减弱免疫效果,如将来继续开展人用疫苗研究,就要充分考虑降低人体对于腺病毒载体本身的免疫反应。除了以DNA疫苗与腺病毒联合免疫的方式外,可以通过对腺病毒表面进行修饰,例如将聚乙二醇与腺病毒交联,以降低其免疫原性,延长在体内的存在时间。还可以选用无肠型腺病毒载体或微小腺病毒载体。研究表明,使用此类载体,可明显减少针对载体的中和抗体,增加其在体内的存在时间和目的基因表达量[6]。另外,采用非人型腺病毒作为疫苗载体也是一种有效的方法。Singh等[7]研究表明,采用牛腺病毒为载体构建的疫苗能够有效降低针对载体的中和抑制效应。
当前的流感疫苗主要是针对诱导产生中和抗体的表面糖蛋白HA和NA,由于HA和NA经常发生抗原转变和抗原漂移,使其抗原性表现出很大的变异,给流感防治带来极大的困难。与HA和NA不同,M2蛋白 (特别是胞外区) 氨基酸序列高度保守[8],并且有研究表明 M2蛋白抗血清具有抑制流感病毒复制的功能[9-10]。因此,M2分子有可能作为具有交叉保护能力的“通用流感疫苗”以解决HA、NA变异所导致的疫苗更换毒株问题。由于 HA是流感疫苗最重要的抗原成分,M2作为抗原对流感病毒具有一定的通用免疫保护作用,因此,进行M2与HA双基因共免疫,刺激宿主既产生针对 H5N1亚型流感病毒较强的保护作用,又能产生针对其他多种流感病毒的通用保护作用,具有重要意义。本研究结果显示,M2、HA双基因共免疫小鼠成功刺激出了针对中和抗原HA蛋白和通用抗原M2蛋白的免疫反应。并且,同HA单基因免疫组相比,M2、HA双基因共免疫组刺激产生的针对 HA蛋白的体液和细胞免疫应答水平没有减弱,这与预期相符。双基因共免疫时,不希望产生两种蛋白之间的相互干扰。实验中发现pStar-M2/HA中的HA基因插入到pStar-IRES下游其表达水平同HA单基因载体表达水平未有明显降低,使得在1、3次免疫DNA疫苗时的两免疫组的HA蛋白表达量基本相当,而M2基因的存在,并没有影响HA基因的免疫效果。本研究表明,相对于HA单基因免疫,能够同时表达中和抗原和通用抗原的双基因共免疫有可能提供更理想的免疫保护效果。流感病毒M2与HA双基因共免疫的研究,为研究开发新型重组流感疫苗奠定了基础。
REFERENCES
[1] Yu H, Shu Y, Hu S,et al.The first confirmed human case of avian influenza A (H5N1) in mainland China.Lancet,2006, 367(9504): 84.
[2] Holterman L, Vogels R, van der Vlugt R,et al.Novel replication-incompetent vector derived from adenovirus type 11 (Ad11) for vaccination and gene therapy: low seroprevalence and non-cross-reactivity with Ad5.J Virol,2004, 78(23): 13207−13215.
[3] Gao W, Soloff AC, Lu X,et al.Protection of mice and poultry from lethal H5N1 avian influenza virus through adenovirus-based immunization.J Virol, 2006, 80(4):1959−1964.
[4] Hoeslscher MA, Garg S, Bangari DS,et al.Development of adenoviral-vector-based pandemic influenza vaccine against antigenically distinct human H5N1 strains in mice.Lancet, 2006, 367(9509): 475−481.
[5] Fedson DS. Pandemic influenza and the global vaccine supply.Clin Infect Dis, 2003, 36(12): 1552−1561.
[6] Kochanek S, Schiedner G, Volpers C. High-capacity‘gutless’ adenoviral vectors.Curr Opin Mol Ther, 2001,3(5): 454−463.
[7] Singh N, Pandey A, Jayashankar L,et al.Bovine adenoviral vector-based H5N1 influenza vaccine overcomes exceptionally high levels of pre-existing immunity against human adenovirus.Mol Ther, 2008,16(5): 965−971.
[8] Ito T, Gorman OT, Kawaoka Y,et al.Evolutionary analysis of the influenza A virus M gene with comparison of the M1 and M2 proteins.J Virol, 1991, 65(10):5491−5498.
[9] Black RA, Rota PA, Gorodkova N,et al.Antibody response to the M2 protein of influenza A virus expressed in insect cells.J Gen Virol, 1993, 4(Pt1): 143−146.
[10] Treanor JJ, Tierney EL, Zebedee SL,et al.Passively transferred monoclonal antibody to the M2 protein inhibits influenza A virus replication in mice.J Virol, 1990, 64(3):1375−1377.
Immunological evaluation of vector-expressedM2andHAgenes of H5N1 influenza virus in mice
Jianqiang Guo1, Lihong Yao1, Aijun Chen1, Yi Xu1, Xiaoyu Liu1, Yuelong Shu2, and Zhiqing Zhang1
1State Key Laboratory for Molecular Virology and Genetic Engineering,Institute for Viral Disease Control and Prevention,Chinese Center for Disease Control and Prevention,Beijing100052,China
2Chinese Influenza Center,State Key Laboratory for Infectious Disease Prevention and Control,Institute for Viral Disease Control and Prevention,Chinese Center for Disease Control and Prevention,Beijing100052,China
Received:November 5, 2009;Accepted:March 21, 2010
Supported by:Major Special Science and Technology Project for Prevention and Treatment of AIDS and Viral Hepatitis and Other Major Infectious Diseases (No. 2009ZX10004-710).
Corresponding author:Zhiqing Zhang. Tel: +86-10-63519655; Fax: +86-10-63532053; E-mail: zhang_zq@hotmail.com
Yuelong Shu. Tel/Fax: +86-10-63577499; E-mail: yshu@vip.sina.com
“艾滋病和病毒性肝炎等重大传染病防治”科技重大专项 (No. 2009ZX10004-710) 资助。
