电融合法产生骆驼刺与鹰嘴紫云英属间体细胞杂种
2010-10-11张改娜贾敬芬孔祥生胥华伟
张改娜,贾敬芬,孔祥生,胥华伟
1 河南科技大学农学院,洛阳 471003
2 西北大学生命科学学院 陕西省生物技术重点实验室,西安 710069
农业生物技术
电融合法产生骆驼刺与鹰嘴紫云英属间体细胞杂种
张改娜1,2,贾敬芬2,孔祥生1,胥华伟1
1 河南科技大学农学院,洛阳 471003
2 西北大学生命科学学院 陕西省生物技术重点实验室,西安 710069
采用电融合法获得了骆驼刺和鹰嘴紫云英属间体细胞杂种。骆驼刺原生质体来自发根农杆菌A4转化系细胞,并经碘乙酰胺处理;鹰嘴紫云英原生质体从甲硫氨酸抗性系细胞分离。双亲及同源融合产物均不能在无激素的筛选培养基上持续分裂,融合后的杂种细胞由于双亲生理互补效应可恢复持续分裂能力而被筛选出来。本实验优化了电融合参数,如直流脉冲、交流脉冲和脉冲次数。融合产物经培养获得的杂种细胞系经形态学、染色体数目检查、生化及随机扩增多态性DNA分析,鉴定出10个杂种克隆,并从3个杂种克隆再生了小植株。
骆驼刺,鹰嘴紫云英,体细胞杂交
Abstract:We obtained intergenus somatic hybrid betweenAlhagi pseudalhagiandAstragalus cicerby using electroporation.Agrobacterium rhizogenesA4-transformedA. pseudalhagiprotoplasts were treated with iodoacetamide so that they were unable to sustain divisions.A. cicerprotoplasts were isolated from a methionine-resistant mutant and did not survive in the medium without plant growth regulator. The intergenus somatic hybrid cells were selected based on physiological complementation between the two parents. We optimized some parameters of electroporation, such as direct current impulse, alternating current impulse and the impulse number. We identified ten hybrid clones by morphological observation, checking the chromosome numbers, isoenzyme analysis and random amplified polymorphic DNA analysis, and obtained regenerated plantlets from three hybrid clones.
Keywords:Alhagi pseudal hagi,Astragalus cicerL., somatic hybridiation
通过原生质体融合和培养产生体细胞杂种是克服有性不亲和性、实现远缘遗传重组、转移多基因控制性状的可行途径。植物体细胞杂交是植物生物技术的重要组成部分。随着技术手段的不断改进,在植物种内、种间、属间甚至科间的原生质体融合都已成功。有一些优良的性状,特别是野生种的抗病[1]、抗旱[2]和胞质雄性不育[3]等性状已通过体细胞杂交成功地转移到栽培植物中。植物的抗逆性多为多基因控制,较之转基因技术,体细胞杂交在提高植物抗逆性方面有一定的优势。诱导原生质体融合常用化学方法和电融合方法。电融合是通过外电场交流脉冲收集细胞排列成串,然后施加直流高压脉冲造成细胞膜的可逆击穿,实现细胞融合,较之化学融合有操作简便、易于控制、副作用小、融合率高、应用范围广等特点。从20世纪80年代中期起,国外对动植物细胞电融合的方法和条件进行了大量研究[4-6]。本研究采用电融合法诱导骆驼刺Alhagi pseudoalhagiA4转化系 (简称ApA4) 和鹰嘴紫云英Astragalus cicer甲硫氨酸抗性系 (简称 Acmetr) 之间的原生质体融合。鹰嘴紫云英是多年生豆科牧草,也是一种蛋白质含量丰富、草质和适口性都极好的饲草作物,但缺乏含硫氨基酸[7]。动物毛发是由一种不溶的纤维状蛋白——α-角蛋白构成的,α-角蛋白含有丰富的含硫氨基酸——胱氨酸[8],所以饲料的营养成分中含硫氨基酸对动物毛发的产量和品质有较大的影响。本实验室已建立了含硫氨基酸含量较高的鹰嘴紫云英甲硫氨酸抗性系。骆驼刺是沙漠地区生长的半灌木豆科植物,具有很强的抗旱、抗风沙和固土能力,可作为土壤水资源的指示植物[9]。本研究欲通过原生质体融合技术建立这两种植物属间体细胞杂交的实验体系,探索开发利用沙漠植物遗传资源和将沙漠植物抗旱性状引入离体遗传操作的新途径。
1 材料和方法
1.1 骆驼刺原生质体来源
骆驼刺原生质体来自本实验室骆驼刺 A4转化系毛根诱导的愈伤组织,具有激素自主性。原生质体制备参考文献[10]。
1.2 鹰嘴紫云英原生质体来源
鹰嘴紫云英原生质体来自本实验室鹰嘴紫云英甲硫氨酸抗性系愈伤组织,不具备激素自主性。原生质体制备参考文献[11]。
1.3 骆驼刺原生质体的处理
在 4℃、黑暗条件下,分别用 1.0、2.0、5.0、10.0 mmol/L不同浓度的碘乙酰胺 (IOA,配于CPW9M[12]中) 处理ApA4原生质体10 min,之后离心收集原生质体,用 CaCl2洗涤液 (0.16 mmol/L CaCl2+0.1% MES,pH 5.8) 冲洗2次,并悬浮于其中备用。每个处理3个重复。
1.4 仪器
电融合仪 (德国 Eppendorf公司),融合室型号为4308 030.003和4308 014.008,电极间距为200 μm,电融合槽容量分别为0.2 mL和0.6 mL。
1.5 双亲原生质体融合条件的优化
电融合液为0.7 mol/L的甘露醇+0.25 mmol/L氯化钙+0.03%的MES,pH 5.8。将纯化的2种原生质体分别用电融合液洗涤 2遍,然后密度调至1.0×106个/mL、3×105个/mL、1.0×105个/mL 三个浓度,每个浓度等体积混合。吸取混合液均匀分布于电融合槽中,静置1 min,在125 V/cm的交流脉冲 (AC) 下选择队列时间。
在原生质体密度一定条件下,改变AC,观察原生质体的形状和形成串珠的长度,以确定最佳 AC和队列时间。
在密度、AC和队列时间最佳条件下,以脉冲次数为 2,观察原生质体融合频率,获得最佳直流脉冲 (DC) 和幅宽;并以其他参数在最佳条件下验证脉冲次数和甘露醇浓度对原生质体融合频率的影响。融合过程中用倒置显微镜 (型号:ECLIPSE TE2000-S) 观察和照相。每个处理重复3次。
用Acmetr原生质体和 IOA处理的有一定存活率,但不能持续分裂的ApA4原生质体的进行融合,分别单独培养双亲原生质体及混合原生质体作为对照。
1.6 杂种融合细胞的筛选和培养
Acmetr原生质体在无激素条件下不能分裂,ApA4原生质体经IOA处理,胞质失活不能分裂。双亲及同源融合产物均不能在无激素的筛选培养基上持续分裂而死亡,融合后杂种细胞由于生理互补恢复持续分裂能力而被筛选出来。
根据骆驼刺和鹰嘴紫云英原生质体培养的最佳条件,融合细胞培养采用附加有2.0 mg/L 2,4-D、0.2 mg/L 6-BA、500 mg/L水解乳蛋白、0.3 mol/L甘露醇和2%蔗糖的DPD液体培养基浅层培养。培养方法参考文献[13]。将在浅层培养基中形成的肉眼可见的小愈伤组织转入附加0.35%琼脂糖的DPD半固体选择培养基和附加有 0.65%琼脂粉的MS基本培养基中连续筛选。筛选出的杂种细胞扩增后放入附加有1 mg/L 6-BA、0.2 mg/L NAA的 MS固体培养基中分化。
1.7 再生愈伤组织的鉴定
1.7.1形态学、细胞学和同工酶分析
将融合再生愈伤组织的色泽、颗粒大小等与双亲愈伤组织进行比较,作为细胞杂种鉴定的参考。
挑取生长旺盛的双亲及融合细胞再生的愈伤组织进行低温预处理,压片法[14]制片,卡宝品红染色,Olympus BH-2型研究用显微镜观察记录。
取融合细胞再生愈伤组织及双亲愈伤组织做过氧化物酶同工酶分析,方法同文献[14]。
1.7.2RAPD分析
方法同文献[13]。
2 结果与分析
2.1 IOA预处理对骆驼刺原生质体存活和分裂的影响
IOA可以与磷酸甘油醛脱氢酶上的-SH发生不可逆的结合,通过抑制酶的活性,阻止 3-磷酸甘油醛氧化生成 3-磷酸甘油酸,抑制糖酵解途径,细胞由于得不到能量供应而停止分裂或死亡。只有当IOA处理的细胞与细胞质完整地细胞融合,代谢上得到互补,才能正常生长[15]。试验用1.0、2.0、5.0、10.0 mmol/L四种浓度IOA处理ApA410 min,表1显示,随处理浓度的增加,原生质体的存活率逐渐下降。培养3 d后,经10 mmol/L IOA处理的原生质体几乎无原生质体分裂,原生质体活力已经受到严重损伤。5.0 mmol/L IOA处理的原生质体存活率仅有 14.4%。且原生质体大多不能分裂,个别能分裂的原生质体最多能分裂 2~3次,继续培养不能形成细胞团。1.0、2.0 mmol/L两个不同浓度的IOA处理的原生质体30 d后部分形成肉眼可见的大细胞团。因此,以5.0 mmol/L的IOA处理10 min为原生质体预处理的适宜条件。

表1 不同浓度IOA对ApA4原生质体活力的影响Table 1 Effect of IOA on protoplast viability of ApA4
2.2 原生质体浓度对原生质体形成串珠的影响
试验发现电融合细胞队列时间与 2种原生质体混合浓度呈负相关。在相同 AC的条件下,浓度越高,需要的队列时间越短,否则,形成的细胞串较长,多元融合增加。在一定范围内,浓度偏低,细胞排队时间须延长,且融合频率下降。
由表2可以看出:浓度为1.0×106个/mL时,25 s原生质体串长就超过 4个,而浓度为1.0×105个/mL时,45 s原生质体串长只有少数形成2~4个;原生质体混合浓度为3.0×105个/mL,时间为45 s时,细胞串长多为2~4个,有利于产生2个细胞的异源融合体。以后的试验均在该浓度下进行。
2.3 电场因素对原生质体融合的影响
2.3.1AC对原生质体串珠形成的影响
不同 AC对原生质体形成串珠的长短有很大影响。实验表明,在 AC作用下,鹰嘴紫云英和骆驼刺的原生质体首先靠近并逐渐排队成串珠 (图1a),随着 AC的增大,原生质体形成串珠的时间缩短,而串珠的长度增长。但当电压过高时,原生质体往往严重变形,在施加直流脉冲后很容易发生破裂(表3)。125 V/cm时,原生质体队列时间最短,形成队列细胞数目合适且无变形,为合适的电融合交流电压。
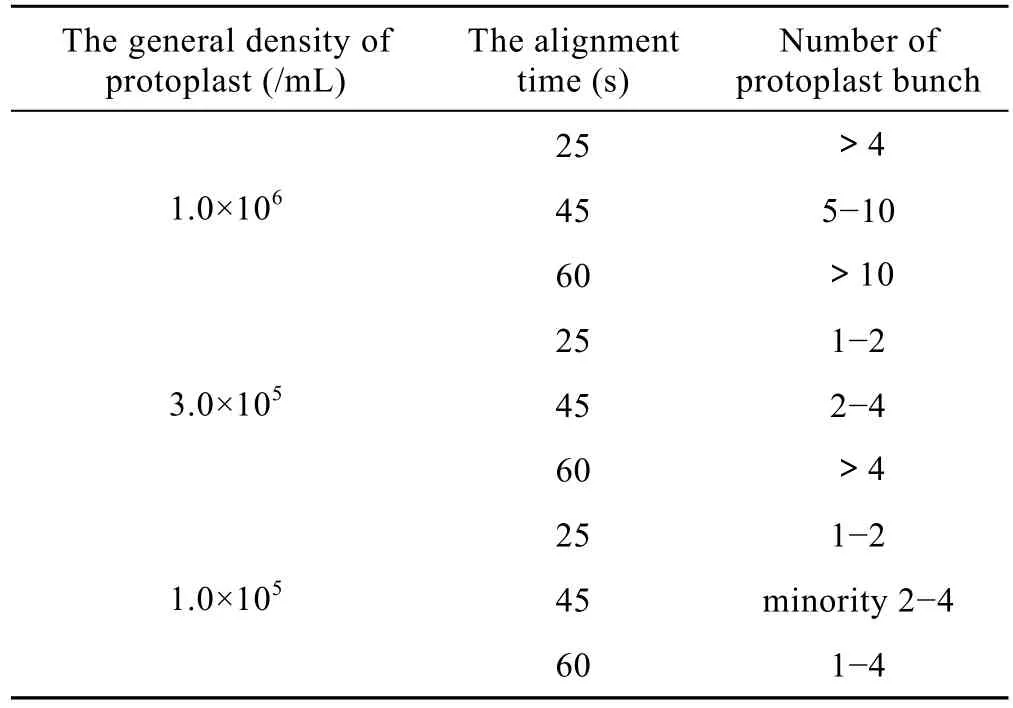
表2 原生质体混合浓度与细胞队列时间的关系Table 2 Relation between the general density of protoplast and the alignment time
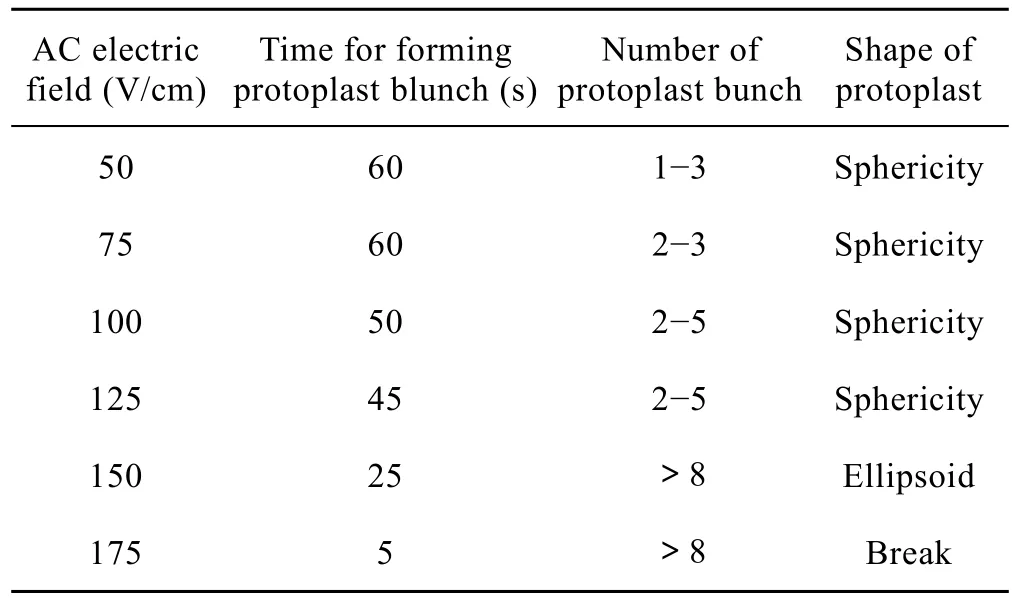
表3 不同交流脉冲对融合频率的影响Table 3 Effect of different alternating current impulse on fusion frequency
2.3.2直流脉冲对原生质体融合的影响
在保持AC为125 V/cm的条件下,不同的DC对鹰嘴紫云英和骆驼刺原生质体的融合有很大影响。图2a显示当DC在0.75~1.35 kV/cm时,原生质体融合频率随着 DC的增大而上升,最大融合频率为24.2%。在0.75 kV/cm以下时则很少发生融合,而高于 1.35 kV/cm时融合频率开始下降。这说明1.35 kV/cm的DC比较适合鹰嘴紫云英和骆驼刺原生质体的融合 (图1b)。同时也发现,2~5个原生质体的短串珠往往容易产生1对1的融合体,而长串珠往往形成多核融合体。
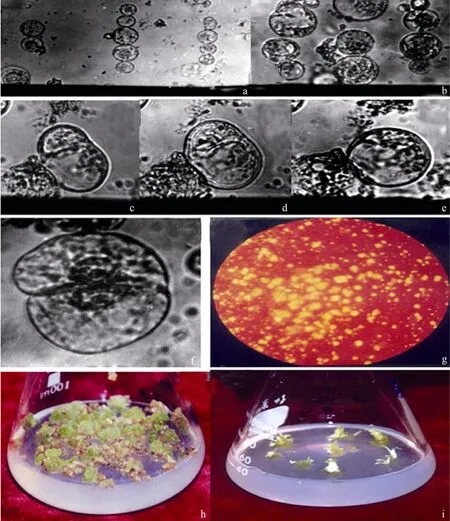
图1 原生质体电融合及培养与再生Fig.1 Electrofusion and culture and regeneration of protoplasts. (a, b) Protoplast bunchs in electric field. (c) Two cells beginning to fuse in direct current. (d) Two cells fusing when 1 minute after direct current. (e) A bigger protoplast after fusion. (f) First division of fusion cell. (g) Calli from fusion cell in liquid thin layer cultures. (h) Calli from fusion cell on selective medium. (i) Plantlets from selected somatic hybrid calli.
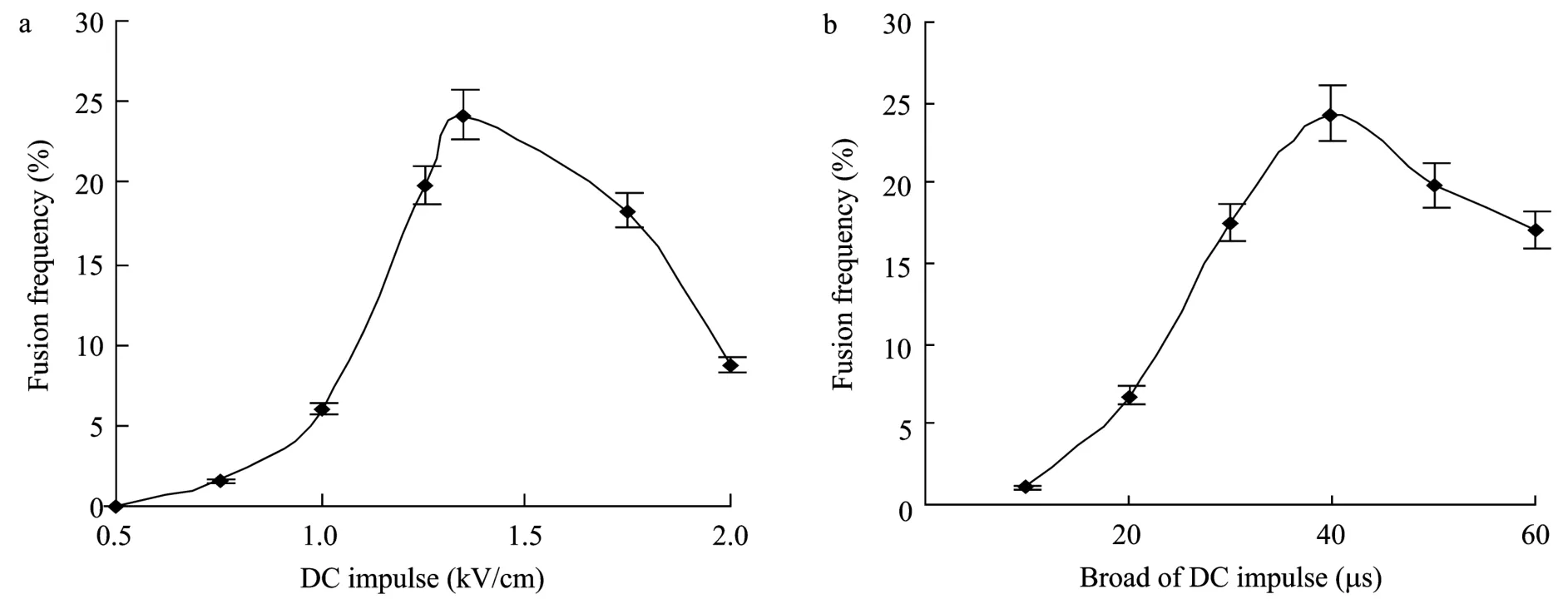
图2 直流脉冲 (a) 和直流脉冲幅宽 (b) 对电融合频率的影响Fig.2 Effect of different impulse (a) and broad (b) of DC on electrofusion frequency.
2.3.3直流脉冲幅宽对原生质体融合的影响
在最佳AC和DC条件下,比较不同的直流脉冲幅宽对原生质体融合的影响时发现 (图2b),随着脉冲幅宽的增加,鹰嘴紫云英和骆驼刺原生质体的融合频率逐渐提高,在脉冲幅宽为40 μs时,原生质体的融合频率最高,为24.3%。这与Chaput等[16-18]用电融合仪在相似的条件下获得的融合频率非常相近。但当脉冲幅宽超过50 μs时融合频率则明显下降。
2.3.4直流脉冲次数对原生质体融合的影响
在使用交流脉冲为 125 V/cm,直流脉冲为1.5 kV/cm,脉冲幅宽为 40 μs时,进行脉冲 1、2、3、4、5次处理,结果发现 (图3),直流脉冲2或3次的处理,鹰嘴紫云英和骆驼刺的原生质体融合频率较高。而脉冲次数在 4次以上的处理不仅不能促进融合,而且还会使已经形成的融合体破裂,从而使原生质体的融合频率明显下降。故本实验采用 2次直流脉冲次数对原生质体进行融合。
2.4 甘露醇浓度对原生质体融合的影响
在最适电融合参数处理的条件下,不同的甘露醇浓度对鹰嘴紫云英和骆驼刺原生质体融合也有一定影响 (图4)。在CaCl2浓度为0.25 mmol/L时,融合液的甘露醇浓度由0上升至0.7 mol/L时,原生质体融合频率明显上升,但当甘露醇浓度高于0.7 mol/L后,原生质体的融合频率开始下降,这说明较低的渗透压可能有利于鹰嘴紫云英和骆驼刺的原生质体融合。
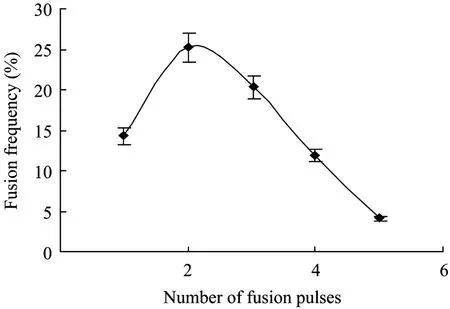
图3 脉冲次数对电融合频率的影响Fig.3 Effect of pulse number on protoplast electrofusion frequency.
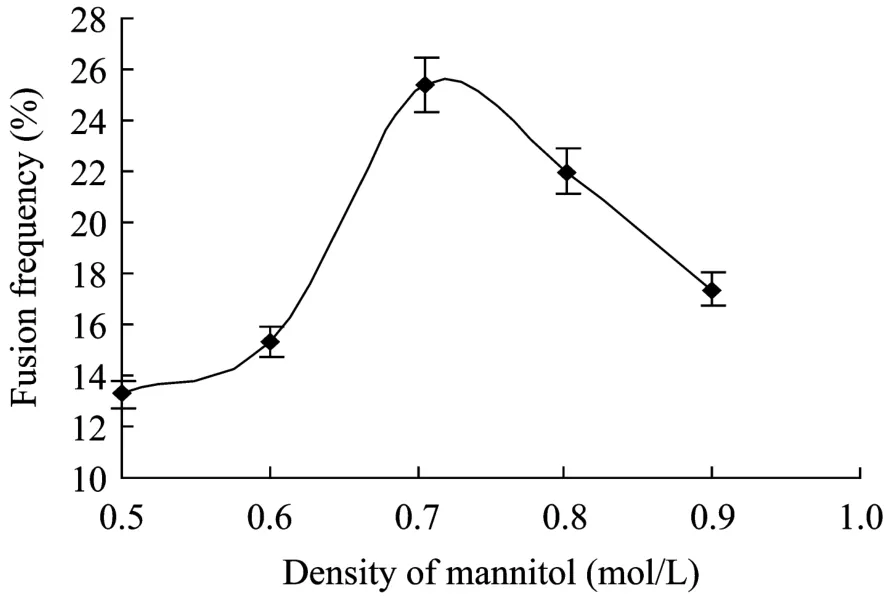
图4 甘露醇浓度对电融合频率的影响Fig.4 Effect of mannitol density on electrofusion frequency.
融合过程中观察到:2个或 2个以上呈圆球形的原生质体融合后体积变大,有 2个靠拢的细胞逐渐变为椭圆形,最后成为含有 2个细胞核的圆形细胞。整个过程在1.5 min内完成。融合后又恢复圆形的细胞要比未融合的原生质体体积显著增大 (图1c,d,e)。
2.5 融合细胞的培养和杂种的筛选及培养
实验中观察到,转至固体筛选培养基后,同源融合细胞和浅黄色的双亲愈伤组织均不再持续生长,绿色的杂种细胞却具有明显的生长优势,1周时间就能生成0.5 cm左右的绿色愈伤组织,明显区别于双亲。每块绿色的杂种愈伤组织来自于 1个克隆,经选择培养获得 10块愈伤组织 (图 1h),其中无性系S7、S9、S10已经再生小植株 (图1i)。
2.6 融合愈伤组织杂种性质的鉴定
2.6.1愈伤组织形态学、细胞学和同工酶分析
ApA4原生质体在成为肉眼可见的小愈伤组织时,为淡黄色胚状体,结构致密;Acmetr原生质体再生小愈伤组织则为淡黄色,结构疏松。融合细胞在选择培养基上直接生成浅绿色再生小愈伤组织。生长速度略快于两个亲本,显示杂种优势。
Acmetr(2n=48) 愈伤组织由于多次继代,染色体丢失,大多数染色体数目保持在 32~44条之间。ApA4(2n=18) 愈伤组织,由于发状根时染色体数目就有丢失[14],大多数保持在12~16条。融合再生愈伤组织的染色体数目接近双亲染色体数目之和(图 5)。
过氧化物酶酶谱分析表明:具有杂种形态学特征的10个克隆均具有双亲的部分或全部特征带,其中6个克隆还有新带型产生 (图6)。
2.6.2RAPD分析
用双亲总DNA作为模板,对12对随机引物进行筛选。取带型稳定、重复性好的S73(AAGCCGCG TC),用于体细胞杂种愈伤组织及其双亲再生愈伤组织的RAPD分析。结果如图7所示,杂种愈伤组织基本上含有双亲所有特征带。

图5 杂种及其双亲染色体Fig.5 Chromosome of somatic hybrid callus and their parents.1:Astragalus cicerL with 34 chromosome; 2: a hybrids with 44 chromosome; 3:Alhagi pseudalhagiwith 16 chromosome.
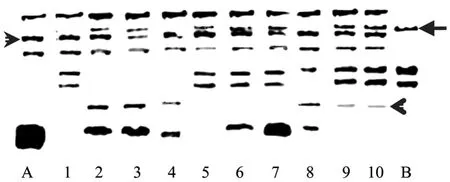
图6 双亲及其杂种过氧化物酶谱分析Fig.6 Analysis of profiles of peroxidases of hybrids and parent calli. A:Alhagi pseudalhagi; 1–10: hybrid clones; B:Astragalus cicerL. character strip ofAstragalus cicerL;character strip ofAlhagi pseudalhagi; new strip.
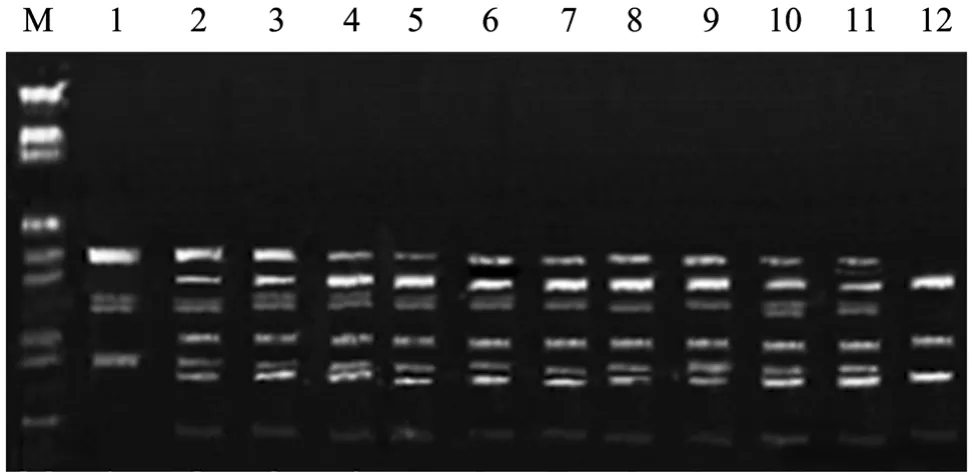
图7 双亲及其杂种的随机扩增多态性分析Fig.7 Analysis of RAPD of hybrids and parent calli. M:λDNA/Hind Ⅲ+EcoR Ⅰ DNA marker; 1:Alhagi pseudalhagi;2–11: hybrid clones; 12:Astragalus cicerL.
3 讨论
通常涉及到豆科牧草的体细胞杂交都是采用PEG融合法,尽管这一方法是有效的,但电融合可以获得更高的融合频率[19-20]。本研究利用适宜的电融合参数获得的总融合频率为 25%左右,这一结果与以前报道的电融合率在20%~35%之间是一致的[21]。电融合参数的优化依赖于以下几个因素:用以融合的亲本原生质体的大小与来源[22];脉冲电场强度和脉冲次数,在许多研究中,脉冲电场强度的应用范围从0.5到2.1 kV/cm,脉冲次数为1~4次[23],也与本研究结果一致。
高的异源融合频率对于不易检出的异核体尤为重要。本研究中 2个亲本来源的原生质体形态非常相似,用肉眼直接鉴定几乎不可能。如果不能将杂种细胞挑选出来,就需要培养大量的非杂种愈伤组织和再生植株。在原生质体融合的早期,已经发展了一些筛选方法,包括荧光活性染色检出法、抗生素抑制法、生理互补法等。Brewer等[24]发现Thlaspicaerulescens和Brassica napus的杂种细胞具有较强的贴壁生长的物理性质,从而区别于双亲。本实验采用IOA预处理使ApA4细胞质失活,不能进行分裂,而另一亲本不能在无激素培养基上生长,融合细胞利用生理互补的方法在无激素培养基中进行筛选。
用未经电融合的双亲混合培养作对照,发现电融合并不影响原生质体的活力,FDA染色[25]结果表明融合的原生质体超过80%是有活性的。融合细胞要经过一段时间,大约4 d,才开始生出新壁,变为椭圆形,进入分裂期。一旦进入一次分裂 (图1f),很快经过多次连续分裂逐步形成多细胞团 (图1g)。到第8天,在DPD培养基中约有10%的原生质体分裂。
本研究首次在沙漠豆科植物与豆科牧草间采用电融合的方法进行原生质体融合,经杂种细胞的筛选、培养获得了鹰嘴紫云英和骆驼刺属间体细胞杂种愈伤组织和再生小植株。对杂种再生愈伤组织进行形态学、染色体观察、同工酶和RAPD分析,均显示杂种含有双亲染色体。该实验体系的建立,将有利于探索开发利用沙漠植物遗传资源,使沙漠植物抗旱性状通过体细胞杂交转移到其他植物中成为可能。
REFERENCES
[1] Gavrilenko TA, Barbakar NI, Pavlov AV. Somatic hybridization betweenLycopersicon esculentumand non-tuberousSolanumspecies of theEtuberosa series.Plant Sci, 1992, 86: 203−214.
[2] Begum F, Paul S, Bag N. Somatic hybrids betweenBrassica juncea(L.) czern andDiplotaxis harra(forsk)boiss and the generation of backcross progenies.Theor Appl Genet, 1995, 91: 1167−1172.
[3] Kofer W, Glimelius K, Bonnett HT. Fsion of male sterile tobacco causes modifications of mtDNA leading to changes in floral morphology and restoration of fertility in cybrid plants.Physiol Plantarum,1992, 85: 334−338.
[4] Zimmermann U. Electric field-mediated fusion and related electrical phenomena.Biochim Biophys Acta, 1982, 694:227−277.
[5] Bates GW, Gaynor JJ. Fusion of plant protoplasts by electric fields.Plant Physiol, 1983, 72: 1110−1113.
[6] Gilmour DM, Davey MR, Cocking EC. Production of somatic hybrid tissues following chemical and electrical fusion of protoplasts from albino cell suspensions ofMedicago sativaandM. borealis.Plant Cell Rep, 1989, 8:29−32.
[7] Lu DR, Wang JH. Eximious Legume forage ——Astragalus cicerL..Pasture Forage, 1988, 2: 36−38.
卢得仁, 王建华. 优良豆科牧草——鹰嘴紫云英. 牧草与饲料, 1988, 2: 36−38.
[8] Sun JS, Chen WL. Plant biology Technique and Crop Improvement. Beijing: Science and Technology Press,1990: 71−82.
孙敬三, 陈维伦. 植物生物技术和作物改良. 北京: 中国科学技术出版社, 1990: 71−82.
[9] Dong ZG, Zhang SJ. The economic value and utilization ofAlhagi pseudalhagiin arid desert region.Grassland China, 2000, 4: 73−75.
董志国, 张苏江. 干旱荒漠区骆驼刺的经济价值及其利用. 中国草地, 2000, 4: 73−75.
[10] Zhang GN, Jia JF. Protoplast culture and plantlet regeneration fromAgrobacterium rhizogenesA4-transformed cell line ofAlhagi pseudalhagi.Plant Physiol Commun,2009, 45(4): 1−5.
张改娜, 贾敬芬. 骆驼刺发根农杆菌转化系的原生质体培养和植株再生. 植物生理学通讯, 2009, 45(4): 1−5.
[11] Zhang GN, Wang YH, Wang XR,et al. Protoplast culture and plant regeneration of the methionine resistant variant ofAstragalus cicerL..J Mol Cell Biol, 2006, 39(3):191−197.
张改娜, 王瑛华, 王学仁, 等. 鹰嘴紫云英甲硫氨酸抗性系原生质体培养及植株再生. 分子细胞生物学报,2006, 39(3): 191−197.
[12] Nagata J, Takebe I. Cell wall regeneration and cell division in isolated tabacco mesophyll protoplast.Planta,1970, 92: 301−308.
[13] Zhang GN, Jia JF. Interfamilial somatic hybridization betweenAstragalus molilotoidespall andZygophyllum xanthoxylum.Chin Bull Bot, 2009, 44(4): 442−450.
张改娜, 贾敬芬. 草木樨状黄芪和木本霸王的科间体细胞杂交. 植物学报, 2009, 44(4): 442−450.
[14] Zhang GN, Jia JF, Hao JG,et al. Cytological observation and analysis of isoenzyme patterns in three types of hairy roots transformed byAgrobacterium rhizogenesA4.Acta Bot Boreali-Occidental Sin, 2003, 23(9): 1533−1538.
张改娜, 贾敬芬, 郝建国, 等. 三种发根农杆菌 A4转化系毛根的细胞学观察及同工酶酶谱分析. 西北植物学报, 2003, 23(9): 1533−1538.
[15] Nenz E, Pupilli F, Daniani F,et al. Somatic hybrid plants between the forage legumeMedicago sativaL. andMedicago arboreaL..TheorAppl Genet, 1996, 93:183−189.
[16] Chaput MH, Sihachakr D, Ducreux G,et al. Somatic hybrid plants produced by electrofusion between dihaploid potatoes: BF15 (H1), Aminca (H6) and Cardimal (H3).Plant Cell Rep, 1990, 9: 411−414
[17] Jadari R, Sihachakr D, Rossignol L,et al. Transfer of resistance toVerticillium dahliaeKleb. fromSolanum torvumSW into potato (solanum tuberosumL.) by protoplast electeofusion.Euphytica, 1992, 64: 39−47.
[18] Serraf I, Sihachakr D, Ducreux G,et al.Interspecific somatic hybridization in potato by protoplast electrofusion.Plant Sci, 1991, 76: 115−126.
[19] Bates WG. Electrical fusion for optimal formation of protoplast heterokaryons inNicotiana.Planta, 1985, 165:217−224.
[20] Saunders JA, Matthews BF, Miller PD. Plant gene transferusing electrofusion and electroporation//Neumamm E, Sowers AE, Jordan CA, eds. Electroporation and Electrofusion in Cell Biology. New York: Plenum Press,1989: 343−354.
[21] Kohn H, Schieder R, Schieder O. Somatic hybrids in tobacco mediated by electrofusion.Plant Sci, 1985, 38:121−128.
[22] Tempelaar MJ, Jones MGK. Fusion characteristics of plant protoplasts in electric fields.Planta, 1985, 165: 205−216.
[23] Chang DC, Chassy BM, Saunders JA,et al. Guide to Electroporation and Elecrofusion. Library of Congress #GH585. 5E48H36. San Diego: Academic Press, 1992:1−581.
[24] Brewer EP, Asaunders J. Somatic hybridization between the zinc accumulatorThlaspi caerulescensandBrassica napus.Theor Appl Genet, 1999, 99: 761−771.
[25] Widholm JM. The use of fluorescein diacetate and phenosafranin for determining the viability of cultured cells.Stain Technol, 1972, 47: 189−194.
Intergenus somatic hybridization betweenAlhagi pseudalhagiandAstragalus cicerby electroporation
Gaina Zhang1,2, Jingfen Jia2, Xiangsheng Kong1, and Huawei Xu1
1College of Agriculture,Henan University of Science and Technology,Luoyang471003,China
2Shaanxi Provincial Key Laboratory of Biotechnology,School of Life Science,Northwest University,Xi’an710069,China
Received:October 27, 2009;Accepted:March 17, 2010
Corresponding author:Gaina Zhang. Tel: +86-379-64282340; E-mail: zgnluck1@163.com
