根癌农杆菌介导的增强型绿色荧光蛋白基因在淡紫拟青霉中的转化
2010-10-11王阶平汪家旭刘凡潘沧桑
王阶平,汪家旭,刘凡,潘沧桑
厦门大学生命科学学院,厦门 361005
农业生物技术
根癌农杆菌介导的增强型绿色荧光蛋白基因在淡紫拟青霉中的转化
王阶平,汪家旭,刘凡,潘沧桑
厦门大学生命科学学院,厦门 361005
为了实现增强型绿色荧光蛋白基因 (egfp) 在生防真菌淡紫拟青霉 9410菌株中的转化,借助中间质粒pcDNA3.1(-) 构建nptⅡ-egfp融合基因的表达载体pUPNGT,然后采用根癌农杆菌介导的转化法将egfp基因转化到淡紫拟青霉9410菌株中。PCR检测和Southern blotting分析结果表明,egfp基因以单拷贝形式整合到淡紫拟青霉9410的基因组中。荧光显微镜观察结果显示,转化子在488 nm光源的激发下能产生绿色荧光。这些结果说明egfp基因已成功转化至淡紫拟青霉 9410菌株并获得表达。这些工作可为淡紫拟青霉在不同条件下的防效评价、环境安全评价等提供新的途径和方法。
淡紫拟青霉,增强型绿色荧光蛋白,根癌农杆菌,遗传转化
Abstract:The main aim of this study was to transform the enhanced green fluorescent protein gene (egfp) into biocontrol fungusPaecilomyces lilacinusstrain 9410. We constructed the expression vector pUPNGT of the fusion genenptII-egfpusing pcDNA3.1(-)as a helper plasmid. Theegfpgene was then transformed intoP. lilacinusstrain 9410 viaAgrobacterium tumefaciens-mediated transformation. PCR and Southern blotting analysis showed that theegfpgene was integrated into the genomes of the tested transformants and the integration manner was single-copy. The transformants could generate green fluorescence when they were excited by 488 nm blue laser. These results indicated that theegfpgene had been successfully transformed intoP. lilacinus9410 and expressed in the tested transformants. Our work may provide a new approach to assess environmental safety and practical biocontrol efficacy ofP. lilacinusunder different conditions.
Keywords:Paecilomyces lilacinus, enhanced green fluorescent protein,Agrobacterium tumefaciens, genetic transformation
淡紫拟青霉Paecilomyces lilacinus(Thom.)Samson 1974是一种土壤及多种植物根际的习居菌,在全球广泛分布。现已认为它是最有前途的植物病原线虫的生防真菌之一,全球已有60多个国家开展了应用淡紫拟青霉防治根结线虫Meloidogynespp.、胞囊线虫Heteroderaspp.等植物病原线虫的研究,并已开始付诸实践[1-3]。同时,淡紫拟青霉对有害昆虫[4]、动物寄生虫[5]、植物病原菌[6]等也有一定的防控效果。但在淡紫拟青霉的遗传背景及其控害的作用机制等方面,至今仍了解甚少。丝状真菌遗传转化系统的建立,为人们从分子水平了解丝状真菌的遗传背景和进一步的菌株改造提供了强有力的工具。
根癌农杆菌介导的转化法 (Agrobacterium tumefaciens-mediated transformation,ATMT) 具有易操作、转化受体多样化、转化效率高、转化子稳定、T-DNA在真菌基因组中以单拷贝插入为主等优点。自1998年de Groot等[7]首次将ATMT法应用于丝状真菌的遗传转化以来,已有大量的丝状真菌通过ATMT法成功实现了遗传转化[8-10]。本研究以G418抗性基因为筛选标记,采用ATMT法将增强型绿色荧光蛋白基因 (Enhanced green fluorescent protein,egfp)[11]整合到生防真菌淡紫拟青霉 9410菌株的基因组中,实现淡紫拟青霉9410的egfp标记,为其在防效评价、生态学跟踪研究和环境安全评价等方面的应用奠定基础。
1 材料与方法
1.1 菌株与质粒
淡紫拟青霉P. Lilacinus9410菌株,大肠杆菌Escherichia coliDH5α 菌 株 , pcDNA3.1(-)和pcDNA3.1-egfp质粒由厦门大学生命科学学院寄生动物研究室保存;根癌农杆菌A. tumefaciensEHA105菌株由厦门大学生命科学学院陈亮教授提供;真菌表达载体 pUR5750由 RE Cardoza博士(University of León,Spain) 提供。
1.2 含有egfp基因的二元载体的构建
首先按图1的流程,经过PCR扩增、酶切、连接和序列分析等步骤分别将来自构巢曲霉Aspergrillusnidulans的甘油醛-3-磷酸脱氢酶启动子 PgpdA、G418抗性基因nptⅡ+弹性连接肽 (Linker)、egfp基因和来自构巢曲霉A. nidulans的色氨酸合成酶C基因的转录终止子 TtrpC 4个片段插入到中间质粒pcDNA3.1(-)中,构建成nptⅡ-egfp融合基因的表达DNA序列组件PgpdA-NPTL-egfp-TtrpC;然后,经酶切、连接步骤将该表达DNA序列组件插入到真菌表达载体 pUR5750中,构建成二元载体 pUR5750-PgpdA-NPTL-egfp-TtrpC,命名为pUPNGT。

图1 构建nptII-egfp融合基因的表达DNA序列组件的流程图Fig.1 Construction flow chart of the expression DNA cassette of the fusion genenptII-egfp.
1.3 淡紫拟青霉分生孢子的准备
用无菌蒸馏水从培养7~10 d的PDA平板上洗下淡紫拟青霉的分生孢子,离心后用MM液体培养基重悬,血球计数板计数,然后用MM液体培养基将孢子浓度调整为108个/mL。
1.4 根癌农杆菌的活化培养
表达载体 pUPNGT采用液氮冻融法直接转化到根癌农杆菌EHA105菌株中。从含50 μg/mL卡那霉素的LB平板上挑取农杆菌单菌落,接种于3 mL LB液体培养基 (含 50 μg/mL卡那霉素),28℃、220 r/min振荡培养过夜。第2天用诱导培养基 (含50 μg/mL 卡那霉素、40 mmol/L MES (pH 5.3)、0.5% 甘油 (W/V)、200 μmol/L乙酰丁香酮的 MM液体培养基) 稀释至OD600大约 0.15,继续培养至OD600为 0.6~0.8。
1.5 淡紫拟青霉的转化
取已活化好的根癌农杆菌EHA105菌液和制备好的淡紫拟青霉分生孢子悬液各 100 µL,加入到1.5 mL EP管中,离心后用200 µL诱导培养基重悬,采用液相静置方式置于28℃培养箱中进行共培养,48 h后将共培养物涂布在含 300 μg/mL G418和300 μg/mL头孢霉素的PDA平板上进行转化子筛选。
1.6 淡紫拟青霉转化子的PCR检测
淡紫拟青霉原始菌株和转化子的基因组 DNA的提取按文献[12]的方法和步骤进行。以基因组DNA为模板,用扩增egfp基因的引物eGFPF: 5′-AT AAGAATGCGGCCGCATGGTGAGCAAGGGCGAG-3′和 eGFPR: 5′-CCGGAATTCTTACTTGTACAGCT CGTC-3′对eGFP转化子进行PCR检测。
1.7 淡紫拟青霉转化子的Southern blotting分析
选择质粒pUPNGT上无酶切位点的内切酶对基因组DNA进行酶切,以质粒pUPNGT的NotI和EcoR I的酶切片段 (egfp) 为模板制备探针。标记、杂交及检测的方法和步骤参照试剂盒上 (DIG High Prime DNA Labeling and Detection Starter KitⅡ,购自上海华舜公司) 提供的方法进行。
1.8 淡紫拟青霉转化子的荧光显微镜观察
在洁净的载玻片中央滴加无菌水,分别从PDA平板上挑取转化子菌丝体于水滴中,用解剖针分散菌丝体,盖上盖玻片。于荧光显微镜下观察转化子的egfp基因的表达情况,并拍照记录。
2 结果
2.1egfp基因表达载体pUPNGT的构建
按图1的流程,分别将启动子PgpdA、筛选标记基因nptII+Linker (即NPTL)、egfp基因和转录终止子TtrpC 这4个片段,依次插入到中间质粒中,构建成重组质粒 pcDNA3.1(-)-PgpdA-NPTL-egfp-TtrpC。然后,用XbaI和Hind III将PgpdA-NPTL-egfp-TtrpC片段切下,插入到真菌表达载体pUR5750的相应位点,得到了表达载体 pUR5750-PgpdANPTL-egfp-TtrpC,命名为pUPNGT。
2.2 淡紫拟青霉转化子的获得与初步鉴定
含载体 pUPNGT的农杆菌和淡紫拟青霉的分生孢子在诱导培养基中液相静置共培养48 h,经适当稀释后涂布在含300 μg/mL G418和300 μg/mL头孢霉素的PDA平板上,培养5 d左右即有G418抗性菌落出现,随机挑取 G418抗性菌落转接至含有400 μg/mL G418的PDA平板,这些菌落都可以正常生长。据此初步认定这些抗性菌落为转化子。结合几次转化结果,本研究对淡紫拟青霉9410的转化率为140~156个转化子/106个孢子。
2.3 转化子的PCR和Southern blotting分析
从抗性平板 (含400 μg/mL G418) 上随机挑取10个转化子,提取基因组DNA后,用扩增egfp基因的引物eGFPF和eGFPR对转化子进行PCR检测。结果表明,10个转化子在约750 bp处均有一条特异的扩增条带,PCR反应均为阳性,而原始菌株的PCR反应则为阴性 (数据未显示)。这些结果提示,egfp基因已成功整合到各转化子的基因组中。
淡紫拟青霉1、4、18、19号转化子和原始菌株(阴性对照) 的基因组 DNA分别用SpeI进行单酶切,该酶切位点位于T-DNA外侧,质粒pUPNGT (阳性对照) 用Hind III进行单酶切,按照试剂盒的方法进行egfp基因的Southern杂交和检测。结果表明egfp基因已经整合到淡紫拟青霉基因组中,而且都是以单拷贝的方式整合 (图2)。
2.4 淡紫拟青霉转化子的荧光显微镜观察
为了检测淡紫拟青霉转化子的egfp基因的表达情况,利用荧光显微镜观察各转化子的菌丝体在488 nm蓝色激光光源的激发下能否产生绿色荧光。图3所示的是1、4和18号3个转化子的菌丝体在蓝色激光激发下的形态,转化子eGFP1、4和18在488 nm蓝色激光的激发下均发出了绿色荧光。结果表明,egfp基因在转化子中得到了表达。
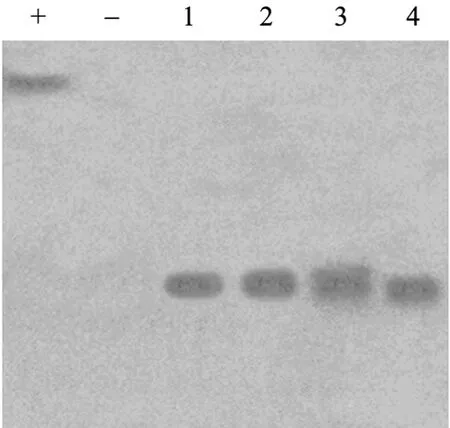
图2 淡紫拟青霉转化子的Southern blotting分析Fig.2 Southern blotting analysis of transformants ofPaecilomyces lilacinus. +: positive control (plasmid pUPNGT);−: negative control (genomic DNA ofP. lilacinus9410 original strain); 1–4: genomic DNA of transformant 1,4,18 and 19,respectively.

图3 淡紫拟青霉转化子的荧光显微镜观察 (200×)Fig.3 Observations of transformants ofPaecilomyces lilacinususing fluorescent microscope (200×).
2.5 淡紫拟青霉转化子的遗传稳定性
将淡紫拟青霉转化子接种到不含抗生素 G418的PDA平板上连续传代5次,每代培养时间均为5 d,然后再接种到含有400 μg/mL G418的PDA平板,培养7 d。结果表明,淡紫拟青霉转化子在没有抗生素的压力下连续传代 5次后,仍保持了抗高浓度G418 (400 μg/mL) 的能力,而且转化子仍能产生绿色荧光 (数据未显示),提示淡紫拟青霉菌转化子的G418抗性和egfp基因能稳定遗传。
3 讨论
遗传转化通常是稀有事件,因此,从大量未转化细胞的背景中筛选转化子有赖于可供选择转化子的遗传标记。潮霉素 (HygB) 已广泛应用于丝状真菌的遗传转化。但淡紫拟青霉9410菌株对HygB具有高度的抗性,因此 HygB不能用来筛选该菌株的转化子。后来,我们发现该菌株对新霉素类抗生素G418较为敏感,可用于转化子的筛选。文献资料也表明,G418及其抗性基因nptII已在酵母[13]、须癣毛癣菌Trichophyton mentagrophytes[14]等真菌的遗传转化中得到应用。本室以G418和nptII基因分别为筛选抗生素和筛选标记,已成功建立了农杆菌介导的淡紫拟青霉9410的遗传转化体系。
绿色荧光蛋白 (GFP) 是一类存在于水母、水螅等腔肠动物体内的非常稳定的生物发光蛋白质。GFP能在细菌、蓝细菌、酵母、植物、真菌、线虫、哺乳动物等多种异源细胞中表达,这一特性使其成为广泛应用的荧光标记分子,已在分子医学、细胞学、分子生物学、病毒学和微生物分子生态学等领域得到广泛应用。尽管GFP已对许多真菌成功实现了标记[15],但对植物病原线虫的生防真菌淡紫拟青霉的遗传标记国内外尚未见报道。本研究采用根癌农杆菌介导的转化法 (ATMT),成功实现了增强型绿色荧光蛋白基因egfp对淡紫拟青霉9410的遗传转化。经实验证实egfp基因以单拷贝的方式整合到淡紫拟青霉9410基因组中,egfp基因能稳定遗传,且淡紫拟青霉转化子在 488 nm蓝色激光的激发下均能发出绿色荧光。
淡紫拟青霉虽已在全球得到广泛的研究并已付诸实践[1-2],但淡紫拟青霉菌剂作为以活菌的形式发挥生防功能的生防制剂,往往存在防效不稳定的问题,可能随着土壤环境、施用方法、耕作方式、灌溉方式等的不同,其防效可能出现较大差异[16]。要解决这些问题,就必须研究在不同土壤、温度 (季节)、不同作物栽培方式 (如聚乙烯薄膜覆盖与露土、滴灌施肥等) 等条件下,淡紫拟青霉在植物根际的定殖能力、发生、发展等情况。由于植物根际有着复杂的微生态系统,在研究目标菌株与植物及其他根际微生物相互作用的过程中,如何将它们与根际其他土著微生物区分开来显得特别重要,GFP分子标记及其荧光检测技术的应用为这项工作提供了一个简便、灵敏和可靠的方法。本研究所进行的工作可为淡紫拟青霉在不同条件下的防效评价、生态学跟踪研究和环境安全评价等提供新的途径和方法。
REFERENCES
[1] Pan CS. R&D ofPaecilomyces lilacinus.Fine Spec Chem,2003, 6: 15−17.
潘沧桑. 淡紫拟青霉菌剂的研究开发. 精细与专用化学品, 2003, 6: 15−17.
[2] Kiewnick S, Sikora RA. Biological control of the root-knot nematodeMeloidogyne incognitabyPaecilomyces lilacinusstrain 251.Biol Control, 2006, 38: 179−187.
[3] Khan MR, Goswami BK. Evaluation ofPaecilomyces lilacinusisolate 6 againstMeloidogyne incognitainfecting tomato.Int J Nematol, 2002, 12(1): 111−114.
[4] Xie QM, Liang GW, Lu YY. Field efficiency ofPaecilomyces lilacinusagainst litchi stink bugTessaratoma papillosaDrury.Wuyi Sci J, 2002, 18: 143−145.
谢钦铭, 梁广文, 陆永跃. 淡紫拟青霉对荔枝蝽象的田间防治试验. 武夷科学, 2002, 18: 143−145.
[5] Ciarmela ML, Thevenet PS, Alvarez HM,et al. Effect ofPaecilomyces lilacinuson the viability of oncospheres ofTaenia hydatigena.Vet Parasitol, 2005, 131(1/2): 61−64.
[6] Add-EL-Moity H, Riad FW, EL-Eraki S. Effect of single and mixture of antagonistic fungi on the control of root knot nematodeMeloidogyne incognita.Egypt J Agr Res,1993, 71(1): 91−101.
[7] de Groot MJ, Bundock P, Hooykaas PJJ,et al.Agrobacterium tumefaciensmediated transformation of filamentous fungi.Nat Biotechnol, 1998, 16(9): 839−842.
[8] Weld RJ, Eady CC, Ridgway HJ.Agrobacteriummediated transformation ofSclerotinia sclerotiorum.J Microbiol Methods, 2006, 65(1): 202−207.
[9] Klimes A, Neumann MJ, Grant SJ,et al. Characterization of the glyoxalase I gene from the vascular wilt fungusVerticillium dahliae.Can J Microbiol, 2006, 52(9): 816−822.
[10] Maruthachalam K, Nair V, Rho HS,et al.Agrobacterium tumefaciens-mediated transformation inColletotrichumfalcatumandC. acutatum.J Microbiol Biotechnol, 2008,18(2): 234−241.
[11] Cormack BP, Valdivia RH, Falkow S. FACS-optimized mutants of the green fluorescent protein (GFP).Gene,1996, 173(1): 33−38.
[12] Russo P, Juuti JT, Raudaskoski M. Cloning, sequence and expression of a β-tublin-encoding gene in the homobasidiomyceteSchizophyllum commune.Gene, 1992,119: 175−182.
[13] Guerra OG, Rubio IG, da Silva Filho CG,et al. A novel system of genetic transformation allows multiple integrations of a desired gene inSaccharomyces cerevisiaechromosomes.J Microbiol Methods, 2006, 67(3):437−445.
[14] Yamada T, Makimura K, Hisajima T,et al. Genetic transformation of the dermatophyte,Trichophyton mentagrophytes, based on the use of G418 resistance as a dominant selectable marker.J Dermatol Sci, 2008, 49(1):53−61.
[15] Spellig T, Bottin A, Kahmann R. Green fluorescent protein(GFP) as a new vital marker in the phytopathogenic fungusUstilago maydis.Mol Gen Genet, 1996, 252(5):503−509.
[16] Kiewnick S, Sikora RA. Optimizing the efficacy ofPaecilomyces lilacinus(strain 251) for the control of root-knot nematodes.Commun Agric Appl Biol Sci, 2004,69(3): 373−380.
Transformation of enhanced green fluorescent protein gene inPaecilomyces lilacinusmediated byAgrobacterium tumefaciens
Jieping Wang, Jiaxu Wang, Fan Liu, and Cangsang Pan
School of Life Science,Xiamen University,Xiamen361005,China
Received:October 26, 2009;Accepted:March 16, 2010
Supported by:Key Program of Fujian Province (No. 2008N01050731).
Corresponding author:Cangsang Pan. Tel: +86-592-2186812; Fax: +86-592-6889168; E-mail: cspan@xmu.edu.cn
福建省重点项目 (No. 2008N01050731) 资助。
