山羊克隆胎儿不同组织中H19基因CpG岛甲基化模式及表达量检测
2010-10-11李长雷郑聪颖刘军兰杰李文哲张涌
李长雷,郑聪颖,刘军,兰杰,李文哲,张涌
西北农林科技大学动物医学院 农业部动物生殖生理与胚胎工程重点实验室,杨凌 712100
动物及兽医生物技术
山羊克隆胎儿不同组织中H19基因CpG岛甲基化模式及表达量检测
李长雷,郑聪颖,刘军,兰杰,李文哲,张涌
西北农林科技大学动物医学院 农业部动物生殖生理与胚胎工程重点实验室,杨凌 712100
表观重编程异常是核移植胚胎发育异常的重要原因。为了研究克隆山羊胎儿不同组织中H19基因CpG岛甲基化水平和相对表达量,本实验运用亚硫酸盐法和荧光实时定量PCR法分别检测了死亡克隆山羊胎儿和同期普通山羊胎儿 (对照组) 肝脏、胎盘、肾脏、肺脏和心脏组织中H19基因CpG岛甲基化水平和mRNA的相对表达量。结果表明,克隆山羊胎儿胎盘组织中H19基因第5个CpG岛的甲基化水平显著高于对照组 (70%vs49.41%,P<0.05),H19基因相对表达量显著低于对照组 (883.3vs1 264.5,P<0.05);肺脏组织甲基化水平显著低于对照组 (63.53%vs88.24%,P<0.05),相对表达量显著高于对照组 (1 003.4vs515.5,P<0.05);其他各组差异不显著 (P>0.05)。结果说明,H19基因在克隆山羊胎儿部分组织中 DNA甲基化重编程异常,而且这种异常影响H19基因的正常表达,这也可能是导致克隆动物死亡的重要因素之一。
克隆,山羊,H19基因,CpG岛,甲基化模式,mRNA表达
Abstract:The aberrant epigenetic reprogramme is an important cause for abnormal development of nuclear transfer embryos. The objective of this study was to investigate the CpG island methylation profiles and relative expression levels ofH19gene in different tissues of cloned goat fetus. We detected liver, placenta, kidney, lung and heart in the dead cloned goat fetus and the age-matched normal goat fetus (control) by using bisulfite sequencing and real time PCR. Results indicated that methylation levels of the fifth CpG island ofH19gene in dead cloned goat fetus was significant high compared with that in the control in placenta (70%vs49.41%,P< 0.05), and relative expression levels ofH19gene was significant low compared with that in the control (883.3vs1 264.5,P<0.05). Reversely, the methylation levels was significant low compared with that in the control in lung (63.53%vs88.24%,P< 0.05),and relative expression levels was significant high compared with that in the control (1 003.4vs515.5,P< 0.05). The differences of others groups were insignificant (P> 0.05). Results showed the abnormal DNA methylation proflies ofH19gene occurred in some tissues of cloned goat fetus, which affected normal expression levels ofH19gene, indicating that aberrant DNA methylationreprogramme may be one of the important factors for the death of cloned animals.
Keywords:clone, goat,H19gene, CpG island, methylation pattern, mRNA expression
自1996年Campbell等成功获得第一例体细胞核移植绵羊以来,体细胞克隆技术已成功应用于多种哺乳动物,但是通过核移植技术得到健康克隆动物的效率非常低,体细胞核移植动物的流产率和新生儿死亡率远高于体外受精和人工受精得到的动物,即使是存活下来的克隆动物也常伴有表型异常和不同程度的发育缺陷,研究表明表观重编程异常是核移植胚胎发育异常的重要原因之一[1-3]。DNA甲基化是基因组主要的表观遗传修饰方式之一,它对哺乳动物发育相关基因的正确表达有着重要的调控作用[4]。核移植过程中,供体核要关闭自身的基因表达模式,建立胚胎发育的基因表达模式,DNA甲基化异常可能导致基因表达紊乱,从而影响核移植胚胎的发育[5]。
目前估计哺乳动物含有20 000~25 000个基因[6],它们中很大一部分与植入前胚胎和胎儿生长发育的调控有关,其中一部分要发生基因印记,即机体仅表达来自亲本一方的等位基因,而另一方不表达或很少表达。到目前为止,在人和哺乳动物中已经分离和鉴定出的印记基因有 70多个[7-9]。H19、IGF2(Insulin-like growth factor 2) 及其受体IGF2R是3个被研究较多的印记基因,它们参与调控植入前胚胎和胎儿的生长发育。H19编码一个非翻译性RNAs,是一种生长调节基因,它在胚胎组织中高度表达,出生后在很多组织中受到了明显表达抑制[10]。它在细胞的增殖和分化方面具有双重作用;可以调节胚胎的生长和发育、胚胎在子宫内的生长以及新生儿的生长,印记功能的紊乱将导致多种发育异常及死胎[11]。截至目前,关于印记基因H19表达的研究已经在克隆小鼠[12-13]、克隆绵羊[14]、克隆牛[15-16]等动物上进行。然而山羊上的相关报道很少,而且在克隆山羊胎儿不同组织中H19基因CpG岛甲基化和表达情况尚不清楚。
在本实验中,运用亚硫酸盐法测定并比较了H19基因CpG岛在死亡克隆山羊胎儿和同期成活普通山羊胎儿 (对照组) 肝脏、胎盘、肾脏、肺脏和心脏组织中的甲基化率,并运用实时荧光定量PCR法测定比较了H19基因在各组织中的相对表达量。实验结果表明,在克隆山羊胎儿部分组织中H19基因表达存在异常,其原因可能是H19基因CpG岛发生了异常甲基化,这些发现为提高核移植效率提供一定的理论基础。
1 材料与方法
1.1 材料、试剂及设备
1.1.1材料来源
克隆山羊胎儿出生 3 h后死亡;同期成活普通山羊胎儿 (对照组,山羊品种均系西农莎能奶山羊,下同),来自于杨凌科元克隆有限责任公司,出生后人为处死,无菌条件下解剖分离肝脏、胎盘、肺脏、肾脏和心脏等组织,封闭保存在−70℃备用。
1.1.2主要试剂及仪器
TIANamp Genomic DNA Kit (离心柱型,DP304),EZ DNA Methylation-Gold KitTM(D5006)、凝胶回收纯化试剂盒、质粒小量制备纯化试剂盒(TaKaRa,Japan);pMD18-T 载体 (Promega,USA);Power SYBR Green PCR Master Mix (ABI,USA);SuperScriptTMⅢRT-PCR Kit (Invitrogen,USA);DH5α感受态细胞 (Tiangen, Germany);PCR (Bioer,China) 仪等。
1.2 实验方法
1.2.1DNA提取及甲基化处理
无菌条件下,按照 DNA提取试剂盒 (离心柱型,DP304) 要求分别提取死亡克隆山羊胎儿和同期普通山羊胎儿的肝脏、胎盘、肺脏、肾脏和心脏组织基因组DNA,按EZ DNA Methylation-Gold KitTM(D5006) 要求进行DNA甲基化处理。
1.2.2DNA扩增、克隆和测序
山羊H19基因公布的DNA序列长度为4 199 bp(Accession No. EF577239),经 MethPrimer-DesignPrimers for Methylation PCRs软件检测有8个CpG岛,按照CpG岛排列顺序,把位于2 861 bp~2 994 bp之间的称之为第5个CpG岛,与启动子 (2 732 bp~2 982 bp) 有部分重叠,所以测定第5个CpG岛甲基化情况有代表性。Primer5.0设计特异性引物:F:5′-TAGTTTTTTGGTGGTATAGGGTTTT-3′,R:5′-A CAAACTCCCACATTTAACCATAAT-3′ (F,forward;R,reverse)。PCR反应体系50 µL,体系反应条件如下:95 ℃ 10 min ;95℃30s,55℃40s,72℃40s,40个循环;72 ℃ 7 min 。PCR产物经凝胶电泳,用凝胶回收试剂盒回收 DNA;取 4 μL回收 DNA与pMD18-T载体,4℃连接过夜;将连接产物转化至DH5α感受态细胞,涂布于含有Amp的LB平皿,37℃培养12 h。挑取菌落,提取质粒,经PCR鉴定后测序。
1.2.3甲基化序列分析
死亡克隆山羊胎儿和同期普通山羊胎儿的肝脏、胎盘、肺脏、肾脏和心脏组织分别取10个克隆结果进行分析,克隆序列用BIQ Analyzer软件进行数据整理和在线分析 (http://biq-analyzer.bioinf.mpi-sb.mpg.de/)。
1.2.4总RNA的提取、反转录和实时定量 PCR
按照SuperScriptTMⅢ RT-PCR Kit (Invitrogen USA) 试剂盒的要求,分别提取死亡克隆山羊胎儿和同期普通山羊胎儿肝脏、胎盘、肾脏、肺脏和心脏组织总 RNA,总RNA提取后用凝胶电泳鉴定其质量;取2 µg总RNA (最终浓度为80 ng/µL) 进行反转录。
山羊H19mRNA表达量的引物 F:5′-GGACTG GAACTTGGACTTCTTCA-3′;R:5′-TGGTGTGGGT CTTCCGTTC-3′[17];山羊 GAPDH (CHI431207) 引物:F:5′-CACCATCTTCCAGGAGCGAG-3′;R:5′-C CATCACAAACATGGGAGCG-3′[18]。在 12.5 μL 定量反应体系中,1 μL模板cDNA,0.625 IUTaqDNA酶,2.5 μL 5×PCR buffer,0.3 mmol/L dNTPs,3.75 mmol/L MgCl2,正反引物各 0.5 µmol/L,0.625 µL 20 × SYBR green I;PCR 反应条件:95℃1 min;95℃30s,57℃30s,72℃30s,45个循环;最后 72℃5 min。循环结束后,完成溶解曲线图,以检验PCR产物的纯度。每组超纯水作为阴性对照,每组PCR定量检测重复 3遍。实时荧光定量分析用 2-ΔΔCt法。标本内普通山羊和克隆山羊不同组织H19基因与内标基因Ct值比较:ΔCt=C(t,m)−C(t,n),标本间 ΔCt比较:ΔΔCt= ΔCt实验组−ΔCt对照组,最后值以2-ΔΔCt计算。
1.2.5数据处理和统计学分析
甲基化率差异显著性检验采用卡方检验(Chisquare),当P<0.05时统计学上差异显著。
2 结果
2.1 山羊胎儿不同组织中H19基因第5个CpG岛目的片段扩增结果
山羊H19基因公布的DNA序列长度为4 199 bp(Accession No. EF577239),扩增目的片段长度为230 bp,位于 2 770 bp~2 999 bp间,其中第5个CpG岛位于2 861 bp~2 994 bp之间 (图1)。
2.2 克隆山羊胎儿不同组织中H19基因第 5个CpG岛甲基化状况分析
H19基因第5个CpG岛甲基化率在死亡克隆山羊胎儿肝脏、胎盘、肾脏、肺脏和心脏组织中分别为75.88%、70%、71.76%、63.53%、83.53%;在同期普通山羊胎儿肝脏、胎盘、肾脏、肺脏和心脏组织中分别为85.88%、49.41%、77.65%、88.24%、78.82% (图2)。同类组织甲基化率差异性采用卡方检验,结果显示在肝脏、肾脏和心脏组织中甲基化率差异不显著 (P>0.05),然而克隆山羊胎儿胎盘组织甲基化率显著高于对照组 (P<0.05),肺脏组织甲基化率显著低于对照组 (P<0.05)。结果表明,克隆山羊胎儿的肺脏和胎盘组织中H19基因第5个CpG岛发生了异常的甲基化。
图 1 死亡克隆山羊胎儿和同期普通山羊胎儿不同组织中H19基因目的片段Fig.1 Objective fragment ofH19in different tissues of dead cloned goat fetus and age-matched common goat fetus. 1−5:liver, placenta, kidney, lung and heart of age-matched common goat fetus; 6−10: liver, placenta, kidney, lung and heart of dead cloned goat fetus; M: DNA marker.

图2 克隆山羊胎儿和同期普通山羊胎儿不同组织中H19基因的甲基化情况Fig.2 Methylation profiles ofH19gene in different tissues of cloned goat fetus and age-mathed common goat fetus. (A) Rate of methylation of CpG island in liver of dead cloned goat fetus: 75.88% (129/170). (B) Rate of methylation of CpG island in liver of age-matched common goat fetus: 85.88% (146/170). (C) Rate of methylation of CpG island in placenta of dead cloned goat fetus:70% (119/170). (D) Rate of methylation of CpG island in placenta of age-matched common goat fetus: 49.41% (84/170). (E) Rate of methylation of CpG island in kidney of dead cloned goat fetus: 71.76% (122/170). (F) Rate of methylation of CpG island in kidney of age-matched common goat fetus: 77.65% (132/170). (G) Rate of methylation of CpG island in lung of dead cloned goat fetus: 63.53%(108/170). (H) Rate of methylation of CpG island in lung of age-matched common goat fetus: 88.24% (150/170). (I) Rate of methylation of CpG island in heart of dead cloned goat fetus: 83.53% (142/170). (J) Rate of methylation of CpG island in heart of age-matched common goat fetus: 78.82% (134/170).
2.3H19基因在山羊胎儿不同组织中的相对表达量
为了验证H19基因第5个CpG岛甲基化异常是否会影响H19基因的表达,运用实时定量 PCR法,测定出H19mRNA在死亡克隆山羊胎儿和同期普通山羊胎儿肝脏、胎盘、肾脏、肺脏和心脏组织中的相对表达量,其比值依次为:1.36、0.70、1.16、1.95、0.87。结果显示在肝脏、肾脏和心脏组织中H19mRNA 的相对表达量差异不显著 (P>0.05),在胎盘组织中的相对表达量显著低于对照组 (P<0.05),在肺脏组织中的相对表达量显著高于对照组(P<0.05) (图 3)。
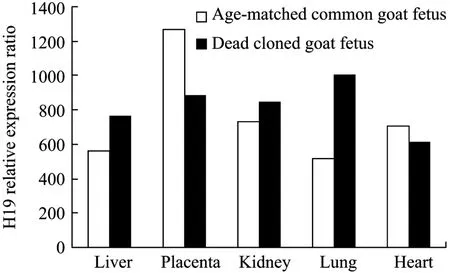
图3 不同类型山羊胎儿不同组织中H19mRNA的相对表达量Fig.3 Relative expression ofH19mRNA in different tissues of different types goat fetus.
3 讨论
体细胞核移植技术有力地证明了分化细胞再发育的潜能。核移植后供体细胞核的不完全修饰可能导致相关生长发育重要基因的异常表达,这导致了克隆动物出生率低下。印记基因的异常表达可导致表观缺陷已在多种克隆动物上被验证[19]。DNA甲基化可能与siRNA、microRNA[20-21]以及其他表观遗传修饰,共同来调节基因的时空表达[22],因此检测基因组CpG岛甲基化模式是揭示基因正常或异常表达的重要事件。本试验结果表明,克隆山羊肺脏和胎盘组织H19基因第5个CpG岛甲基化异常,这种异常可以影响H19基因的正常表达。
本实验运用亚硫酸盐法处理基因片段,结果表明H19基因第5个CpG岛甲基化水平在死亡克隆山羊胎儿胎盘和肺脏组织中相对于对照组差异明显(P<0.05)。运用实时定量 PCR法测定出H19基因在死亡克隆山羊胎儿和同期普通山羊胎儿不同组织(肝脏、胎盘、肾脏、肺脏和心脏) 中的相对表达量。结果表明H19基因相对表达量在死亡克隆山羊胎儿胎盘和肺脏组织中相对于对照组差异明显 (P<0.05),而且H19基因甲基化结果和mRNA实时定量结果相吻合。H19基因第5个CpG岛甲基化程度越高,H19基因mRNA的表达量低,甲基化程度越低,mRNA表达量高。克隆山羊胎儿胎盘和肺脏组织H19基因第5个CpG岛甲基化异常可能是由于供体核的错误重编程导致的,而且第5个CpG岛与启动子有部分重叠,对基因表达有调控作用,因此CpG岛甲基化异常引起了基因表达的异常[23]。
H19基因呈母源性表达,与父源性基因IGF2形成交互印记作用[24],对维持胚胎正常发育至关重要,它的表达异常可能引起印记模式的错误,导致胚胎发育异常或者发育终止。Lee等[25]在绵羊胚胎和由内胚层及中胚层发育而来的胎儿肌肉和肾脏等组织中检测到H19mRNA有较高表达量,但并没有在由外胚层发育来的组织如滋养外胚层和胎儿脑部组织中检测到它的表达。Young等[14]研究发现小鼠H19基因上游区域的 CpG岛调控其自身的印记表达,Inoue等[26]和 Ogura等[27]检测发现发育足月的克隆小鼠和对照组小鼠的胎盘,两者的H19mRNA的表达量并无显著差异,说明克隆小鼠发育到足月和出生后存活与印记基因的正常表达有着十分紧密的联系。李宁等[28]研究发现H19基因在死亡克隆牛脾脏组织内甲基化水平较高,在心脏组织内水平较低而mRNA表达量较高;而在同期正常牛同类组织中H19基因甲基化水平相对稳定。Zhang等[29]发现H19基因在出生后不久死亡的克隆牛胎儿不同组织中表达异常,呈双等位基因表达。这些研究均说明H19基因能否正常表达对克隆胎儿的正常生长发育起着十分重要的作用。邢宝松等[17]通过成活体细胞克隆山羊和同期普通山羊耳部组织和舌部组织的检测,发现在克隆山羊和非克隆山羊中H19mRNA的表达量没有显著性差异(P>0.05),但是没有对其他组织中H19mRNA的表达量进行检测。本实验结果表明H19基因在克隆山羊死亡胎儿的肺脏和胎盘中异常表达。实验过程中还发现克隆山羊死亡胎儿较正常山羊胎儿相比,个体偏小、体重偏轻、出生后3 h死于呼吸衰竭、胎盘肥大、肉脯减少、剖解未见器官异常。因此,H19基因的异常表达可能是导致克隆山羊死亡的重要原因之一。
REFERENCES
[1] Daniels R, Hall VJ, French AJ,et al. Comparison of gene transcription in cloned bovine embryos produced by different nuclear transfer techniques.Mol ReprodDev,2001, 60: 281−288.
[2] Humpherys D, Eggan K, Akutsu H,et al. Abnormal gene expression in cloned mice derived from embryonic stem cell and cumulus cell nuclei.Proc Natl Acad Sci USA,2002, 99: 12889−12894.
[3] Wrenzycki C, Wells D, Herrmann D,et al. Nuclear transfer protocol affects messenger RNA expression patterns in cloned bovine blastocysts.Biol Reprod, 2001,65: 309−317.
[4] Jaenisch R, Bird A. Epigenetic regulation of gene expression:how the genome integrates intrinsic and environmental signals.Nat Genet, 2003, 33(Supplement): 245−254.
[5] Feng YQ, Desprat R, Fu H,et al. DNA methylation supports intrinsic epigenetic memory in mammalian cells.PLOS Genet, 2006, 2: 461−470.
[6] Stein LD. Human genome: end of the beginning.Nature,2004, 431(7011): 915−916.
[7] Bartolomei MS, Tilghman SM. Genomic imprinting in mammals.Annu Rev Genet, 1997, 31: 493−525.
[8] Morison IM, Paton CJ, Cleverley SD. The imprinted gene and parent-of-origin effect database.Nucleic Acids Res,2001, 29: 275−276.
[9] Young LE, Fairburn HR. Improving the safety of embryo technologies: possible role of genomic imprinting.Theriogenology, 2000, 53: 627−648.
[10] Paulsen M, Takada S, Youngson NA,et al.Comparative sequence analysis of the imprintedDlk1-Gtl2locus in three mammalian species reveals highly conserved genomic elements and refines comparison with theIgf2-H19region.Genome Res, 2001, 11(12): 2085−2094.
[11] Barlow DP. Gametic imprinting in mammals.Science,1995, 270(5242): 1610−1613.
[12] Ogawa H, Ono Y, Shimozawa N,et al. Disruption of imprinting in cloned mouse fetuses from embryonic stem cells.Reproduction, 2003, 126: 549−557.
[13] Yamazaki Y, Mann MR, Lee SS,et al. Reprogramming of primordial germ cells begins before migration into the genital ridge, making these cells inadequate donors for reproductive cloning.Proc Natl Acad Sci USA, 2003, 100:12207−12212.
[14] Young LE, Schniekec AE, McCreathc KJ,et al.Conservation ofIGF2-H19andIGF2Rimprinting in sheep:effects of somatic cell nuclear transfer.Mech Dev, 2003,120: 1433−1442.
[15] Yang L, Chavatte-Palmer P, Kubota C,et al. Expression of imprinted genes is aberrant in deceased newborn cloned calves and relatively normal in surviving adult clones.Mol Reprod Dev, 2005, 71: 431−438.
[16] Han DW, Song SJ, Uhum SJ,et al. Expression ofIGF2andIGFreceptor mRNA in bovine nuclear transferred embryos.Zygote, 2003, 15: 245−252.
[17] Xing BS, Xu YX, Cheng Y,et al.Overexpression ofIGF2RandIGF1RmRNA in SCNT-produced goats survived to adulthood.J Genet Genomics, 2007, 34(8):709−719.
[18] Wu HJ, Luo J, Zhang LJ,et al. Screening, cloning and bioinformatics analysis ofUbi-d4gene in Xinong Saanen goat.Sci Agr,2008, 41(6):1804−1809.
武会娟, 罗军, 张丽娟, 等. 西农萨能山羊锌指蛋白基因Ubi-d4的筛选、克隆和生物信息学分析. 中国农业科学, 2008, 41(6): 1804−1809.
[19] Wilmut I, Beaujean N, De Sousa PA,et al. Somatic cell nuclear transfer.Nature, 2002, 419: 583−586.
[20] Morris KV, Chart SW, Jacobsen SE,et al. Small interfering RNA-induced transcriptional gene silencing in human cells.Science, 2004, 305(5688): 1289−1292.
[21] Grewal SI, Rice JC. Regulation of heterochromatin by histone methylation and small RNAs.Curr Opin Cell Biol,2004, 16(3): 230−238.
[22] Fuks F. DNA methylation and histone modifications:teaming up to silence genes.Curr Opin Genet Dev, 2005,15(5): 490−495.
[23] Kremenskoy M, Kremenska Y, Suzuki M,et al. DNA methylation profiles of donor nuclei cells and tissues of cloned bovine fetuses.J Reprod Develop, 2006, 52(2):259−266.
[24] Ripoche MA, Kress C, Poirier F,et al. Deletion of theH19transcription unit reveals the existence of a putative imprinting control element.Gene Dev, 1997, 11(12):1596−1604.
[25] Lee RS, Depree KM, Davey HW. The sheep (Ovis aries)H19gene: genomic structure and expression patterns,from the preimplantation embryo to adulthood.Gene,2002, 301: 67−77.
[26] Inoue K, Kohda T, Lee J,et al. Faithful expression of imprinted genes in cloned mice.Science, 2002, 75:295−297.
[27] Ogura A, Inoue K, Ogonuki N,et al. Phenotypic effects of somatic cell cloning in the mouse.Clone Stem Cells, 2002,4: 397−405.
[28] Li Lin, Qiang Li, Ning Li,et al.Aberrant epigenetic changes and gene expression in cloned cattle dying around birth.BMC Dev Biol,2008, 11: 8−14.
[29] Shouquan Zhang, Chikara Kubota, Lan Yang,et al.Genomic imprinting ofH19in naturally reproduced and cloned cattle.Biol Reprod, 2004, 71: 1540−1544.
CpG island methylation patterns and expressions ofH19gene in cloned fetus of goat
Changlei Li, Congying Zheng, Jun Liu, Jie Lan, Wenzhe Li, and Yong Zhang
Key Laboratory of Animal Reproductive Physiology & Embryo Technology,College of Veterinary Medicine,Northwest Agriculture & Forestry University,Yangling712100,China
Received:November 21, 2009;Accepted:March 12, 2010
Supported by:Key Scientific and Technological Special Program for the Development of Transgenic Species of China (No. 2008ZX08007-004).
Corresponding author:Yong Zhang. Tel: +86-29-87080085; E-mail: zhy1956@263.net
国家“转基因品种培育”重大科技专项资金 (No. 2008ZX08007-004) 资助。
