大麦高分子量基因组DNA提取的优化
2010-09-11薛金爱赵彦宏王艳芳李润植
薛金爱,赵彦宏,王艳芳,李润植
(1.山西农业大学 农学院,山西 太谷030801;2.鲁东大学生命科学院,山东 烟台264025)
随着生物基因组学的广泛构建,有关基因组结构、组成、DNA序列变异与进化、基因组遗传作图以及基因组改良的研究已成为当今生物学最活跃的研究领域。制备高质量的基因组高分子量(HMW)DNA是进行基因组学研究,特别是BAC(bacterial artificial chromosome)克隆,YAC(yeast artificial chromosome)克隆DNA文库构建和全基因组物理作图至关重要的基础工作[1~3]。常规提取基因组DNA的方法需要研磨生物组织,使用含蛋白酶K、去垢剂和EDTA等化学药品。用这些方法所提取的DNA分子多为小于500 kb,不能用于高质量DNA文库(如YAC文库)的构建和基因组物理作图。曾有先辈建立了先用琼脂糖包埋酵母细胞,然后进行分解提取酵母基因组 HMW DNA的方法。琼脂糖包埋法可使大分子DNA不被分解液及后续操作所降解,保持DNA完整。基于琼脂糖包埋法,从拟南芥、番茄等生物中分离基因组高分子DNA的方法也已建立。Cheung和Gale[4]报道了基于琼脂糖包埋法制备小麦、大麦和黒麦基因组HMW DNA方法。该方法用于大麦基因组DNA制备还存在着DNA产量低,时间长等不足。迄今,还没有一种较好的提取大麦基因组完整的高分子量DNA的方法。
本文在前人研究的基础上,对琼脂糖包埋大麦原生质体和细胞核这两种提取DNA的方法进行了比较,改进和优化,建立了较理想的适合于从大麦幼苗叶片中提取大麦基因组高分子量DNA的有效方法。限制酶消化,脉冲电场凝胶电泳(PFGE)和Southern杂交等检测表明,新改进的方法实验流程缩短,效率提高,所分离HWM DNA能更好地满足后续相关研究的需要。
1 材料与方法
1.1 植物材料与试剂
大麦植物材料:生长14 d和4周的大麦幼苗叶片。
试剂:
原生质体缓冲液(10 mmol·L-1CaCl2·2H2O,1μmol· L-1CuSO4· 5H2O,0.2 mmol· L-1KH 2PO4,10 mmol·L-1KI,1 mmol·L-1KNO3,0.7 mol· L-1Mannitol,2 mmol· L-1MES,1 mmol·L-1MgSO4·7 H2O,最后用KOH调整到pH 8.5)
酶溶液[0.8%纤维素酶Onokzuka R-10(Yakult,Tokyo,Japan),0.4%Macerocyme Onokzuka R-10(Yakult,Tokyo,Japan),0.04%PectoylaseY23(Seishin,Tokyo,Japan)].
分解液(0.5 mol·L-1EDTA pH 8.0,10 m mol·L-1Tris,pH 8.0,1%sarkosyl,2 g·L-1蛋白酶K)
匀化缓冲液(HB)母液:0.1 mol·L-1trizma base,0.8 mol· L-1KCl,0.1 mol· L-1EDTA,10 mmol·L-1spermidine,10 mmol·L-1spenine,最后用NaOH调整p H 9.4~9.5,在4℃下保存。
HB(1×):1×HB+0.5 mol·L-1sucrose,4℃下保存,使用前再加入β-巯基乙醇使终浓度为0.15%。
漂洗缓冲液(1×HB+0.5%TritonX-200,4℃下保存,用前加入β-巯基乙醇使终浓度为0.15%。
TE缓冲液(10 mol·L-1Tris-HCl p H8.0,1 mmol·L-1EDTA p H 8.0)。
酶解缓冲液(其中含有8 mmol·L-1的亚精胺和2 g·L-1的 BSA)
1.2 琼脂糖包埋原生质体
参照Cheung和Gale[4]方法并做修改。以生长14 d的大麦幼苗叶片为材料,经过一系列的操作先提取出原生质体,再把叶组织用4 mL原生质体缓冲液漂洗4次,以促进原生质体进一步解离。然后,将含有原生质体的溶液用40μm和20μm的尼龙筛过滤。将收集到的过滤液,少许离心(26 g,10 min)后获得原生质体沉淀。再用原生质体缓冲液漂洗原生质体沉淀,最终浓度为每毫升4.5×106个原生质体。加入等体积的含有2%琼脂糖和0.17 mol·L-1EDTA的低溶点的琼脂糖溶液,混匀,45℃下保存备用。将含有原生质体的低溶点琼脂糖溶液分装入塑料铸模中(长×宽×高:10 mm×5 mm×1.5 mm),4℃下,固化 30 min。将固化的含有原生质体的琼脂糖块于50℃下用分解液(0.5 mol·L-1EDTA pH 8.0,10 m mol·L-1Tris p H 8.0,1%sarkosyl,2 g·L-1蛋白酶 K)处理48 h。再用0.5 mol·L-1EDTA 于50℃下漂洗4次。收集 DNA于 0.5 mol·L-1EDTA中,4℃保存备用。
1.3 琼脂糖包埋细胞核
参考邱芳等的方法[5]稍做修改进行。取生长4周的大麦幼苗叶片,将其切碎,加入液态氮研磨至粉末状并转移到加有200 mL冰冷的混合液(1×HB,0.15%的β-巯基乙醇,0.5%的 TritonX-100)的烧杯中。在冰上轻轻搅动混合液10 min,混匀后过滤。过滤后的混合液4℃下离心(1800 g)20 min。弃除上清液,收集细胞核沉淀。然后用1 mL未加入β-巯基乙醇的1×HB液重新悬浮细胞核,冰上保存。最后将细胞核包埋到琼脂糖块中,按琼脂糖包埋原生质体方法进行解离和漂洗[6]。
1.4 高分子量(HMW)DNA的限制性酶解
先用冰冷的TE(10 mol·L-1Tris-HCl p H 8.0,1 mmol·L-1EDTA p H 8.0)缓冲液漂洗含有HMW 的DNA的琼脂糖塞(块),然后将漂洗过的琼脂糖塞(块)放入500μL限制性酶解缓冲液中,在4℃下进行预酶解处理。接着再将琼脂糖塞转入500μL新配制的与上述相同的缓冲液中,加入PvuI和NotI这两种限制性酶,在该限制性酶所要求的温度下,酶解处理4 h至过夜。在每个酶解反应样品中加入0.5 mol·L-1EDTA,以终止酶解反应,在4℃下保存以备用。此时,经过酶解的琼脂糖塞就可以用来进行电泳分离。
1.5 脉冲电场凝胶电泳(PFGE)[7]分离酶解DNA
片段,转膜,Southern杂交和杂交信号的检测
用CHEF DRⅡ(Bio-Rad.USA)电泳仪进行PFGE电泳,温度 14℃,电压200 V,分离 HMW DNA的脉冲和电泳时间见表1。电泳完毕,EB染色;然后用凝胶成像仪拍照。将凝胶电泳所分离的DNA片段转移到Hbond-N+杂交膜(Amershan USA)上,转移液为0.4 mol·L-1的NaOH 。然后用32P标记的探针进行Southern杂交。在暗室中,将杂交和漂洗后的Hbond-N+杂交膜用X光胶片曝光,放射自显影;然后在暗室中取出胶片,进行显影和定影。读取和记录杂交信号(杂交斑点或者带)。

表1 限制性酶解的HMW DNA的电泳参数Table1 Electrophoretic parameters used to resolve the restricted HMW DNA
2 结果与讨论
比较两种不同方法所提取的高分子量DNA的PFGE电泳结果,分析所获高分子量的DNA片段的数量和质量,从而确定这两种方法中哪种方法提取的基因组DNA数量多,质量高较适合后续的研究。这两种方法是:琼脂糖包埋原生质体和琼脂糖包埋细胞核。优化后的试验流程如图1所示:

图1 试验流程Fig.1 Experiment process
制备过程中为了确保细胞核完整无损,将细胞核从匀化缓冲液中分离出来,用DAPI染色,在荧光显微镜上观察,计数,以确保样本中有大量完整无损的细胞核(>95%)。原生质体的分离和完整性可通过倒置显微镜来检测。然后用琼脂糖包埋完整的细胞核或原生质体,以制备高分子量DNA。用脉冲场电泳检测这两种方法所分离DNA片段的数量和质量。DNA分子大小标记为由酿酒酵母(Saccharomycescerevisiae)和粟酒酵母(Scizosaccharomyces pombe)染色体所制备的高分子量DNA,分别为220 kb~2.2 Mb(M1)和 2.2 Mb~4.6 Mb(M2)。
如图2a所示,经脉冲场电泳分离后,绝大多数DNA滞留在点样孔(D)及其附近凝缩区中(DZ)。琼脂糖包埋细胞核方法提取的DNA数量大,而原生质体方法提取的DNA数量少。细胞核和原生质体法所提取的DNA也含有少量低分子量的DNA片段,凝胶中呈现轻微拖尾状。这两种方法提取的DNA分子绝大多数 >1.6 Mb(图2a),其中>4.6 Mb(图2b)占主要部分。这样大小的DNA能满足BAC克隆,YAC克隆文库构建和基因组物理作图的要求[7]。相比较而言,琼脂糖包埋细胞核方法制备的大麦基因组DNA质量优于原生质体法所提取的DNA。
为验证这两种方法所分离的DNA能否被限制性内切酶所消化以及酶解片段大小是否适合物理作图对大片段的要求,我们用两种稀有限制性内切酶(PvuⅠ,NotⅠ)和三种常见限制性内切酶(EcoR1,HindIII,BamH1)对这些HMW DNA进行限制性消化处理,接着用PFGE电泳分离。电泳后,凝胶体用EB染色,在清水中脱色过夜,结果如图2b。绝大部分细胞核法和原生质体法制备的未切割DNA是大于4.6Mb的HMW DNA(滞留在点样孔及其附近凝胶中)。也能看见一些低分子量DNA,呈轻微拖尾状。这两种酶能完全酶解HMW DNA(点样孔中DNA已全部消失)。具有6个碱基识别位点的PvuI酶解细胞核法制备的DNA,酶解所得的DNA片段均小于2.2 Mb,而具有8个碱基识别位点的NotI酶所切割的DNA片段接近于2.2 Mb。酶切所得DNA片段大小亦能满足后续研究的要求。稀有内切酶酶解结果亦表明琼脂糖包埋细胞核法制备的大麦HMW DNA的数量多,质量好。
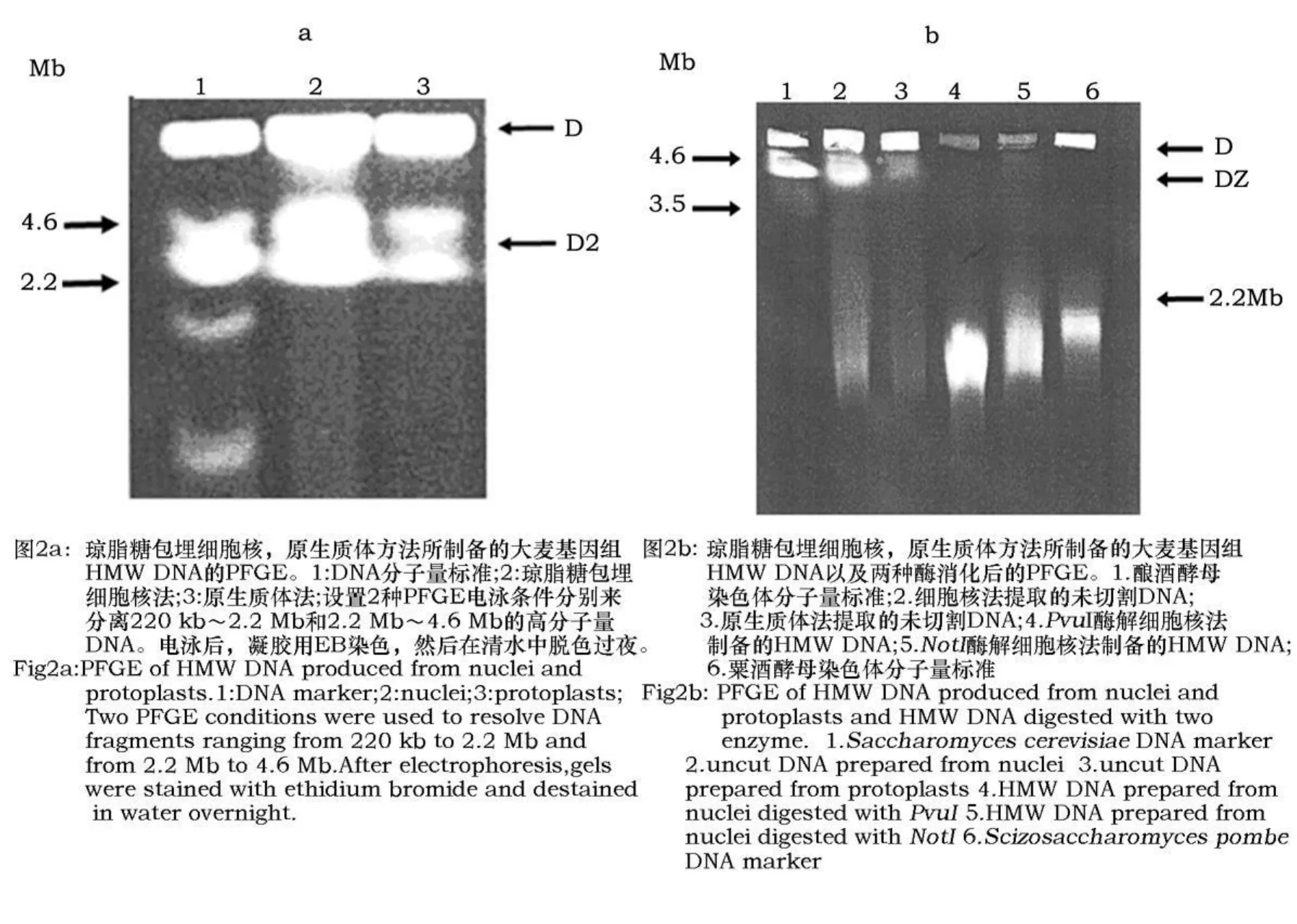
图2 两种不同方法制备大麦基因组HMW DNA的比较Fig.2 Comparison of high molecular weight(HMW)DNA prepared from Hordeum vulgare nuclei and protoplasts
三种常见限制性内切酶对这两种方法提取的HMW DNA酶解结果见图3a。这些酶解所得到的片段大小多数介于4 kb和1 Mb之间,为不连续的带型,这正是物理作图所需的。酶解DNA转膜后,与在大麦基因组有多个位点的探针 BCD1380进行杂交。在各酶解DNA样品中均获得多拷贝的杂交信号(图3b)。Southern杂交结果再次显示本研究所优化的提取大麦HMW DNA方法所获得高质量DNA能适于后续大片段克隆文库构建和物理组图。
前期研究应用原生质体分离的HMW DNA已成功地用作物理作图[8],然而物种不同,分离原生质体所需要的条件和方法也不同[9]。分离细胞核的条件及程序则不存在物种特异性限制。近年来,应用琼脂糖包埋细胞核制备HMW DNA方法在其他植物上也已建立,如raspherry(Rubus idaeus)和blackcurrant(Ribes nigrum)[10],蚕豆(Vicia f abaL.)和香蕉(Musa acuminateColla)[11],柑桔(Citrusclementina)[12]。DNA 方法还存在比如DNA量少、易降解、操作繁琐等不足[13]。我们对已有的方法[4]进行了改进和优化,操作容易,很少发生细胞核丢失。通过上述的分析和比较,确定由琼脂糖包埋细胞核制备DNA的方法所获得HMW DNA产量大,质量更好,绝大部分DNA的分子量大于4.6Mb。稀有和常见限制性酶酶解及PFGE电泳分离后,非常适于后续的大片段克隆文库和物理作图等基因组学研究。本文所优化的提取大麦HMW DNA方法亦可借鉴用于其他作物基因组高分子量DNA的分离。

图3 大麦基因组HMW DNA的限制性酶解和southern杂交分析Fig.3 Restriction enzyme digestion and southern hybridization of Hordeum vulgare HMW DNA
[1]Zhang H B,Zhao X,Paterson A H,et al.Preparation of megabase size DNA from plant nuclei[J].Plant J,1995,7:175-184.
[2]郭东伟,佘茂云,李连城,等.以小麦根尖分生组织细胞核及染色体制备高分子量DNA[J].作物学报,2006,32(12):1920-1923.
[3]Ahmadikhah A.A rapid mini-prep DNA extraction method in rice[J].African Journal of Biotechnology,2009,8(2):323-327.
[4]Cheung W Y,Gale M D.The isolation of high molecular weight DNA from wheat,barley and rye for analysis by pulse-field gel electrophoresis[J].Plant Molecular Biology,1990,14(5):881-888.
[5]邱芳,伏健民,王斌.从植物细胞核分离大分子量的核DNA[J].植物学报,1999,41(11):1204-1207.
[6]Woo SS,Rastogi V,Hong bin Zhang,et al.Isolation of megabase-size DNA from sorghum and applications for physical mapping and bacterial and yeast artificial chronosome library constraction[J].Plant M olecular Biology,1995,13(1):82-94.
[7]杨继良,王庆华,Deng Daiyong.Comparative studies on preparation of Large Plant DNA Fragments by PFGE[J].高技术通讯(英文版),2004,10(1):34-40.
[8]Wu K S,Tanksley S D.Abundance polymorphism and genetic mapping of microsatellites in rice[J].Molecular&General Genetics:MGG.1993,241(1/2):225-235.
[9]Ganal M W,Young N D,Tanksley S.D.Pulsed field gel electrophoresis and physical mapping of large DNA fragments in the Tm-2a region of chromosome 9 in tomato[J].M G G:Molecular&General Genetics.1989,215(3):395-400.
[10]Hein,Williamson I S,Russell J,et al.Isolation of high molecular weight DNA suitable for BAC library construction from woody perennial soft-fruit species[J].biotechniques.2005,38:69-71.
[11]Simkova H,cihalikova J,vrana M A,et al.Preparation of HMW DNA from plant nucleiand chromosomesisolated from root tips[J].Biologia plant arum.2003,46(3):369-373.
[12]Terol J,Naranjo M A,Ollitrault P,et al.Development of genomic resources for Citrus clementina:Characterization of three deep-coverage BAC libraries and analysis of 46,000 BAC end sequences[J].BMC Genomics 2008,9:423.
[13]Ghalib-Shalaldeh.Influence of Two Genomic DNA Extraction method s on DNA quantity and quality extracted from Barley in Jordon[J].Biotechnology,2006,5(4):508-513.
