喜泊芬对人食管癌Eca-109细胞的光动力效应
2010-09-01黄维甄谢剑明陈锦章李荣张兰英李黎波罗荣城
黄维甄 谢剑明 陈锦章 李荣 张兰英 李黎波 罗荣城
(南方医科大学南方医院肿瘤中心,广东 广州 510515)
自20世纪70年代光动力疗法进入临床研究以来,它不仅在各种良性疾病的治疗中取得了很好的疗效,并且在恶性肿瘤的治疗中取得了令人瞩目的成就[1]。光动力治疗(photodynamic therapy,PDT)也称光化学反应,氧、光敏剂和激光(常用激光)是其基本要素,其基本原理是利用某些光敏剂在新生物组织的定向分布或优先分布,同时在相应波长的可见光激发下,这些光敏剂能够激活,从而产生活性分子[2-3],这些活性分子包括单线态氧或三重态氧,它们和相邻的多种生物大分子发生氧化反应,进而对亚细胞结构(细胞膜、线粒体、溶酶体等)造成不可逆性损伤,最终导致细胞死亡。目前我国食管癌发病率居世界第1位,且90%的病理类型为鳞癌。由于光动力治疗具有创伤小、毒性小、可重复性好等优点,已逐渐成为食管癌的一种治疗手段,但在临床治疗中,其疗效并不稳定。本研究是采用我国自主研发的第3代光敏剂-喜泊分(HiPorfin),研究不同浓度光敏剂及不同光照剂量密度对人食管鳞状细胞癌Eca-109细胞体外效应的影响,探讨PDT杀伤人食管癌细胞效应与孵育浓度及光照剂量密度的关系,为临床HiPorfin-PDT的治疗参数选择提供一定的实验依据。
1 资料与方法
1.1 试剂及设备 喜泊芬每瓶5 mL 25 mg(重庆市华鼎现代生物制药有限责任公司);Bio-Rad550型博赛自动酶标仪;DIOMED 630型半导体激光器;CO2培养箱;LXJ-Ⅱ离心沉淀机;倒置相差显微镜;人食管癌细胞株Eca-109。
1.2 细胞培养 RPMI-1640高糖培养基,10%小牛血清,青霉素及链霉素双抗,置于37℃、5%CO2的培养箱中,常规细胞培养,3~5 d传代1次。
1.3 四甲基偶氮唑盐(MTT)法检测喜泊芬-PDT对食管癌Eca-109细胞的杀伤效应 取对数生长期(第3天,细胞长满约占培养瓶的80%)Eca-109细胞,胰蛋白酶消化30 s~1 min,镜下观察细胞大部分变形后弃消化液,加入RPMI-1640培养液,吹打,以1000 r◦min-1离心5 min,取上清液,加入全培养基,调整细胞浓度为105◦mL-1,接种于96孔板,每孔100 mL,37℃、5%CO2的培养箱培养24 h后,加入光敏剂,每孔 100μL。Eca-109细胞分为PDT实验组和完全空白对照组。PDT实验组加入不同孵育浓度的喜泊芬(每个浓度4个复孔),使喜泊芬终浓度为:0、2.5 、5.0、10.0、15.0 、20.0 μ g ◦mL-1。加入喜泊芬后继续于37℃、5%CO2培养箱内培养12 h,去培养液,PBS洗3次后加入含2%小牛血清的1640培养液后除空白对照组外均即刻给予光照,光源采用DIOMED 630 PDT系统,波长630 nm,给予饱和光剂量照射,光照剂量密度分别为 0、12、24、30 J◦cm-2。光照后继续在培养箱内培养24 h,每孔加入 MT T 20μL,并继续避光培养4 h后去培养液,每孔加入二甲基亚砜100μL,于振荡器上摇匀后于酶标仪上测A570OD值,并按照以下公式计算细胞生存率。细胞生存率=(光动力实验组A570OD值-本底组A570OD值)/(完全空白对照A570OD值-本底组A570OD值)[4]。以上实验重复3次。
1.4 统计学处理 数据分析用SPSS13.0分析软件,采用析因设计的方差分析。
2 结 果
在喜泊芬不同孵育浓度及不同光照剂量密度下PDT对食管癌Eca-109细胞体外效应的影响见表1和图1。
表1 不同孵育浓度喜泊芬及不同光照剂量密度食管癌Eca-109细胞的生存率(%)比较 ()
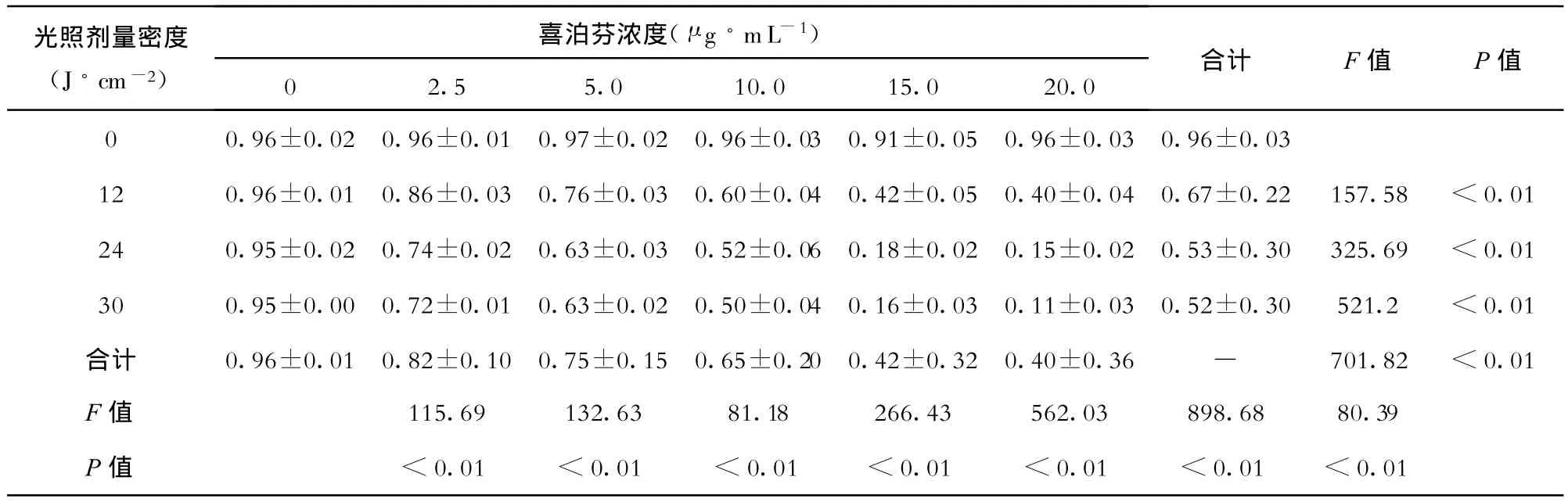
表1 不同孵育浓度喜泊芬及不同光照剂量密度食管癌Eca-109细胞的生存率(%)比较 ()
光照剂量密度(J◦cm-2)喜泊芬浓度(μ g◦mL-1)02.5 5.0 10.0 15.0 20.0合计 F值 P值0 0.96±0.020.96±0.010.97±0.020.96±0.030.91±0.050.96±0.030.96±0.0312 0.96±0.010.86±0.030.76±0.030.60±0.040.42±0.050.40±0.040.67±0.22 157.58 <0.0124 0.95±0.020.74±0.020.63±0.030.52±0.060.18±0.020.15±0.020.53±0.30 325.69 <0.0130 0.95±0.000.72±0.010.63±0.020.50±0.040.16±0.030.11±0.030.52±0.30 521.2 <0.01合计 0.96±0.010.82±0.100.75±0.150.65±0.200.42±0.320.40±0.36 — 701.82 <0.01 F值 115.69 132.63 81.18 266.43 562.03 898.68 80.39 P值 <0.01 <0.01 <0.01 <0.01 <0.01 <0.01 <0.01

图1 喜泊芬不同孵育浓度(J◦cm-2)和不同光照剂量密度(μ g◦mL-1)间的交互效应
从表1及图1可见,喜泊芬的不同孵育浓度和在4种不同光照剂量密度下食管癌Eca-109细胞的生存率均有显著差异(P<0.01)。同一光照剂量密度下(除浓度为0 μ g◦mL-1组外),不同喜泊芬孵育浓度的食管癌 Eca-109细胞的生存率有显著差异(P<0.000),同一喜泊芬孵育浓度下(除光照剂量密度为0 J/cm2组外),不同光照剂量密度的食管癌Eca-109细胞的生存率亦有显著差异(P<0.01)。光照剂量密度与孵育浓度之间有显著的交互效应(P <0.01),当孵育浓度为20 μ g◦mL-1,光照剂量密度为24 J◦cm-2时其杀伤效应最强。孵育浓度由 15.0 μ g◦mL-1增加到 20 μ g ◦mL-1时,光照剂量密度由 24 J◦cm-2延长为 30 J◦cm-2并不能提高杀伤效应,这说明当喜泊芬孵育浓度和光照剂量密度达到一定程度时,其杀伤效应已达到平台期。
3 讨 论
在我国,食管癌的发病率和死亡率仍均居恶性肿瘤的第2位,仅次于胃癌[5]。随着我国肿瘤治疗水平的进展,食管癌的疗效有了一定的提高。光动力治疗PDT在食管癌,尤其是早期食管癌及癌前病变,如Barret食管的治疗上已取得很大进展[6]。目前PDT已成为继放化疗后治疗食管癌的另一重要手段,并且在中晚期食管癌的治疗中取得较好的疗效[7]。居云胜等[8]报道,PDT治疗食管癌的有效率高达76%,并且具有以下优点:(1)能选择性地消灭肿瘤细胞而不损害正常组织;(2)与化疗、放疗有一定协同作用;(3)可以缩小手术的范围和改善手术的预后。PDT的作用原理是光敏剂通过细胞膜进入肿瘤细胞内部与细胞器结合在肿瘤组织中大量积存,光照后所产生单线态氧和大量的氧自由基对其生物膜和线粒体造成损害,从而影响线粒体呼吸链中许多酶,如细胞色素氧化酶、琥珀酸脱氢酶、单胺氧化酶、乳酸脱氢酶、磷酸激酶以及微粒体细胞色素P450的活性,因而减少ATP的合成[9-10]。这些均可直接或间接地影响到肿瘤细胞的增殖。有研究[11]揭示光敏剂在肿瘤细胞中容易积存是因为新生细胞的细胞膜上表达大量的低密度脂蛋白受体(low density lipoprotein receptor,LDLP),而肿瘤细胞细胞膜上具有比静止细胞更多的LDLP。这使得一些易附于LDLP上的亲脂性光敏剂在肿瘤细胞上高度聚集。从PDT作用机制可见,在细胞的体外PDT效应中,光照剂量密度、光敏剂的种类和光敏剂的孵育浓度及孵育时间均可影响其效应。本研究结果表明,喜泊芬的不同孵育浓度和4种不同光照剂量密度的食管癌Eca-109细胞生存率均有显著差异(P<0.01)。在同一光照剂量密度下(除浓度为0 μ g◦mL-1组外),不同喜泊芬孵育浓度的食管癌Eca-109细胞的生存率有显著差异(P<0.01),同一浓度下(除光照剂量密度为0 J◦cm-2组外),不同光照剂量密度的食管癌Eca-109细胞生存率亦有显著差异(P<0.01)。光照剂量密度与孵育浓度之间有显著的交互效应(P<0.01),当孵育浓度和光照剂量密度达到一定程度时,其杀伤效应达到平台期。有研究[12]结果表明,这可能与细胞存在胞内饱和光敏剂浓度相关。因此对于同一种光敏剂,当孵育浓度和光照剂量密度达到一定程度时,增加孵育浓度及提高光照剂量密度并不能提高PDT效应,即杀伤效应达到了平台期。本研究中当光敏剂孵育浓度为15.0 μ g◦mL-1而且光照剂量密度为24 J◦cm-2时达到最佳治疗效应,即使再提升光敏剂浓度和光照剂量密度也无法提高治疗效应。从临床治疗角度上,一旦达到最佳光照剂量密度之后,如再进一步增加光照剂量密度,有可能导致正常组织的损伤,因此不提倡过多的光照剂量。综上所述,在特定孵育时间下,光敏剂孵育浓度及光照剂量密度为影响PDT效应的主要因素,本研究为临床HiPorfin-PDT参数的选择提供一定的实验依据。
1 Rosenthal DI.Gatstein Clinical applications of photodynamic therapy[J].Ann Med,1994,26:405-409.
2 Epstein JH.Phototoxieity and photoallergy[J].Semin Cutan M ed Surg,1999,18(4):74-84.
3 Price M,Reiners JJ,Santlago AM,et al.M onitoring singht oxygen and hydroxy l radical formation with fluorescent probes during photodynamie therapy[J].Photoehem Photobiol,2009,10(3):3-5.
4 尚立群,周乃康,顾瑛,等.竹红菌乙素-PDT与血卟啉衍生物-PDT对食管癌杀伤效应的比较研究[J].肿瘤防治杂志,2005,12(15):1139-1142.
5 孙燕,石远凯.临床肿瘤内科手册[M].第5版.北京:人民卫生出版社,2008:466.
6 Radua,Wagineres G,Vanden BH,et al.Photodynamic therapy of early squamous cell cancers of the esophagus[J].Gastrointest Chin N Am,2000,10(3):430-460.
7 李黎波,罗荣城,廖旺军,等.Photofrin光动力治疗晚期肿瘤近期疗效观察[J].第一军医大学学报,2003,23(12):1341-1343.
8 居云胜,陶祥元.光动力治疗消化道恶性肿瘤的疗效观察[J].中国临床医学,1997,4(3):162-163.
9 Hilf R,Murant R S,Narayanan U,et al.Relationship of mitoehondria function and cellular adenosine triphosphate levels to hematoporphyrin defivatine-induced photosensitization in R3230 AC mammary tumorg[J].Cancer Res,1986,46(1):211-217.
10 Gibson SL,Vander M eid K R,Mutant RS,et al.Increased eficacy of photod ynamie therapy of R3230 AC mamlnary adenecarcinoma by intratumoral injection of photofrin I[J].Br J Cancer,1990,61(4):553-557.
11 张林,虞乐华.光动力疗法作用机制的研究进展[J].中国激光医学杂志,2003,24(2):91-93.
12 刘慧龙,刘凡光,顾瑛.影响光动力疗法的几个主要因素[J].中国激光医学杂志,2005,11(12):121-124.
