无花果曲霉固态发酵中菊粉酶的提取工艺
2010-08-27陈天祥陈寒青陈晓明于阳徐学明金征宇
陈天祥, 陈寒青, 陈晓明, 于阳, 徐学明, 金征宇*
(1.食品科学与技术国家重点实验室,江南大学,江苏无锡 214122;2.江南大学食品学院,江苏无锡 214122)
无花果曲霉固态发酵中菊粉酶的提取工艺
陈天祥1,2, 陈寒青1,2, 陈晓明1,2, 于阳1,2, 徐学明1,2, 金征宇*1,2
(1.食品科学与技术国家重点实验室,江南大学,江苏无锡 214122;2.江南大学食品学院,江苏无锡 214122)
对无花果曲霉固态发酵中菊粉酶的提取工艺进行了研究。主要研究了溶剂种类、提取时间、固液质量体积比、振荡频率和提取温度等因素对酶活的影响,确定了最佳提取工艺:以p H为4.5的0.1 mol/L醋酸缓冲液为提取溶剂,提取时间40 min,固液质量体积比1∶20.5,振荡频率为207 r/min,提取温度39.6℃,菊粉酶的提取得率相对于初始提取条件可以提高50%以上。
无花果曲霉;菊粉酶;固态发酵;提取工艺
菊粉酶是一种主要来源于微生物的多糖水解酶,可催化水解菊粉中的β-2,1糖苷键,生产高果糖浆和低聚果糖[1-3]。低聚果糖是一种水溶性膳食纤维,具有低热能值、抗龋齿、增殖肠道内双歧杆菌等优点,是常用的功能性食品添加剂。利用菊粉酶水解菊粉生产果糖,相对于传统的淀粉转化法,果糖得率可由45%提高到90%以上。菊粉酶的生产,传统方法一般采用液态发酵。近年来,也有学者报道使用固态发酵法生产菊粉酶[4-7]。
固态发酵相对于液态发酵具有成本低、工艺简单、产酶活力高等众多优点,在酶制剂生产上具有巨大的潜力。但在固态发酵中,各种发酵代谢产物在固体曲中高浓度积累,这也为下游工程的处理带来了困难。目前对固态发酵的研究大多集中在微生物发酵方面,对如何有效地把发酵代谢产物从固体曲中提取出来研究较少,而在整个生物工艺过程中,产物的回收成本占整个生产成本的80%以上,因而研究固体曲中发酵产物的提取具有重要意义[8]。Ramadas[9]等利用双水相法从固态发酵基质中提取淀粉葡糖苷酶;Ikasari[10]等研究了不同条件下固体曲中蛋白酶的提取效果;Castilho[11]等采用了不同的实验模型研究了固态发酵中果胶酶的提取;Marcio Mazutti[12]等利用酵母固态发酵甘蔗渣生产菊粉酶,并研究了菊粉酶的提取条件。
作者利用无花果曲霉固态发酵生产菊粉酶,系统研究了固体曲中菊粉酶的提取工艺,主要考察了溶剂种类、时间、温度、振荡频率和固液质量体积比等因素对菊粉酶提取得率的影响。
1 材料和方法
1.1 材料
1.1.1 菌种 无花果曲霉,作者所在实验室保存。
1.1.2 主要试剂和设备 菊粉:优级纯,Sigma公司,用于酶活测定;菊芋粉:由菊芋洗净、去皮、切片,50℃烘干粉碎而得,用于培养基;SW-CJ-1F双人单面超净工作台:苏州安泰空气技术有限公司产品;HYG-A型回转恒温调速摇瓶柜:江苏太仓市实验设备厂产品;UV-2100紫外分光光度计:尤尼科上海仪器有限公司产品;HH-6数显恒温水浴锅:江苏省金坛市仪器制造有限公司产品;THZ-82A水浴恒温振荡器:金坛市荣华仪器制造有限公司产品。
1.1.3 培养基
1)斜面培养基(g/L):马铃薯(洗涤,去皮,切碎)200,葡萄糖15,琼脂20。
2)种子培养基(g/L):菊粉20,蛋白胨20,酵母膏10。
3)固体培养基:250 mL三角瓶中添加固体基质麸皮10 g,菊芋粉11.47%,NH4H2PO40.76 %,NaCl 0.5%,MgSO40.05%,ZnSO40.01%, KH2PO40.1%,玉米浆5.71%,吐温-80 0.5%(均为相对于固体基质的质量分数),固液质量体积比1 g∶1.3 mL,初始p H 5.5。
1.2 方法
1.2.1 培养方法
1)斜面培养方法:30℃培养72 h。
2)种子培养方法:250 mL的三角瓶装液30 mL,121℃灭菌15 min,接种后,30℃、200 r/min摇瓶培养24 h。
3)固态培养方法:接种后,121℃灭菌30 min, 28℃静止培养72 h,期间翻曲3~4次。
1.2.2 菊粉酶的提取 实验所用固体发酵曲均来自同一批发酵样,经混匀后在-20℃冰箱保存备用。每次取出一定量发酵曲,加入一定比例溶剂,振荡提取一定时间后,纱布过滤,获得滤液,然后在5 000 r/min离心机上离心10 min,取上清液,并记录体积[7]。
1.2.3 菊粉酶测定 采用3,5-二硝基水杨酸(DNS)法[8]测定,具体测定方法如下:取0.2 mL粗酶液,加入2 mL底物(质量分数2%蔗糖溶液,用p H4.5的0.2 mol/L醋酸缓冲液配制),50℃反应30 min后,沸水浴5 min使酶失活,然后冷却至室温,测定水解物中还原糖含量。在相同条件下,以直接在沸水浴中加热5 min失活的酶液作对照。菊粉酶活力单位定义为:在上述条件下,以每分钟转化生成1μmol还原糖所需的酶量为一个酶活力单位(U)。
1.2.4 响应面试验 采用可旋转中心组合设计方法进行试验设计,以液固质量体积比、振荡频率、温度3个因素作为自变量,以提取的菊粉酶酶活(Y)为响应值,设计3因素5水平的响应面试验。试验结果利用SAS8.1软件分析。

表1 试验设计因素水平编码表Tab.1 Factors and levels of experimental design
2 结果与讨论
2.1 溶剂种类对菊粉酶提取的影响
溶剂种类对菊粉酶提取效果的差异主要是由于溶剂离子强度和极性的不同。各种溶剂的提取效果如表2所示。

表2 溶剂种类对提取效果的影响Tab.2 Effect of different solvents on inulinase extraction
表2显示,溶剂的使用能减少菊粉酶的损失,其中提取效果最好的是p H 4.5的0.1 mol/L乙酸-乙酸钠缓冲液,相对于蒸馏水提取,菊粉酶酶活提高了22.9%。这与文献报道的结果相似,Marcio Mazutti[12]等利用p H4.8的0.1 mol/L乙酸-乙酸钠缓冲液提取菊粉酶,相对于蒸馏水提取,菊粉酶酶活提高了14.1%。
2.2 响应面试验结果
可旋转中心组合试验设计的结果如表3所示。
通过SAS软件对试验数据进行二次多项回归拟合,得到二次多项式回归模型为:
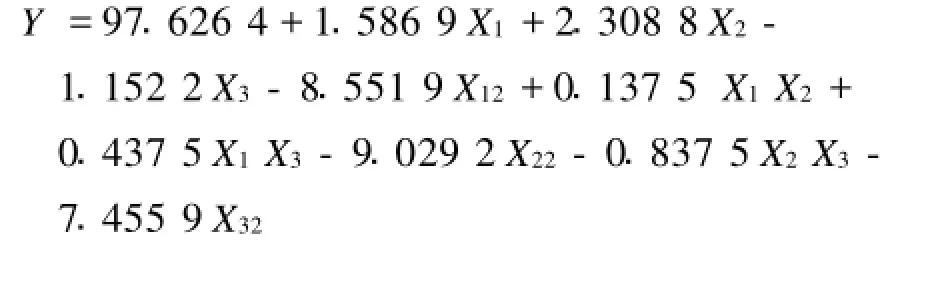
表3 试验设计与结果Tab.3 Experimental design and results
表4方差分析结果显示,该模型极显著((Pmodel>F)=0.0001),SAS软件的分析结果显示,该模型的决定系数为98.96%,表示仅有1.04%的变更无法用该模型解释。因此,该模型与实际情况拟合良好,具有较好的代表性,可以对实验结果进行分析和预测。
表4方差分析显示,X1、X2、X12、X22和X32的置信度均大于99%,对菊粉酶的提取具有极显著影响,X3的置信度大于95%,对菊粉酶的提取具有显著影响。X1X2、X1X3、X2X33项的置信度均小于90%,表明3项之间无明显交互作用。
在提取过程中,酶能否充分溶散在溶剂中影响着提取效果,这不但与溶剂的加入量有关,而且还与溶剂对固体基质的溶解能力有关,提取过程中,振荡可以加快酶在溶剂中的扩散和溶解,但是振荡频率过大会加大酶的机械损伤,从而使酶失活。温度也是影响提取效果的重要因素,温度过低可能会影响固体基质及酶在溶剂中的溶解效果,温度过高则酶的热稳定性下降,酶易失活。
经SAS软件分析,当X1(固液质量体积比)=1 g∶20.5 mL,X2(振荡频率)=207 r/min,X3(温度) =39.6℃时,Y值达到最大,即菊粉酶提取效果最好。
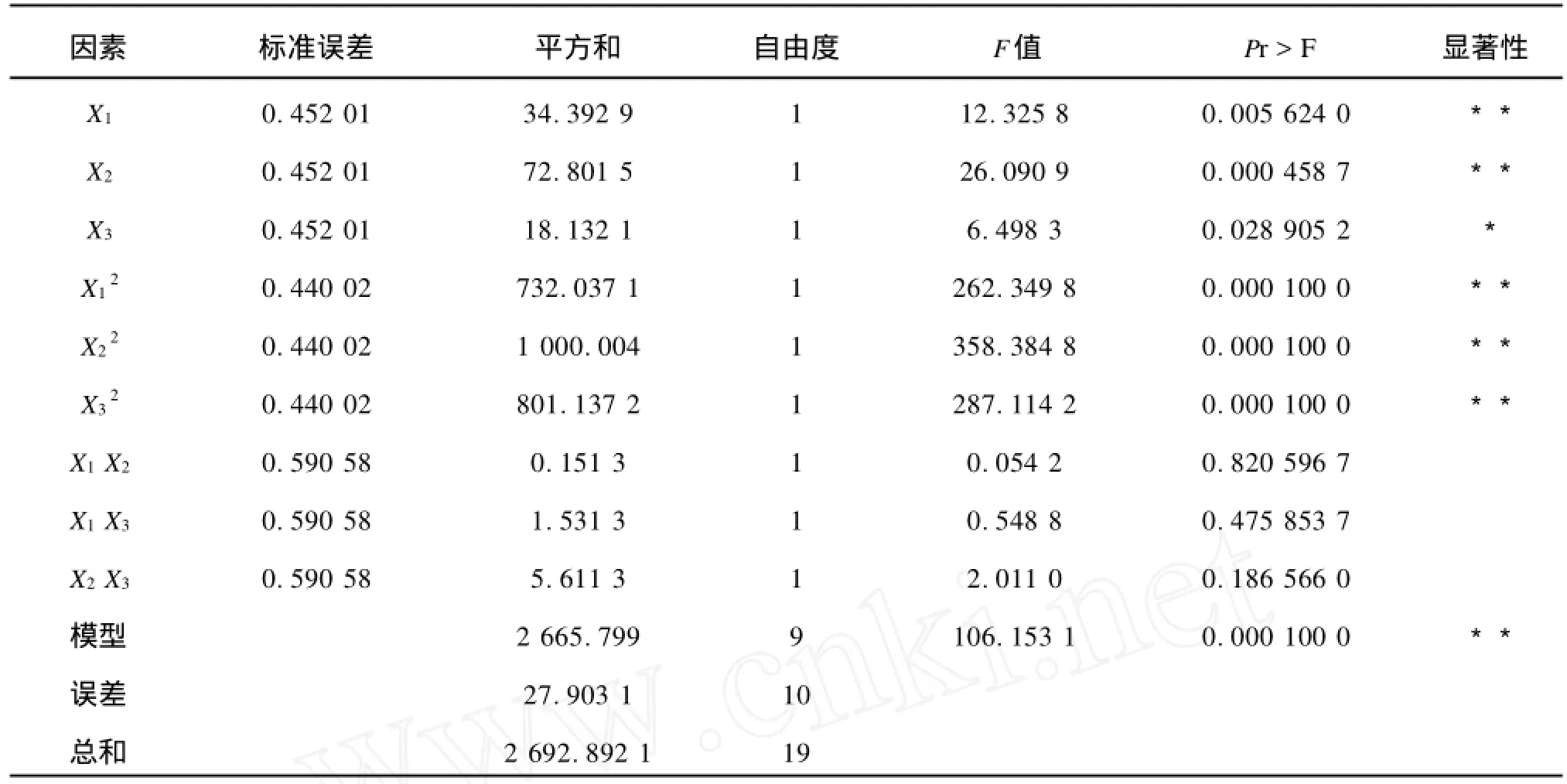
表4 方差分析表Tab.4 Analysis of variance of the regression parameters
2.3 提取时间对菊粉酶提取的影响
在确定了提取溶剂、振荡频率、温度和固液质量体积比等因素后,对菊粉酶提取所需的最佳时间进行了考察。时间的长短与酶的溶散效果、所受的机械损伤程度、热失活程度等都有关系,由图1可知,菊粉酶最佳提取时间为40 min。
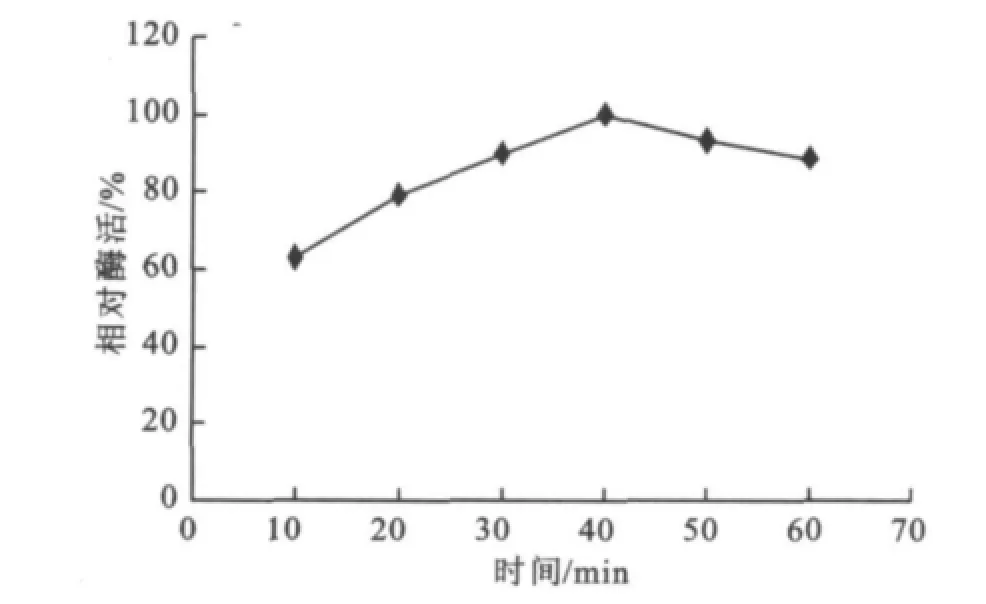
图1 提取时间对菊粉酶提取的影响Fig.1 Effect of time on the extraction of inulinase
根据以上所优化的提取条件,对提取效果进行验证,即在提取溶剂为p H 4.5的醋酸缓冲液,固液质量体积比为1 g∶20.5 mL,振荡频率为207 r/ min,温度39.6℃,提取时间40 min条件下对菊粉酶进行提取,相对于最初的以水为提取溶剂,固液质量体积比为1 g∶20 mL,振荡频率为150 r/min,温度常温,提取时间60 min条件下,菊粉酶的提取得率提高了50%以上。
3 结 语
对无花果曲霉固态发酵中菊粉酶的提取工艺进行了研究,主要考察了溶剂种类、提取时间、温度、振荡频率、固液质量体积比等影响菊粉酶提取效果的因素。菊粉酶最佳的提取工艺为:以p H4.5的0.1 mol/L醋酸缓冲液为提取溶剂,提取时间40 min,固液质量体积比1 g∶20.5 mL,振荡频率207 r/min,提取温度39.6℃,菊粉酶的提取得率,相对于初始提取工艺,可提高50%以上。
[1]谢秋宏,相宏宇.一步酶法水解菊粉生产高果糖浆[J].吉林大学自然科学学报,1997(2):103-105.
XIE Qiu-hong,XIANG Hong-yu.Production of high—fructose syrup by inulinase fromJerusalem artichokes[J].Acta Scientiarium Naturalium Universitatis Jilinensis,1997(2):103-105.(in Chinese)
[2]王静.Aspergillus f icuum菊粉酶及其酶解菊芋制备低聚果糖的研究[D].无锡:江南大学,2003.
[3]彭英云.Aspergillus f icuumSK004产外切菊粉酶及其酶解菊粉制备高果糖浆的研究[D].无锡:江南大学,2005.
[4]Chen X,Wang J H,Li D S.Optimization of solid-state medium for the production of inulinase byKluyveromycesS120 using response surface methodology[J].Biochemical Engineering Journal,2007,34:179-184.
[5]Selvakumar P,Pandey A.Solid state fermentation for the synthesis of inulinase fromStaphylococcus sp.andKluyveromyces marxianus[J].Process Biochemistry,1999,34:851-855.
[6]Mazutti M,Bender J P,Luccio M D,et,al.Optimization of inulinase production by solid-state fermentation using sugarcane bagasse as substrate[J].Enzyme and Microbial Technology,2006,39:56-59.
[7]陈雄,王金华,李世杰.克鲁维酵母固体发酵高产菊粉酶的研究[J].食品科学,2005,26:54-57.
CHEN Xiong,WANG Jin-hua,LI Shi-jie.High yield of inulinase fromKluyveromycesS120 by solid-state fermentation [J].Food Science,2005,26:54-57.(in Chinese)
[8]Pessoni R A B,Figueiredo-Ribeiro R C L,Braga M R.Extracellular inulinases fromPenicillum janczewskii,a fungus isolated from the rhizosphere of Vernonia herbacea(Asteraceae)[J].Journal of Applied Microbiology,1999,87:141-147.
[9]Ramadas M,Holst O,Mattiasson B.Extraction and purification of amyloglucosidase produced by solid state fermentation withAspergillus niger[J].Biotechnology Techniques,1995,9:901-906.
[10]Ikasari K,Mitchell D A.Leaching and characterization of Rhizopus oligosporus acid protease from solid-state fermentation[J].Enzyme and Microbial Technology,1996,19:171-175.
[11]Castilho L R,Alves T L M,Medronho R A.Recovery of pectolytic enzymes produced by solid state culture ofAspergillus niger[J].Process Biochemistry,1999,34:181-186.
[12]Bender J P,Mazutti M A,Luccio M D,et,al.Extraction of inulinase obtained by solid state fermentation of sugarcane bagasse byKluyveromyces marxianusNRRL Y-7571[J].Applied Biochemistry and Biotechnology,2008,149:195-203.
(责任编辑:朱明)
Extraction Technology of Inulinase fromAspergillus f icuum by Solid State Fermentation
CHEN Tian-xiang1,2, CHEN Han-qing1,2, CHEN Xiao-ming1,2, YU Yang1,2, XU Xue-ming1,2, J IN Zheng-yu*1,2
(1.State Key Laboratory of Food Science and Technology,Jiangnan University,Wuxi 214122,China;2.School of Food Science and Technology,Jiangnan University,Wuxi 214122,China)
The target of this study is to develop a efficient extract process of inulinase fromAspergillus f icuumby solid state fermentation.For this,the extract process parameters were carefully investigated and listed as follows:0.1 mol/L sodium acetate buffer of p H 4.5 was used for extraction solvent,the ratio of solid to liquid of 1:20.5,temperature of 39.6 C,stirring rate of 207 r/min,extraction time of 40 min.By the optimum conditions,the enzyme recovery yield was increased by more than 50%,when compared with that of the initial conditions.
Aspergillus f icuum,inulinase,solid-state fermentation,extraction technology
Q 814.1
:A
1673-1689(2010)03-0421-05
2009-06-25
国家863计划项目(2006AA10Z333),中国博士后科学基金项目(20070420968),江苏省博士后科研资助计划项目(0801007B)。
*通信作者:金征宇(1960-),男,江苏扬州人,工学博士,教授,博士生导师,主要从事碳水化合物研究。Email:jinlab2008@yahoo.com
