高热对局灶性脑缺血再灌注大鼠缺血灶5-LO表达的影响
2010-07-13胡成伍夏加琴吴家幂
胡成伍 夏加琴 吴家幂
1)湖北潜江市中心医院 潜江 433100 2)安徽芜湖市第一人民医院 芜湖 241000 3)皖南医学院弋矶山医院 芜湖241001
关于脑缺血再灌流期间高热对脑缺血损伤的作用,迄今国内外研究结果不一致[1-2]。本工作在大鼠局部脑缺血再灌注不同时间点给予短暂高热,探讨高热对缺血性脑损伤的作用,为临床对急性脑卒中患者的治疗提供实验依据。
1 材料与方法
1.1实验分组健康雄性Sprague-Dawley大鼠66只,鼠龄3~4个月,体质量 275~325 g,由南京青龙山实验动物养殖中心提供。动物随机分为3组:假手术(Sham)组(n=6),缺血再灌注后正常体温组(normathermia,NT)组(n=30),缺血再灌注组后高热(hyperthermia,HT)组(n=30)。CIR后NT组和HT组分别按12 h后、24 h后、48 h后、72 h后、120 h后再各分5个亚组(n=6)。假手术组再分为NT和HT)2个亚组(n=3)。
1.2大鼠局部脑缺血再灌流模型的制备参照Zea Lon-ga[3]方法制备大鼠脑缺血再灌流模型,脑缺血2 h后将尼龙丝线拔出,退至颈外动脉内恢复再灌流,假手术组插尼龙线深度为小于10 mm。扎紧备线,外留10 mm长线头,缝合皮肤。手术全过程应用100W 灯泡照明,调节灯泡至大鼠的距离,以保持大鼠肛温为(37.0±0.5)℃。插入栓线2h后,回抽栓线使其头端回到颈外动脉内,恢复颈内动脉血流,实现再灌注。
1.3大鼠体温调控参照L.A.Favero-Filho等[4]的实验方法使用100 W白炽灯及恒温控制器升高大鼠肛温。期间大鼠自由饮水。加温干预时间分别为 CIR11 h、23 h、47 h、71 h、119 h后。加温时间为1 h。大鼠 CIR模型成功后,每隔12 h测量体温,升高体温干预开始后每隔15 min测量大鼠肛温。保持大鼠肛温39.0~39.5℃。如果大鼠在加温前和常温组大鼠在各时间点前出现体温异常(<37.0℃或>38.0℃)则被剔除。
1.4神经功能缺损评分及模型成功标准模型成功的标准以Zea Longa 5分法[3]为评分标准:0分,无神经缺损症状;1分,提尾时瘫侧前肢内收,不能完全伸直;2分,行走时向瘫侧倾倒;3分,行走时向瘫侧旋转;4分,不能行走或昏迷。评分为1~3分者为成功模型。未达到上述标准者视为模型制作失败,不计入实验组。因麻醉未清醒者以及清醒后死亡经解剖发现存在蛛网膜下腔出血的也视为模型制作失败不计入实验组。
1.5脑梗死体积测定及免疫组化染色取大鼠脑组织后,从视交叉前缘始向后作2 mm厚冠状位脑组织块,将除纹状体平面外的脑组织置于2%TTC染色,再用4%多聚甲醛固定3~5 h后的脑组织数码相机(微距,且用三角架固定焦距)拍取照片,然后采用计算机图像分析软件计算大鼠脑梗死体积。纹状体平面的脑组织的梗死体积的取其相邻两个脑片梗死体积之和的平均值[5]。将纹状体平面脑组织切片制成蜡块。脑组织蜡块标本进行5 μ m厚的连续切片。每间隔5片选1片行常规HE染色,光镜下观察形态学改变。剩余切片用兔抗鼠多克隆抗体ALOX5ABC(武汉博士德公司提供)免疫组化染色。
1.6统计学方法实验数据正态资料以均数±标准差表示,应用SPSS 11.5软件进行资料处理,2组均数间比较t检验,方差不齐时,用Tamhane's T2检验。双变量关系采用直线相关分析,非正态资料使用Mann-Whitney U检验,检验水准均为α=0.05。
2 结果
2.1神经功能缺损评分CIR后NT组和CIR后HT组各时间点神经功能缺损评分与假手术组相比明显增加,比较都有统计学意义(P<0.05)。CIR后N T组大鼠清醒后出现神经功能缺损症状,12 h后症状进展,24 h后继续发展、48 h后最严重,3个时间点神经功能缺损评分差异无统计学意义(P>0.05)。CIR NT组大鼠神经功能缺损评分自72 h后即下降。CIR HT组12 h、24 h、48 h的神经功能缺损评分较CIR NT组相应时间点增加,差异有统计学意义(P<0.05)。CIR HT组72h、120h的神经功能缺损评分较 CIR NT组相应时间点增加,但差异无统计学意义(P>0.05)。见表1。
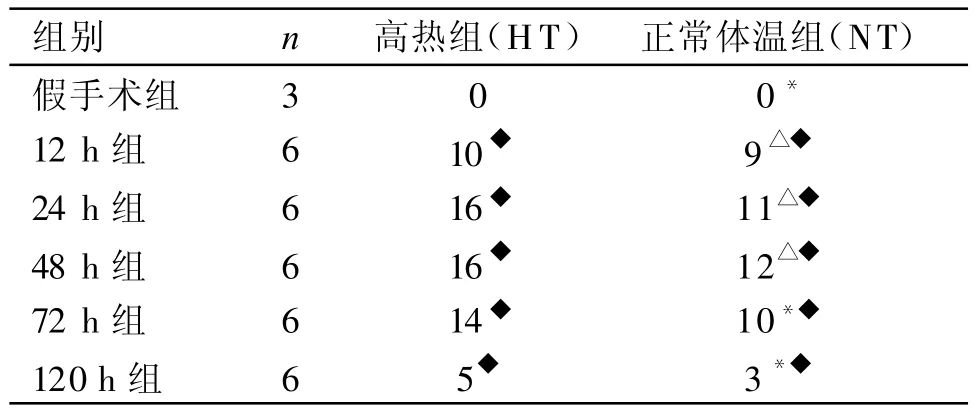
表1 各组神经功能缺损评分比较
2.2脑缺血再灌注后高热对梗死体积和梗死灶周边皮质5-LO表达的影响CIR后NT组和CIR后HT组梗死体积与假手术组相比明显增加,差异均有统计学意义(P<0.05)。CIRNT组72 h后梗死体积逐渐减少,120 h后梗死体积最小。虽然CIR NT组72 h、120 h梗死体积较 HT组 72 h、120 h增加,但差异无统计学意义(P>0.05)。假手术HT组和NT组纹状平面脑组织有少量5-LO表达,主要位于神经元细胞内,为棕黄色颗粒,细胞形态正常。CIR NT组和HT组12 h、24 h、48 h后梗死中心,都有少量 5-LO阳性神经元细胞存在,半暗带皮质可见5-LO阳性神经元细胞明显增多,胞浆及胞膜均有5-LO表达,但以胞浆明显。
表2 5-LO表达与梗死体积 (mm3,s)
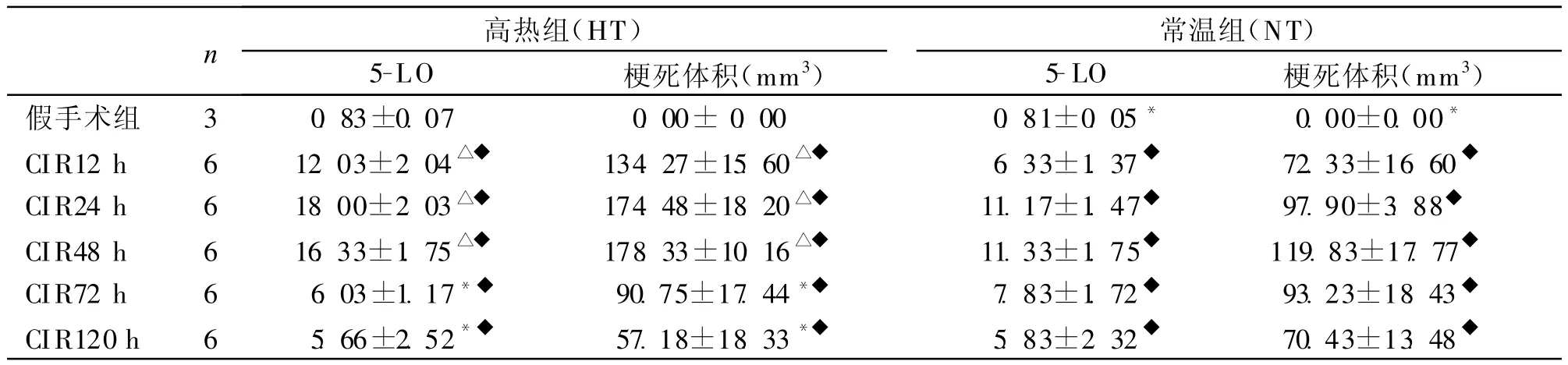
表2 5-LO表达与梗死体积 (mm3,s)
注:HT与 NT比较,*P>0.05,两两比较,△P<0.05;HT、NT分别与假手术组比较,◆P<0.05;r=0.649,P<0.05
n 高热组(HT)常温组(NT)5-LO 梗死体积(mm3)5-LO 梗死体积(mm3)假手术组 3 0.83±0.07 0.00±0.00 0.81±0.05* 0.00±0.00*CIR12 h 6 12.03±2.04△◆ 134.27±15.60△◆ 6.33±1.37◆ 72.33±16.60◆CIR24 h 6 18.00±2.03△◆ 174.48±18.20△◆ 11.17±1.47◆ 97.90±3.88◆CIR48 h 6 16.33±1.75△◆ 178.33±10.16△◆ 11.33±1.75◆ 119.83±17.77◆CIR72 h 6 6.03±1.17*◆ 90.75±17.44*◆ 7.83±1.72◆ 93.23±18.43◆CIR120 h 6 5.66±2.52*◆ 57.18±18.33*◆ 5.83±2.32◆ 70.43±13.48◆
CIR HT组和NT组分别与假手术组相比脑组织5-LO阳性神经元细胞数增加,有统计学意义(P<0.05)。CIR HT组12 h、24 h、48 h后半暗带皮质5-LO阳性神经元细胞数较CIR NT组相应时间点增加显著(P<0.05)。CIR HT组72 h、120 h后半暗带皮质神经元细胞虽然仍有5-LO表达,但较CIR NT组相应时间点增加不明显(P>0.05)。CIR后缺血灶周边神经元5-LO与梗死体积存在正相关(r=0.649,P<0.05)见表2。
3 讨论
脑血管疾病是目前危害人类健康的三大疾病之一。其中缺血性脑血管疾病以其高发病率、高致残率和高死亡率而严重危害人们的身体健康。临床中常发现缺血性脑卒中后患者体温升高,体温升高的原因主要为感染,其次为缺血性脑卒中影响下丘脑体温中枢而引起体温升高[6]。
结果发现CIR HT组神经功能缺损评分12 h、24 h、48 h后组比NT组相对应时间点增加;CIR HT组72 h、120 h后较NT组神经缺损评分虽有增加,但无统计学意义。因为神经功能缺损与损伤范围并非总是相关[7],因此本实验又采用另一更加直接的指标—脑梗死体积来观察大鼠CIR后高热对脑组织的影响。HT组和NT组12 h后见明显梗死病灶,24 h后体积逐渐增大,48 h后梗死体积达到高峰。72 h后梗死体积逐渐减少,120 h后梗死体积最小。HT组12 h、24 h、48 h梗死体积较NT组相应时间点明显增加,通过HT组与NT组之间梗死体积的比较更加说明缺血性脑卒中48 h内高热可加重脑损伤。其原因可能由于短暂脑缺血再灌流早期脑缺血细胞的结构和功能尚未完全恢复,此时再灌流损伤及高温的共同作用使许多可逆的脑缺血细胞进入不可逆状态,增加脑梗死体积,在再灌流晚期,再灌流损伤作用的减弱或消失,缺血半暗带中可逆状态的缺血脑细胞基本恢复了正常功能,可通过自身保护机制抵御高热造成的损伤,因此随再灌流时间的延长,高热对脑缺血损伤的作用趋于不明显。高热对大鼠CIR后加重脑损伤的机制可能有:①高热能通过辣椒素受体3(Transient receptor potential vanilloid 3,TPRV3)引起细胞内钙超载,加重神经损伤。Xu H等[8]报道当温度从22℃升高到40℃,TRPV3可被激活,并在一定范围内随温度升高电流增大。已有研究表明高热刺激通过TRPV3受体引起钙内流[9]。②脑卒中后的高热可促进氨基酸递质的释放。③脑卒中后的高热可使氧自由基增多,可加重血脑屏障的损害[10]。
虽然高热可能通过以上机制加重脑损伤,但是其具体机制仍不清楚。最近研究发现5-LO与脑缺血再灌注损伤有密切关系。Manu Jatana等[11]研究使用5-LO抑制剂BW-B 70 C和AA-861作为干预后发现5-LO抑制剂干预组大鼠局灶性脑缺血再灌注24 h后梗死体积较对照组缩小、神经功能缺损评分改善。该研究虽然说明5-LO可以加重脑缺血再灌注损伤,但一直以来,CIR后高热与5-LO之间的关系研究较少。本实验中假手术HT组脑组织神经元5-LO表达很少,与假手术NT组相比没有增加,说明短暂高热对正常脑组织的影响较小。而且HT组12 h、24 h、48 h时缺血灶周边神经元5-LO表达比NT组明显增加;CIR72 h后NT组比HT组缺血灶周边神经元5-LO表达虽有增加,但无统计学意义。实验结果说明高热能使CIR48 h内缺血灶周边神经元5-LO表达增加,同时提示大鼠CIR后缺血灶周边神经元5-LO表达能够加重脑损伤,而且5-LO表达越多,梗死体积越大,二者之间存在正相关。解释这一结果的可能原因为随着再灌注时间延长,CIR后缺血半暗带逐渐减少,这样CIR48 h后缺血灶周边神经元对高热等伤害性刺激无反应,5-LO表达减少,所以高热对大鼠CIR后加重脑损伤的时间窗为CIR后48 h内。高热使缺血灶周边神经元5-LO表达虽有增加的机制可能为①高热能通过TPRV3受体引起细胞内钙内流,而钙离子能够诱导5-LO膜聚集。而细胞内钙离子超载可以能够诱导5-LO膜聚集。②高热能促进蛋白激酶及其磷酸化活化[12]。P38蛋白激酶被磷酸化活化,并通过磷酸化活化转录因子调控特定基因的表达,继而可在细胞内钙参入下激活5-LO。
虽然高热可能通过上述途径促进缺血性脑卒中后5-LO表达进而加重脑损伤,但是否存在其他途径有待进一步研究。尽管如此,临床上缺血性脑卒中如果患者出现高热(48h内),都应该给予积极的干预以减少患者脑损伤。
[1]Reith JJ,rgensen HS,Pedersen PM,et al.Body temperature in acute stroke:relation to stroke severity,infarct size,mortality,and outcome[J].Lancet,1996,347:422-425.
[2]Leira R,Rodr íguez-Yáez M,Castellanos M.Hyperthermia is a surrogate marker of inflammation-mediated cause of brain damage in acute ischaemic stroke[J].Journal of Internal Medicine,2006,260:343-349.
[3]Zea Longa,Weinstein PR,Carlsons et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20:84-91.
[4]Favero-Filho1 LA,Borges AA,Grassl C,et al.Hyperthermia induced after recirculation triggers chronic neurodegeneration in the penumbra zone of-focal ischemia in the rat brain[J].Brazilian Journal of Medical and Biological Research,2008,41:1 029-1 036.
[5]梁泽华,魏尔清,朱朝阳,等.图像分析定量测量脑片体积方法的改良[J].浙江大学学报(医学版),2003,32:697.
[6]Fuhai Li,Tsuy oshi Omae,Marc Fisher.Spontaneous hyperthermia and its mechanism in the intraluminal suture middle cerebral artery occlusion mode of rats[J].Stroke,1999,30:2 464-2 467.
[7]李捷,张蓬勃,刘勇.对大鼠局灶性脑缺血后神经功能障碍判断方法的改进[J].第四军医大学学报,2003,24:1 970-1 972.
[8]Xu H,Ramsey IS,Kotecha SA,et al.T RPV3 is a calcium-permeable temperature sensitive cation channel[J].Nature,2002,418:181-186.
[9]Smith GD,Gunthorpe M J,Kelsell RE,et al.T RPV3 is a tem-perature-sensitive vanilloid receptor-like protein[J].Nature,2002,418:186-190.
[10]Eugene A Kiyatkin,Brown P Leon,Hari S Sharma.Brain edema and breakdown of the blood–brain barrier during methamphetamine intoxication:critical role of brain hyperthermia[J].European Journal of Neuroscience,2007,26:1242-1253.
[11]Manu Jatana,Shailendra Giri,Mubeen A Ansari,et al.Inhibition of NF-κ B activate-on by 5-lipoxygenase inhibitors protects brain against injury in a rat model of focal cerebral ischemia[J].Journal of Neuroinflammation,2006,3:1-12.
[12]Fukunaga K,Miyamoto E.Role of M AP kinase in neurons[J].M ol Neurobiol,1998,16:79-95.
