质粒pcDNA3.1-IL-24的制备和纯化
2010-07-09韩依辰殷玉和刘新涛吴丛梅
韩依辰, 殷玉和, 孙 博, 刘新涛, 吴丛梅*
(1.长春工业大学化学与生命科学学院,吉林长春 130012;2.长春百克药业,吉林长春 130021)
0 引 言
IL-24(白细胞介素-24)具有免疫调节作用。研究证实,IL-24基因可以有效杀伤肿瘤细胞,促进旁观者抗肿瘤效应[1],诱导肿瘤细胞凋亡。同时,对正常组织却没有损伤,是一种理想的肿瘤治疗基因[2-4]。研究发现,重组质粒pcDNA3.1-IL-24能高效表达白细胞介素-24,以此质粒作为载体导入靶细胞进行肿瘤基因治疗有较广阔的应用前景。因此,探索大规模制备、纯化质粒DNA的工艺即成为重要的研究任务。
然而,在大肠杆菌细胞溶解产物中,质粒DNA仅仅占全部核酸的2%(w/w),大量存在的RNA和蛋白质必须在后续步骤中除去。由于DNA难于与RNA有效分离,在制备质粒DNA时,不得不引入外源RNA酶A(RNaseA)以去除RNA杂质,这就使得最终产品存在一定的安全隐患[5]。为克服质粒DNA制备过程中有毒化学物质和动物源性酶类污染及杂质去除不彻底等缺陷,本研究探讨了质粒DNA的纯化方法,即利用异丙醇和LiCl沉淀法初步去除大分子RNA和蛋白,然后,以DEAE Sepharose FF离子交换层析法去除染色体DNA、小分子RNA、蛋白质等关键杂质,并对最终产品进行质量检测,为大规模制备基因治疗用质粒DNA奠定基础。
1 材料和方法
1.1 质粒与菌株
pcDNA3.1-IL-24质粒由吴丛梅博士构建[6],含有氨苄青霉素抗性基因为筛选标记基因,大小为7.6 kb。大肠杆菌E.coli DH5α由吉林大学疫苗中心保存。
1.2 试剂及仪器
胰蛋白胨、酵母提取物;
阴离子交换层析柱填料DEAE Sepharose FF,购自美国GE公司;
BCA蛋白检测试剂盒,购自Pierce公司;
多功能自控发酵罐为New Brunswick Scientific公司BIOFLO 5000 40 L发酵罐;
核酸蛋白检测仪,购自美国Pharmacia公司;酶标仪,购自Beckman公司。
1.3 细菌发酵
大肠杆菌感受态细胞按文献[7]进行。将质粒pcDNA3.1-IL-24转化感受态细胞[8]。挑取单个菌落,接种4 mL M9培养液,过夜培养后接种2 L M9培养液,继续培养4~6 h,作为发酵菌种。发酵菌种接种发酵基础培养基(蛋白胨2 g/L,酵母提取物5 g/L,K2HPO47 g/L,Na2HPO46 g/L,(NH4)2SO42 g/L,葡萄糖5 g/L,硫酸镁2 g/L,Amp 100 μ g/mL)后,按20 L发酵规模于37℃培养,6 h后流加4 L补充培养基(葡萄糖100 g/L,酵母提取物20 g/L,干酪素10 g/L,Amp 100 μ g/mL),继续培至溶氧值迅速上升。16 h结束发酵,离心收集菌体,称重后保存于-20℃。
1.4 碱性裂解提取质粒
取640 g发酵菌体,重悬于5 L溶液Ⅰ(50 mmol/L葡萄糖,25mmol/LTris-HCl,10 mmol/L EDTA,pH值为8.0)中,充分混匀,冰浴10 min。随即缓缓加入5 L溶液Ⅱ(0.2 mol/L NaOH,2%SDS),温和混匀后,冰浴5 min。然后立即加入5 L冰预冷的溶液Ⅲ(3 mol/L乙酸钾),充分混匀,冰浴30 min。加入5 L CaCl2(2 mol/L),冰浴2 h。4层灭菌纱布过滤,离心(4 000 r/min,30 min),得到澄清裂解液。
1.5 质粒DNA粗纯
将澄清裂解液中加入0.6倍体积异丙醇,室温放置30 min,12 000 r/min,离心30 min,收集沉淀,重悬于150 mL TE溶液中,待沉淀完全溶解,加入等体积5 mol/L冰预冷的LiCl,混匀后,室温放置30 min,12 000 r/min,离心30 min。取上清液,加入等体积异丙醇,混匀,室温放置1 h,室温下,12 000 r/min,离心10 min。
1.6 DEAE Sepharose FF离子交换柱精纯质粒DNA
将色谱填料DEAE Sepharose FF按产品说明填装到色谱柱中,用流动相Ⅰ(0.5 mol KAc,pH值为5.5)平衡色谱柱,含有质粒DNA的样品上柱后,再用流动相Ⅰ平衡,然后分别用流动相Ⅱ(0.3 mol NaC1,25 mmol Tris,10 mmol EDTA,pH值为8.0)、流动相Ⅲ(0.5 mol NaC1,25 mmol Tris,10 mmol EDTA,pH值为8.0)洗脱,流速为40 mL/min,分别收集洗脱峰进行检测,流动相Ⅳ(2 mol NaCl,0.5 mol NaOH)在位清洗。
1.7 质粒DNA的质量评价
1.7.1 残留蛋白质检测
用BCA蛋白检测试剂盒检测样品中蛋白质浓度。100 μ L样品与100 μ L BCA试剂反应,37℃水浴放置30 min,检测其在562 nm处的吸收值。
1.7.2 DNA纯度检测
采用分光光度法对质粒DNA进行定量,在260 nm和280 nm两个波长下读数。在260 nm的读数用于计算样品中的DNA浓度,即1OD260=50 μ g双链DNA;根据260 nm和280 nm读数的比值(OD260/OD280)估算DNA的纯度。
1.7.3 抗生素残留试验
抗生素检定培养基按说明书制备。阳性对照为氨苄青霉素,以生理盐水为阴性对照。不锈钢管(内径0.5 cm,高1 cm)内装液体200 μ L。将已过夜活化的枯草杆菌用无菌水稀释,混匀,均匀涂布到抗生素检定培养基平板上,放平,凝固。在上述测定板上均匀放置不锈钢管,分别加入阳性对照氨苄青霉素200 μ L,生理盐水、待测质粒各200 μ L。标号后,38℃下培养24 h,观察抑菌圈情况并拍照。
2 实验结果
2.1 质粒DNA精纯
EAE Sepharose FF纯化pcDNA3.1-IL-24色谱图如图1所示。
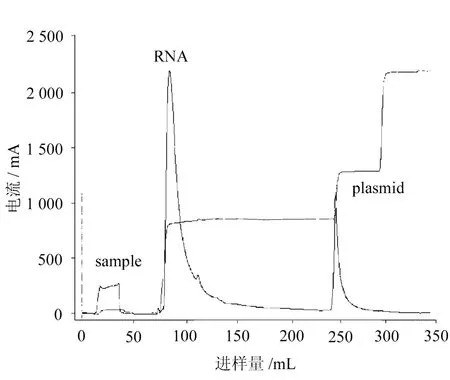
图1 DEAE Sepharose FF纯化pcDNA3.1-IL-24色谱图
从洗脱曲线及电泳结果可见,NaCl浓度为0.3 mol/L时,RNA被洗脱下来,见图1中“RNA”峰。NaCl浓度为0.5 mol/L时,出现质粒DNA洗脱峰,见图1中“plasmid”峰。
经DEAE Sepharose FF离子交换色谱纯化后,RNA被有效去除,电泳未检测到RNA残留,如图2所示。
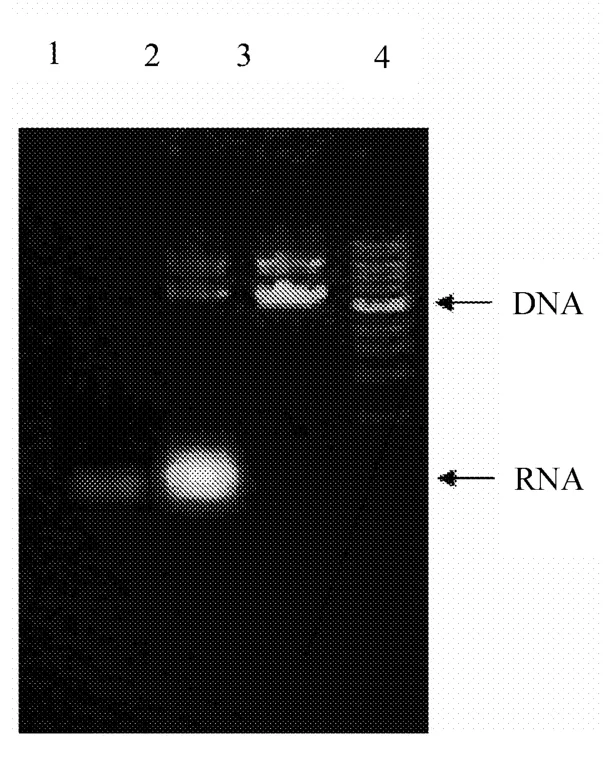
1.RNA洗脱峰;2.质粒原样;3.DNA洗脱峰;4.Marker
2.2 质粒DNA中残留蛋白质检测
BCA标准曲线如图3所示。
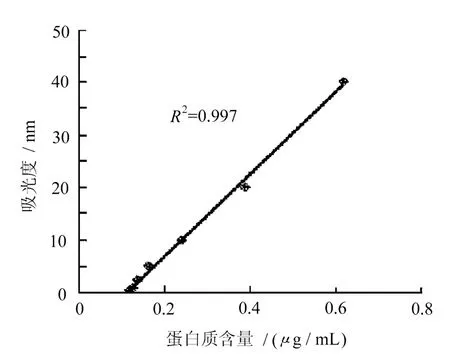
图3 质粒DNA的BCA蛋白标准曲线
其相关系数R2为0.997,具有较好的直线性相关性。检测结果显示,精纯后杂质蛋白的含量为0.007 μ g/mL质粒DNA,说明本纯化工艺能有效去除质粒DNA中的蛋白杂质。
2.3 质粒DNA的浓度和纯度
采用分光光度法对生产的质粒DNA定量,质粒DNA浓度为727 μ g/mL,A260/A280值为1.87,制备的质粒DNA具有较高的纯度。
2.4 质粒DNA抗生素残留检查
观察抑菌圈情况并拍照,结果如图4所示。
测定板上阳性对照氨苄青霉素孔可见明显的抑菌圈,而生理盐水和质粒DNA样品孔无抑菌圈,即无抗生素残留。

图4 质粒DNA抗生素检测图
3 讨 论
下游工艺中纯化质粒DNA的经典方法是氯化铯-溴化乙锭梯度离心法。此方法过程复杂,耗时长,且使用了有毒物质溴化乙锭,就安全性而言,不适用于药用级质粒DNA的生产。除此方法外,还有各具特色的质粒纯化试剂盒可供选择,这些商业试剂盒纯化效果好,却因为价格昂贵不能应用于大规模生产。在本工艺中,先通过高盐沉淀来去除大分子RNA、蛋白质、宿主DNA聚凝物,再通过离子交换色谱进行质粒纯化,可有效去除内毒素等主要杂质[9-10]。
考虑到经济合理性和产品安全性,本工艺生产流程避免使用有毒试剂(苯酚、氯仿)和动物源性酶类(RNA酶),确保了产品的安全性的同时,也减少了检测有毒试剂残余量的繁琐步骤;本工艺大量使用的国产试剂价格低廉,材料和设备可以再生使用。生产周期较短,具有良好的经济性,可以满足实际生产需求;此外,本工艺操作简单、易于放大、重复性好,并且建立了相应的质粒DNA质量检测体系,对于药用级质粒DNA大规模制备具有重要的现实意义,也为同类研究奠定了理论基础,为进一步的工业化生产提供了借鉴。
[1] Fisher PB.Is mda-7/IL-24 a“Magic Bullet”for cancer[J].Cancer Res.,2005,65(22):10128-10138.
[2] Su Z Z,Lebedeva I V,Sarkar D,et al.Ionizing radiation enhances therapeutic activity of mda-7/IL-24:overcomingradiation-and mda-7/IL-24-resistance in prostate cancer cells overexpressing the antiapoptotic proteins bcl-xL or bcl-2[J].Oncogene,2006,25:2339-2348.
[3] Madireddi M T,Su Z Z,Young C S,et al.Mda-7,a novel melanoma differentiation associated gene with promise for cancer gene therapy[J].Adv.Exp.Med.Biol.,2000,465:239-261.
[4] Saito Y,Miyahara R,Gopalan B,et al.Selective induction of cell cycle arrest and apoptosis in human prostate cancer cells through adenoviral transfer of the melanoma differentiation-associated-7(mda-7)/interleukin-24(IL-24)gene[J].Cancer.Gene.T-her.,2005,12:238-247.
[5] Tan P H,Chan C L,George A J.Strategies to improve non-viral vectors-potential applications in clinical transplantation[J].Expert.Opin.Biol.Ther.,2006,6(6):619-630.
[6] 刘永哲,吴丛梅,倪冠英,等.IL-24基因联合电离辐射对前列腺癌PC-3细胞凋亡的影响[J].吉林大学学报:医学版,2008,34:171-174.
[7] 李 霄,金宁一,米志强,等.联合应用凋亡素基因新城疫病毒HN基因及IL-18基因对黑色素瘤的抑制效应研究[J].高技术通讯,2005,14(12):33-36.
[8] 萨姆布鲁克J,弗里奇E F,曼尼阿蒂斯.分子克隆实验指南[M].金冬雁,黎孟枫,译.2版.北京:科学出版社,1992:26-99.
[9] 蒋国润,周东霞,孙 明,等.层析技术纯化核酸疫苗[J].中国生物制品学杂志,2007,20(2):129-132.
[10] 皮文辉,孙从建,宋志强,等.质粒DNA的阴离子交换色谱法纯化及内毒素去除[J].色谱,2007,25(6):809-813.
