基于壳聚糖-硅溶胶复合膜固载甲苯胺蓝及纳米金的新型电流型过氧化氢生物传感器的研究
2010-06-26李文娟柴雅琴
孙 妮,李文娟,袁 若,柴雅琴
(西南大学化学化工学院,重庆市分析化学重点实验室,重庆400715)
0 引言
在生物传感器的构建中,关键技术之一就是如何将生物活性分子稳定、高活性地固定到电极表面[1~2]。壳聚糖(CS)是一种天然多糖,具有生物降解性、无毒性及良好的生物兼容性[3]等诸多优点,在生物传感器中已经被广泛用做酶的固载基质[4~6]。在该实验中,用一种硅烷偶合试剂氨丙基三乙氧基硅烷(APTES)交联壳聚糖,形成的杂化复合材料可以克服纯粹溶胶凝胶衍生的硅酸盐材料的脆度和皱缩度,而且可以提供一个适中的疏水环境以便染料分子的固定,并且允许分析物透过该材料[7]。同时酶可以包裹到复合材料中而无需共价结合,因此可以保持其良好的生物活性。
然而,壳聚糖复合膜导电性差,这是其在生物传感器应用中的一个重要问题。鉴于纳米材料优异的电子传输能力,可以采用纳米材料包括纳米颗粒、纳米管、量子点和纳米线等来提高壳聚糖复合膜的导电性。由于纳米金具有易制备、生物兼容性好,比表面积大和能提供一个与酶蛋白本身相似的环境等优点,已经被用来固载葡萄糖氧化酶[8]、辣根过氧化氢酶[9]和抗体[10],同时保持这些生物大分子的活性。故该实验中,选择纳米金(GNPs)来改变其导电性。
在该实验中,尝试联合壳聚糖/硅溶胶凝胶复合物(CSHMs)和纳米颗粒的优点来研究酶的电化学和电催化性能。纳米金用来改变导电性,甲苯胺蓝作为电子媒介体,壳聚糖复合膜作为生物分子的固载基质,Nafion用来防止酶和甲苯胺蓝的泄露。选用辣根过氧化氢酶为模板酶蛋白,将其混入CSHMs-TB-GNPs溶液中,并将其滴涂在玻碳电极上,制备了Nafion/CSHMs-TB-GNPs-HRP/GCE生物传感器。利用紫外吸收光谱分析修饰膜的组成,用循环伏安和计时电流法表征传感器性能。该实验所构建的传感器对过氧化氢响应快,为生物传感器的发展提供了一个有前途的平台。
1 实验部分
1.1 仪器与试剂
CHI 660A型电化学工作站(上海辰华仪器公司),电化学反应池为三电极体系:修饰了酶膜的玻碳电极为工作电极,铂丝电极为对电极,饱和甘汞电极(SCE)为参比电极。Lambda 17 UV-VIS 8500(PE Co,USA)紫外分光光度计 (300~750 nm)。GNPs的粒径由H-600透射电子显微镜(TEM,日立公司)测定。辣根过氧化物酶(HRP,250 U/mg),氨丙基三乙氧基硅烷,壳聚糖,Nafion,氯金酸和柠檬酸钠均购自美国Sigma公司,甲苯胺蓝购自上海化学试剂公司,H2O2(30%,水溶液)购自重庆化学试剂公司,其它试剂均为分析纯试剂,实验用水为二次蒸馏水。用柠檬酸钠还原氯金酸水溶液制备纳米金(粒径约为 16 nm)[11]。
1.2 酶电极的制备
玻碳电极(GCE,φ =4 mm)依次用 0.3 μm、0.05 μm的Al2O3粉末进行抛光。抛光后所得电极依次用乙醇、二次蒸馏水进行超声清洗5 min。
将 APTES与 0.1%的 CS在 HCl的作用下,在室温条件下交联反应 2 h,即制得CSHMs。取 10 μL CSHMs 储备液, 10 μL HRP(pH7.0,2 mg/mL HRP),10 μL GNPs 及 5 μL 1.0 mmol/L 的TB充分混合。然后取8 μL该混合液滴涂在洁净的玻碳电极表面,在冰箱放置过夜成膜,取出后用PBS冲洗,放置晾干,然后在电极表面滴涂2.0 μL 0.25%Nafion 封闭 CSHMs-TB-GNPs-HRP 膜层,最终制得Nafion/CSHMs-TB-GNPs-HRP/GCE修饰电极。修饰好的电极置于冰箱(4℃)中保存。
按照同样的方法制备对比实验所需的Nafion/HRP-TB-CSHMs/GCE修饰电极和Nafion/GNPs-TB-CSHMs/GCE修饰电极。图1为电极制备示意图。
2 结果与讨论
2.1 紫外吸收光谱
图2 所示是 (a)CS 溶液,(b) 硅溶胶,(c)CSHMs,(d)GNPs,(e)GNPs 和 CSHMs 的混合溶液,(f)HRP,GNPs和 CSHMs 的混合溶液的紫外吸收光谱图。 从(a)(b)(c)可以看出,当将 CS 溶液加入硅溶胶后,峰形几乎没有变化,表明在CS溶液中硅溶胶可以保持其化学性能不变。曲线(d)在524nm处有一处强吸收峰,该峰为GNPs的特征吸收峰。当GNPs与CSHMs混合后的曲线(e)表明GNPs和CSHMs之间发生了相互作用[12],并且使GNPs的表面发生了变化,从而引起光谱图上的变化。HRP加入GNPs和CSHMs的混合溶液中以后(f),在大约416 nm处有一个强烈的吸收峰,此峰是HRP的特征吸收峰,表明在混合溶液中HRP可以保持其本身的结构和生物活性。从图2可以得到以下结论:CSHMs、GNPs及HRP可以彼此混合,并且保持它们各自的化学性能,为实验的准备工作提供了可行性依据。
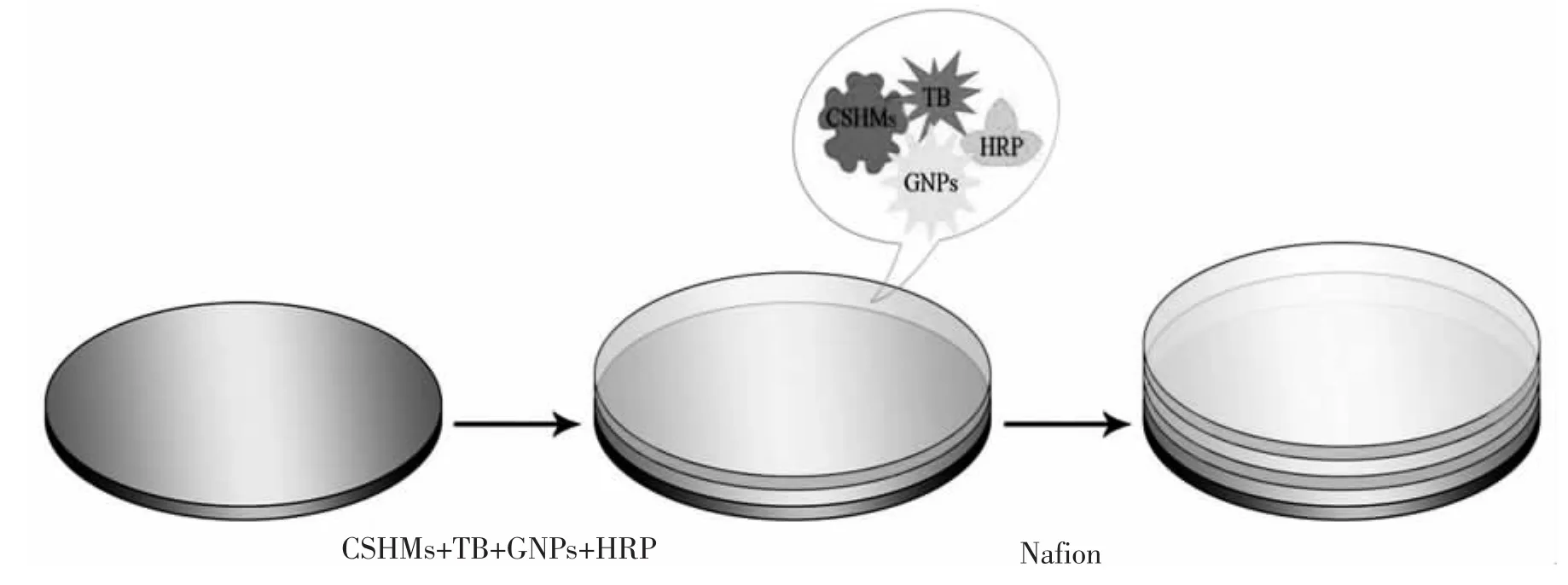
图1 电极制备示意图Fig.1 Schematic illustration of the preparation process of enzyme electrode
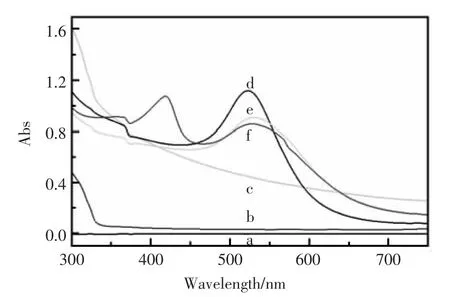
图2 紫外吸收光谱图Fig.2 UV-Vis absorption spectra of(a)CS solution,(b)sol-gel solution,(c)CSHMs,(d)GNPs,(e)CSHMs mixed with GNPs,(f)CSHMs mixed with HRP and GNPs
2.2 扫速对修饰电极性能的影响
图3是修饰电极在pH7.0 PBS中,不同扫速下的循环伏安图。从图中可以看出,该传感器的循环伏安表征呈现一对可逆的氧化还原峰,表明掺杂在CSHMs复合膜中的TB有效的固定在了玻碳电极表面,促进了电子的传输。且在10~500 mV/s扫速范围内,氧化还原峰电流与扫速成线性关系,表明该修饰电极在PBS中的电化学过程是受表面控制的。

图3 扫速对生物传感器的影响Fig.3 CVs of the biosensor at various scan rates(from inner to outer curves:10,20,50,80,100,150,200,250,300,350,400,450,500 mV/s)in 0.1 mol/L pH7.0 PBS.The inset shows the linear relationship of peak currents and scan rates
2.3 修饰电极的电化学特征
图4是该生物传感器 (Nafion/HRP-GNPs-TB-CSHMs/GCE)在 pH7.0 PBS 中,加入不同浓度H2O2时的循环伏安图。(a)为修饰电极在未加入H2O2时的循环伏安图。当加入0.35 mmol/L H2O2后,电极的催化还原电流明显增大(曲线b),加入1.05 mmol/L H2O2后,催化还原电流继续增大(曲线c),表明固载在CSHMs膜上的TB是一种有效的电子媒介体,可以在HRP生物活性中心与电极表面传输电子,同时还表明CSHMs复合膜可以保持HRP的生物活性。

图4 Nafion/HRP-GNPs-TB-CSHMs/GCE修饰电极对H2O2的催化反应图Fig.4 CVs of the biosensor at scan rate of 100 mV/s in 0.1 mol/L PBS(pH7.0)without H2O2(a),with 0.35 mmol/L H2O2(b)and 1.05 mmol/L H2O2(c)
2.4 对比实验
图5是在最佳实验条件下,当连续加入不同浓度H2O2时,不同的修饰电极对H2O2的电流-时间曲线。其中 (a)Nafion/GNPs-TB-CSHMs/GCE,(b)Nafion/HRP-TB-CSHMs/GCE,(c)Nafion/HRPGNPs-TB-CSHMs/GCE。从图中可以看出(a)Nafion/GNPs-TB-CSHMs/GCE对H2O2几乎没有发生催化还原反应。(b)Nafion/HRP-TB-CSHMs/GCE修饰电极有微小的电流响应,表明电子媒介体TB在电极表面和HRP生物活性中心进行了电子的传递。比较这3支修饰电极的电流响应,(c)Nafion/HRP-GNPs-TB-CSHMs/GCE 电流响应最灵敏,并且响应电流远远大于另外两支修饰电极,表明纳米金能大大的促进电子转移,进而提高灵敏度。此外,纳米金具有生物相容性,酶可以稳固的吸附在纳米金的表面。另外,固载了纳米金的CSHMs复合膜呈网状结构,可以增加酶的吸附量,增强传感器的响应。
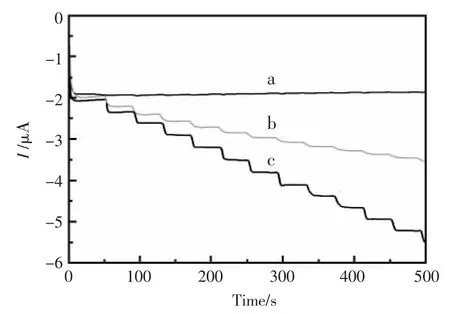
图5 不同修饰电极对H2O2的电流响应Fig.5 The chronoamperometry response at applied potential of-0.4 V with injection of 3.5×10-4mol/L H2O2 into 5mL of stirring pH7.0 PBS for(a)Nafion/GNPs-TBCSHMs/GCE,(b)Nafion/HRP-TB-CSHMs/GCE and(c)Nafion/HRP-GNPs-TB-CSHMs/GCE modified electrode,respectively
2.5 传感器对过氧化氢的电化学响应
图6是在最佳实验条件下,Nafion/HRPGNPs-TB-CSHMs/GCE修饰电极的电流响应图及相应的标准曲线。从图中可以看出,H2O2浓度在 7.0×10-7~2.3×10-3mol/L(r=0.998)范围 内与 其还原峰电流成良好的线性关系,检出限为2.4×10-7mol/L(信噪比 3)。
2.6 传感器的重现性、稳定性及选择性
该酶修饰电极对浓度 0.02 mmol/L的 H2O2平行测定10次,所得相对标准偏差 (RSD)为3.4%,说明此酶生物传感器重现性良好。将该酶生物传感器在4℃的冰箱中放置1周后对相同浓度的底物响应可保持为初始时的90%,4周后可保持81%,说明此电极稳定性良好。
该实验考察了可能对此生物传感器工作存在干扰的物质如L-赖氨酸、L-亮氨酸、葡萄糖、乳酸、和乙醇等,发现均无明显干扰,说明此H2O2生物传感器具有较好的选择性。这些应当归功于Nafion膜对电活性物质有良好的抗干扰能力。
3 结论
该实验成功制备了一种新型的过氧化氢生物传感器。实验证明,CSHMs复合膜可以有效的将电子媒介体和酶固定到电极表面。与Nafion/GNPs-TB-CSHMs/GCE和Nafion/HRP-TBCSHMs/GCE修饰电极相比,Nafion/HRP-GNPs-TB-CSHMs/GCE修饰电极响应电流灵敏度较高,线性范围宽,检测下限低,具有良好的选择性,重现性和稳定性。
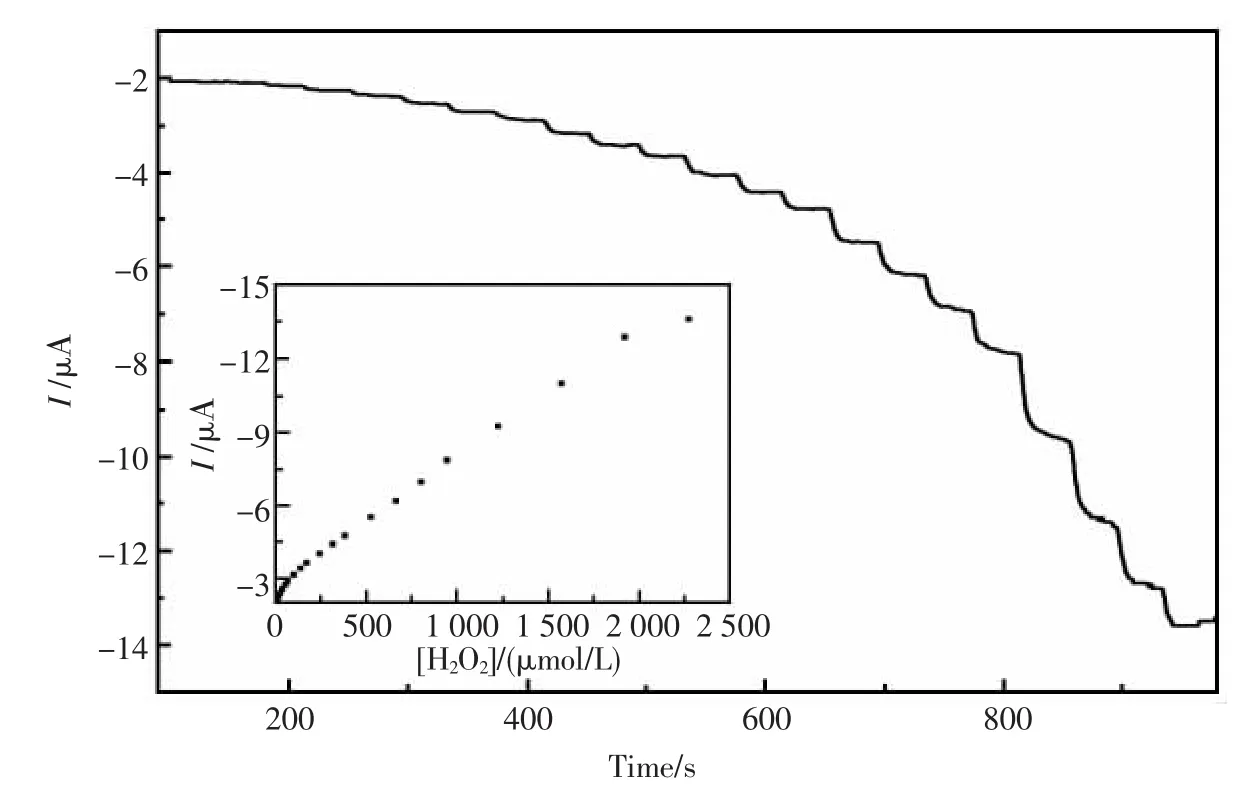
图6 生物传感器对连续加入不同浓度H2O2的计时安培电流图Fig.6 Amperometric response of the biosensor to H2O2at-0.4 V upon successive additions of 1.4 μmol/L(110~190 s),7.0 μmol/L(230~310 s),14.0 μmol/L(350~430 s),35.0 μmol/L(470~550 s),70.0 μmol/L(590~670 s),140 μmol/L(710~830 s),350 μmol/L(870~990)in the time intervals of 40 s
[1]Zhang S,Wright G,Yang Y.Materials and techniques for electrochemical biosensor design and construction[J].Biosens Bioelectron,2000,15(5-6):273~282.
[2]Wu X J,Choi M M F.Spongiform immobilization architecture of ionotropy polymer hydrogel coentrapping alcohol oxidase and horseradish peroxidase with octadecylsilica for optical biosensing alcohol in organic solvent[J].Anal Chem,2004,76(15):4 279~4 283.
[3]Schulz B, Riedel A, Abel P V.Amperometric glucose biosensor based on situ electropolymerized polyaniline/poly(acrylonitrile-co-acrylic acid)composite film[J].J Mol Cat B,1999,7(2):85~87.
[4]Puig-Lleixa C, Jimenez C, Bartroli J.Acrylated polyurethane-photopolymeric membrane for amperometric glucose biosensor construction[J].Sens Actuators Chem,2001,72(1):56~62.
[5]Wang B,Zhang J, Cheng G,et al.Amperometric enzyme electrode for the determination of hydrogen peroxide based on sol-gel/hydrogel composite film[J].Anal Chim Acta,2000, 407(1-2):111~118.
[6]Kros A, Gerritsen M, Sprakel V S I, et al.Silica-based hybrid materiak as biocompatible coatings for glucose sensors[J].Sens Actuators,2001,81:68~75.
[7]Jaafar A,Musa A,Lee Y H, et al.Chitosan-based tyrosinase optical phenol biosensor employing hybrid nafion/sol-gel silicate for MBTH immobilization[J].Talanta,2006,70(2):527~532.
[8]Zhang S,Wang N,Niu Y,et al.Immobilization of glucose oxidase on gold nanoparticles modified Au electrode for the construction of biosensor[J].Sens Actuat B,2005,109(2):367~374.
[9]Gu H Y,Yu A M,Chen H Y.Direct electron transfer and characterization of hemoglobin immobilized on a Au colloid-cysteamine-modified gold electrode[J].J Electroanal Chem,2001,516(1/2):119 ~ 126.
[10]Wang M,Wang L,Wang G,et al.Application of impedance apectroscopy for monitoring colloid Au-enhangced antibody immobilization and antibody-antigen reaction[J].Biosens Bioelectron,2004,19(6):575~582.
[11]Garbar K C,Griffith F R,Hommer M B,et al.Preparation and Characterization of Au Colloid Monolayers[J].Anal Chem,1995,67:735~743.
[12]Lei C X,Hu S Q,Shen G L,et al.Immobilization of horseradish peroxidase to a nano-Au monolayer modified chitosan-entrapped carbon paste electrode for the detection of hydrogen peroxide [J].Talanta,2003,59:981 ~988.
