稽留流产绒毛组织中Fas相关死亡结构域蛋白和Livin的表达
2010-06-20杨玲竹马丽红
杨玲竹,马丽红
郑州大学第一附属医院妇产科郑州450052
稽留流产是自然流产的一种特殊情况,发病机制不明。有学者[1]认为细胞凋亡在胎盘绒毛组织结构分化及功能完善等方面起重要作用,细胞凋亡的加速可能导致流产、胎儿生长受限及早产等病理过程的发生。作者检测了稽留流产患者绒毛组织结构中Fas相关死亡结构域蛋白(Fas-associated protein with death domain,FADD)和凋亡抑制蛋白家族(inhibitor of apoptosis proteins,IAPs)成员 Livin 的表达,探讨两者与稽留流产的关系。
1 材料与方法
1.1 标本来源及处理 选择2008年7月至11月在郑州大学第一和第三附属医院妇产科收治的稽留流产患者30例作为研究对象(实验组)。稽留流产诊断标准以人民卫生出版社第7版《妇产科学》[2]为主。以同期无合并症的健康人群行人工流产的早孕妇女30例为对照组。所有研究对象无合并症,无全身感染性疾病,月经周期规律,流产前无用药史。2组样本的基本临床资料如年龄、孕龄、孕产次差异无统计学意义(表1),均为早期流产(孕周<12周)。2组研究对象均在确诊后第2天行人工流产术取绒毛组织,用生理盐水冲洗后,取0.5 cm×0.5 cm×0.5 cm,固定完全后石蜡包埋,另取一部分存于液氮中备用。
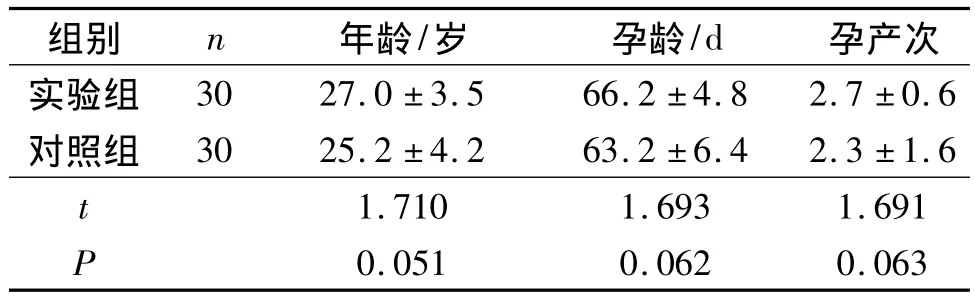
表1 2组一般资料的比较
1.2 FADD及Livin蛋白的检测 应用免疫组化SP法检测FADD及Livin蛋白的表达。兔抗人抗FADD多克隆抗体和兔抗人抗Livin多克隆抗体均购自北京博奥森生物技术公司,抗体稀释比例为1∶100。操作步骤严格按试剂盒说明书进行。采用试剂盒内阳性对照片为阳性对照,用0.01 mol/L PBS代替一抗作阴性对照。参照对照片,FADD及Livin阳性信号均表现为棕黄色或黄色颗粒状物,定位于胞质。抽取5个高倍视野,按阳性细胞百分率计分:阳性细胞百分率≤5%为0分,~25%为1分,~50%为2分,~75%为3分,>75%为4分;再按照染色强度计分:无着色细胞为0分,淡黄色着色为1分,棕黄色着色为2分。2项评分的乘积≥3为阳性表达。
1.3 FADD及Livin mRNA检测 Trizol提取液和RT-PCR试剂盒均购自上海普洛麦格生物产品有限公司。Trizol法抽提绒毛组织中总RNA,按试剂盒说明书进行反转录得cDNA,以cDNA为模板进行PCR扩增。FADD引物序列:上游 5’-GAGAAG GAGAACGCAACA-3’,下游 5’-GACGCTTCGGAGG TAGAT-3’,产物大小170 bp。Livin引物序列:上游5’-GACGCTTCGGAGGTAGAT-3’,下游 5’-GCACG GCACAAAGACGAT-3’,产物大小 485 bp。β-actin引物序列:上游5’-ATTGGCAATGAGCGGTTCCGC-3’,下游 5’-CTCCTGCTTGCTGATGCACATC-3’,产物大小336 bp,引物由上海生工生物技术有限公司合成。PCR条件:94℃预变性1 min;94℃变性30 s,56 ℃退火30 s,72℃延伸30 s,循环30次;最后72℃延伸7 min。PCR产物经15 g/L琼脂糖(西班牙全式金公司)凝胶电泳,MGIAS-1000凝胶成像系统扫描定量并拍照。以目的基因条带与β-actin条带灰度值的比值作为目的基因mRNA的相对表达量。
1.4 统计学处理 采用SPSS13.0进行统计分析,对2组FADD及Livin蛋白阳性表达率进行χ2检验,对两者mRNA相对表达量的比较采用成组资料设计的t检验,检验水准α=0.05。
2 结果
2.1 2组胎盘滋养细胞中FADD及Livin蛋白检测结果 见图1、表2。
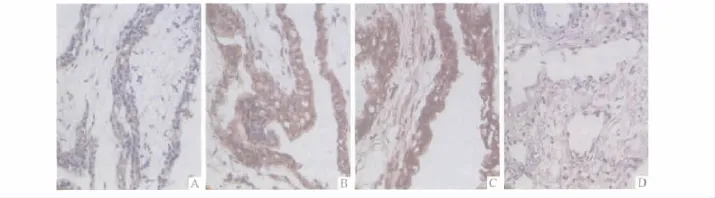
图1 正常早孕及稽留流产组织中FADD及Livin蛋白的表达(SP,×400)
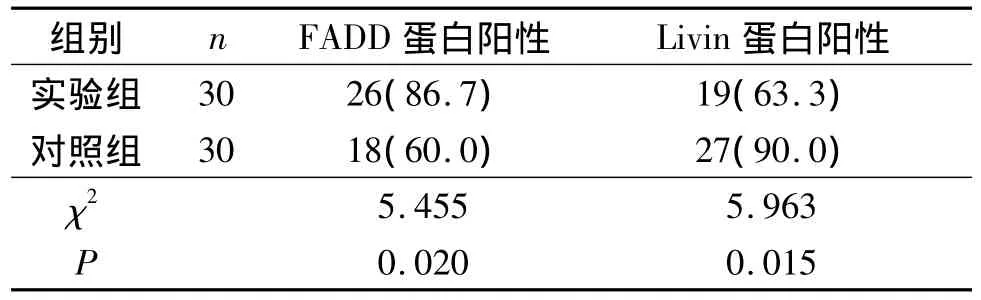
表2 2组胎盘滋养细胞中FADD及Livin蛋白的表达 例(%)
2.2 2组胎盘滋养细胞中FADD及Livin mRNA检测结果 见图2、表3。
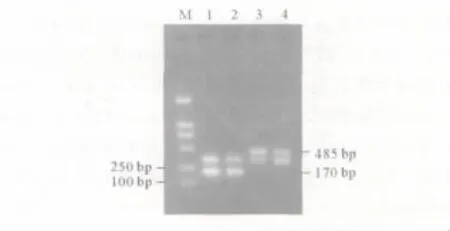
图2 FADD及Livin的RT-PCR扩增结果
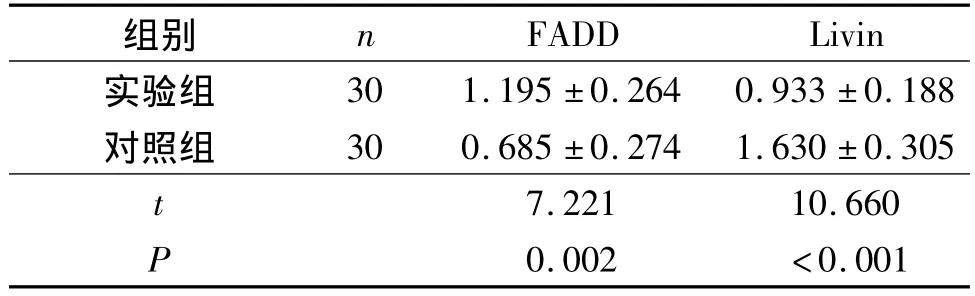
表3 2组胎盘滋养细胞中FADD及Livin mRNA的相对表达量
3 讨论
FADD是新近克隆出的一种能与Fas相互作用而诱导细胞凋亡的蛋白,其基因位于人11号染色体长臂上,由死亡效应结构域(DED)和死亡结构域(DD)两部分组成。FADD基因参与多种死亡受体诱导的细胞凋亡信号传导通路,其主要作用途径为:Fas与FasL结合导致Fas胞内的死亡结构域形成三聚体而活化,并引起与之结合的FADD构象改变,使Caspase-8前体集聚、断裂和激活,产生有活性的Caspase-8,从而激发一系列下游的Caspase-3等级联反应,诱发细胞凋亡[3]。FADD异常导致的凋亡通路异常与多种疾病发病之间联系密切[4-5]。作者的实验结果显示正常早孕绒毛中有FADD的阳性表达,提示FADD与胚胎发育密切相关。正常妊娠均存在一定程度的滋养层细胞凋亡,且主要发生在合体滋养层细胞,说明FADD在胚胎发育过程中也发挥着重要作用[6]。
Livin是IAPs家族的新成员,主要在一些肿瘤组织中高表达,正常组织中表达较少[7];其BIR功能区可与Caspase结合,抑制Caspase的活性,尤其是Caspase-3、-7和Caspase-9,通过阻断凋亡受体和以线粒体为基础的凋亡途径而起作用;抑制肿瘤细胞中Livin基因的表达,可增加细胞的凋亡[8]。Ka等[9]用RT-PCR技术检测到胎盘滋养层细胞JEG-3和绒毛膜瘤细胞系Jar中都有Livin mRNA的表达;通过免疫印迹分析高纯化的足月胎盘的滋养层细胞,发现Livin在绒毛膜滋养层和间充质细胞的细胞核中都有表达,而在合体滋养层细胞中表达较低。表明细胞凋亡特别是滋养层细胞凋亡参与了正常早期妊娠胎盘的生长发育,在胚胎发育中也发挥着重要作用。
作者观察到实验组滋养层细胞FADD蛋白及mRNA的表达较对照组明显增加,而Livin蛋白及mRNA的表达较对照组明显降低。表明FADD的高表达与Livin的低表达与稽留流产有关。作者还发现对照组及实验组中FADD的表达以合体滋养层细胞为主,而对照组和实验组中Livin的表达以滋养层细胞为主。
作为胎盘功能的主要承担者,绒毛滋养层细胞中的合体滋养细胞是执行功能的分化终末细胞,凋亡的发生是其必然结局。而细胞滋养层细胞的凋亡则可能与绒毛发育和DNA修复障碍等有关,当细胞滋养层细胞凋亡增加,打破了维持绒毛正常发育的平衡状态,势必影响其正常功能的发挥,使绒毛生长受阻,从而阻碍孕卵的发育,继而发生稽留流产。而Fas凋亡途径可能是滋养层细胞凋亡的主要途径。
[1]Vogt Isaksen C.Maternal smoking intrauterine growth restriction,and placental apoptosis[J].Pediatr Dev Pathol,2004,7(5):433
[2]乐杰,谢幸,林仲秋,等.妇产科学[M].7版.北京:人民卫生出版社,2008:83
[3]Stewart JH 4th,Nguyen D,Chen GA,et al.Induction of apoptosis in malignant pleural mesothelioma cells by activation of the Fas(Apo-l/CD95)death signal pathways[J].J Thorac Cardiovase Surg,2002,123(2):295
[4]Trauzold A,Schmiedel S,Roder C,et al.Multiple and synergistic deregulations of apoptosis-controlling genes in pancreatic carcinoma cells[J].Br J Cancer,2003,89(9):1 714
[5]Tourneur L,Mistou S,Michiels FM,et al.Loss of FADD protein expression results in a biased Fas-signaling pathway and correlates with the development of tumoral status in thyroid follicular cells[J].Oncogene,2003,22(16):2 795
[6]Yeh WC,Pompa J LDI,Me Curraeh ME,et al.FADD:essential for embryo development and signaling from some but not all,inducers of apoptosis[J].Sciense,1998,279(5 358):1 954
[7]刘川,吴小候,张唯力,等.Livin反义寡核苷酸诱导人肾癌细胞凋亡及其机制的研究[J].第三军医大学学报,2008,30(17):1 622
[8]郭玥馨,毛成刚,罗庆,等.Livin siRNA重组腺病毒的构建及其对K562细胞增殖、凋亡和耐药的影响[J].第三军医大学学报,2009,341(14):1 353
[9]Ka H,Hunt JS.Tamporal and spatial patterns of expression of inhibitors of apoptosis in human in placentas[J].Am J Pathol,2003,163(2):413
