盐酸法舒地尔体外诱导大鼠骨髓间充质干细胞向神经元样细胞分化的可行性*
2010-06-20滕军放关文娟文全庆张博爱贾延劼
彭 涛,滕军放,关文娟,文全庆,张博爱,贾延劼
郑州大学第一附属医院神经内科郑州450052
骨髓间充质干细胞(mesenchymal stem cells,MSCs)是中胚层来源的具有多向分化能力的干细胞,具有向骨细胞、软骨细胞、肌腱细胞、肌细胞、干细胞、脂肪细胞和造血细胞等多向分化和自我更新的能力,在体内及体外一定条件下可横向分化为神经元和胶质细胞[1]。Rho/Rho激酶(ROCK)信号通路是体内重要的信号通路,它通过调节细胞内肌动蛋白骨架的聚合状态而扮演着“分子开关”的角色,参与调节细胞骨架蛋白的合成、降解、移动和收缩等,对细胞的分裂、收缩、黏附、迁移及分泌等活动具有重要的调节作用[2-3]。作者观察了ROCK抑制剂盐酸法舒地尔体外诱导大鼠骨髓MSCs向神经元样细胞分化的效果,报道如下。
1 材料与方法
1.1 材料 实验动物:成年Wistar雄性大鼠,体质量150~200 g,雌雄不拘,由郑州大学实验动物中心提供。主要试剂:高糖 DMEM培养基购自Gibco公司,胎牛血清购自Hyclone公司,盐酸法舒地尔注射液由天津红日药业股份有限公司提供,神经元特异性烯醇化酶(NSE)、神经丝蛋白(NF200)与胶质纤维酸性蛋白(GFAP)兔抗大鼠多克隆抗体及兔抗大鼠Cy3免疫荧光染色试剂盒均购自Santa Cruz公司,其他生化试剂均为进口或国产分析纯。
1.2 大鼠骨髓MSCs的分离培养、纯化及扩增 取Wistar雄性大鼠,颈椎脱臼处死后,体积分数75%乙醇浸泡5 min,无菌条件下分离大鼠两侧股骨和胫骨,暴露骨髓腔,以含体积分数15%胎牛血清的DMEM培养基反复冲洗骨髓腔,3 000 r/min离心2 min,弃上清液,以培养基重悬细胞,制成单细胞悬液,以1×105mL-1的细胞密度接种于25 cm2的塑料培养瓶中,置于37℃饱和湿度、体积分数5%CO2的恒温培养箱中培养,48 h半量换液。待贴壁细胞完全融合后,以含1 mmol/L EDTA的2.5 g/L胰蛋白酶消化传代,按1×104mL-1的密度接种,每隔48 h半量换液。倒置显微镜动态观察骨髓MSCs的生长情况。传至15代后备用。
1.3 骨髓MSCs的诱导分化 根据预实验结果选用200 μmol/L盐酸法舒地尔诱导骨髓MSCs。取15~18代的骨髓MSCs,以2×104mL-1的密度接种于24孔板,当细胞融合度达70% ~80%时,用含终浓度200 μmol/L盐酸法舒地尔的高糖DMEM液诱导。设4个复孔,实验重复3次。
1.4 细胞形态学观察 倒置显微镜下动态观察诱导前及诱导30、60、90、120及180 min细胞形态学变化。
1.5 细胞存活率测定 吖啶橙(AO)与溴化乙锭(EB)分别用PBS溶解成100 mg/L的工作液,使用前按体积比1∶1混匀。诱导30、60、90、120及180 min,分别加入AO-EB混和液。荧光显微镜下(×100)随机计数5个非重叠视野,计算细胞存活率。
1.6 NSE、NF200与 GFAP的检测 40 g/L多聚甲醛固定诱导后60、90、120及180 min的细胞,4℃过夜,TBST洗涤3次。用含体积分数5%牛血清白蛋白的TBST封闭60 min。去除封闭液,分别滴加一抗NSE、NF200与GFAP兔抗大鼠多克隆抗体,工作浓度均1∶100,4℃过夜后洗涤。加入Cy3标记的二抗作用1 h,洗涤后在荧光显微镜下观察,随机计数5个非重叠视野(×200),计算NSE、NF200和GFAP阳性细胞百分率。
2 结果
2.1 大鼠骨髓MSCs的培养和纯化 接种后24~48 h,骨髓细胞出现纺锤形改变,开始贴壁生长,随着培养时间延长,贴壁细胞明显增多并分裂增殖。7~10 d细胞胞体膨大,伸出长短不一、粗细不均多种形态的突起,细胞呈团簇状生长,分布不均,显示出集落生长趋势。经15~18次传代,形成较典型的骨髓MSCs。见图1。

图1 18代大鼠MSCs(×200)
2.2 诱导后的形态学变化 盐酸法舒地尔诱导后30 min细胞开始出现胞体收缩,细胞间隙增宽。诱导后120 min,形态变化最为理想,表现为胞体收缩成球形或锥形,折光性增强,部分细胞周围有光晕,有较多长突起,并连接成网状。继续延长诱导时间,神经元样细胞明显增多,但有少量细胞脱落、死亡(图2)。
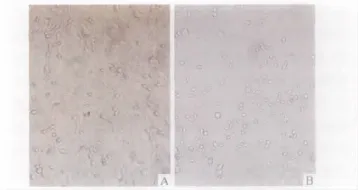
图2 盐酸法舒地尔诱导30 min(A)和120 min(B)(×200)
2.3 诱导后细胞存活率 盐酸法舒地尔诱导30、60、90、120 及180 min后细胞存活率分别为(96.7 ±2.2)%、(95.3 ±1.9)%、(93.8 ±1.8)%、(92.5 ±2.1)%及(90.1 ±1.3)%。
2.4 NSE、NF200及GFAP测定 见图3。诱导后60、90、120及 180 min,NSE阳性表达率分别为(66.5 ±1.9)%、(88.1 ±3.2)%、(93.6 ±1.9)%和(93.5±5.4)%,NF200 阳性表达率分别为(70.1 ±2.9)%、(89.5 ±1.3)%、(98.1 ±1.6)%和(98.3 ±1.9)%,而GFAP阳性表达率均小于5%。
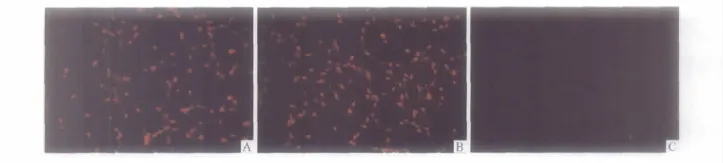
图3 诱导120 min NSE(A)、NF200(B)和GFAP(C)蛋白的表达(免疫荧光染色,×200)
3 讨论
目前诱导骨髓MSCs在体外分化成为神经细胞可采用细胞因子、基因转染和化学诱导剂等方法。但是前两者诱导时间长,获得神经元样细胞的百分率较低。作者观察了ROCK抑制剂盐酸法舒地尔诱导骨髓MSCs向神经元分化的可行性,结果显示,盐酸法舒地尔可在体外诱导大鼠骨髓MSCs向神经元样细胞分化,诱导后的细胞主要表达 NSE和NF200,GFAP表达较少,证明骨髓MSCs诱导后主要是向神经元细胞分化,而不是向胶质细胞分化。AO-EB染色和免疫荧光结果显示,盐酸法舒地尔的诱导效率及诱导后细胞存活率较高,且其诱导过程是连续的,诱导2 h后,细胞形态已有明显变化,省略了预诱导期,使诱导时间大大缩短。
近年来的研究[4-6]表明,骨髓MSCs的分化是通过一系列信号转导途径实现的。2006年,Pacary等[7]报道CoCl2联合ROCK抑制剂Y-27632可促进骨髓MSCs向多巴胺能神经元样细胞分化。2007年,Kamata等[8]在研究人神经母细胞瘤GOTO细胞时发现,Rho抑制剂胞外酶C3转移酶和法舒地尔可诱导轴突形成,促进GOTO细胞向神经元样细胞分化,推测GOTO细胞的分化和ROCK信号通路密切相关。骨髓MSCs的定向分化主要涉及细胞形态学的改变,细胞形态改变依赖于持续的细胞骨架的重建,肌动蛋白是细胞骨架的主要成分。Rho激酶是细胞骨架肌动蛋白的重要调节分子,并作为信号分子参与众多与细胞骨架有关的细胞信号传导。该研究首次证实ROCK抑制剂盐酸法舒地尔可以在体外快速、高效诱导大鼠骨髓MSCs向神经元样细胞分化。推测其机制可能为盐酸法舒地尔抑制了Rho激酶的活性,从而导致细胞骨架重建,启动细胞分化的过程,同时通过干扰ROCK信号通路与其他信号传导通路之间本来相对平衡稳定的内环境,关闭或激活下游途径中与细胞分化相关的基因,从而促进骨髓MSCs向神经元样细胞分化。
[1]Woodbury D,Schwarz EJ,Prockop DJ,et al.Adult rat and human bone marrow stromal cells differentiate into neurons[J].J Neurosci Res,2000,61(4):364
[2]Etienne-Manneville S,Hall A.Rho GTPases in cell biology[J].Nature,2002,420(6 916):629
[3]Riento K,Ridley AJ.Rocks:multifunctional kinases in cell behaviour[J].Nat Rev Mol Cell Biol,2003,4(6):446
[4]Yaghoobi MM,Mowla SJ,Tiraihi T.Nucleostemin,a coordinator of self-renewal,is expressed in rat marrow stromal cells and turns off after induction of neural differentiation[J].Neurosci Lett,2005,390(2):81
[5]Wislet-Gendebien S,Hans G,Leprince P,et al.Plasticity of cultured mesenchymal stem cells:switch from nestin-positive to excitable neuron-like phenotype[J].Stem Cells,2005,23(3):392
[6]Brown JH,Del Re DP,Sussman MA.The Rac and Rho hall of fame:a decade of hypertrophic signaling hits[J].Circ Res,2006,98(6):730
[7]Pacary E,Legros H,Valable S,et al.Synergistic effects of CoCl(2)and ROCK inhibition on mesenchymal stem cell differentiation into neuron-like cells[J].J Cell Sci,2006,119(Pt 13):2 667
[8]Kamata Y,Hattori Y.Neural differentiation of human neuroblastoma GOTO cells via a Rho-Rho kinase-phosphorylation signal transduction and continuous observation of a single GOTO cell during differentiation[J].J Vet Med Sci,2007,69(1):37
