供体抗原特异性的CD4+CD25+Treg对心脏移植小鼠体内B细胞功能的影响*
2010-06-15黄赤兵张艮甫王平贤范明齐冯嘉瑜
肖 亚,黄赤兵,张艮甫,王平贤,范明齐,冯嘉瑜
(第三军医大学新桥医院泌尿外二科,重庆400037)
由于免疫抑制剂的发展以及配型技术和临床移植水平的提高,心脏移植近期(术后1年内)效果已显著改善。然而,迄今为止,尚无阻抑慢性排斥发生和发展的有效药物与临床干预手段。在对慢性排斥临床病例的观察和实验研究中,抗原抗体复合物在移植物的沉积和由此介导的内皮细胞慢性损伤是慢性排斥共同的临床表现[1-3]。因此,欲抑制心脏移植术后慢性排斥,则必须干预B细胞排斥性抗体形成[4]。本实验拟探讨CD4+CD25+Treg体内应用对小鼠心脏移植受体B细胞功能的影响,研究CD4+CD25+Treg在移植术后控制排斥反应,诱导免疫耐受中的作用机制,为推动CD4+CD25+Treg的临床应用奠定基础。
1 材料与方法
1.1 实验动物及主要仪器、试剂 Balb/c小鼠30只,雌雄不限,体质量20~25 g。C57bl/6小鼠 30只,雌雄不限,体质量25~30 g,由第三军医大学大坪医院动物实验中心提供;FITC-labeled Anti Rat CD8、FITC-labeled Anti Rat CD25(美 国Pharmingen公司);抗FITC抗体——磁珠(百奥科生物技术有限公司);免疫磁珠分选(MACS)磁力架、auto MACS磁性分离柱(德国Miltenyi公司);IgA、IgG抗体检测试剂盒(迈新公司);3H-TdR(中国原子能研究所)。
1.2 实验方法
1.2.1 CD4+CD25+Treg供体抗原特异性的诱导 以0.3%戊巴比妥钠注射液(1 mL/100 g体质量)腹腔注射将C57bl/6小鼠麻醉,无菌条件下切取小鼠脾脏,将其剪碎,研磨后过200目筛网及400目尼龙网滤器,以小鼠淋巴细胞分离液分离小鼠脾脏单个核细胞,置于含10%BSA的RPMI-1640培养液中备用。无菌条件下切取Balb/c小鼠心脏,制备心组织匀浆抗原。将C57bl/6小鼠脾脏单个核细胞与Balb/c小鼠心脏组织匀浆抗原在37℃、5%CO2条件下混合培养24 h。采用T细胞纯化柱分离供体抗原特异性诱导后的Balb/c小鼠脾脏T细胞,以CD8-FITC抗体和抗FITC标记的磁珠相结合阴性选择法剔除CD8+T细胞,再以CD25-FITC抗体和抗FITC标记的磁珠相结合的阳性选择法分选获得CD4+CD25+T细胞,流式细胞仪检测所获细胞纯度[5]。将细胞浓度调整为2×106/mL,备用。
1.2.2 小鼠心脏移植模型的建立 以Balb/c小鼠为供体,C57bl/6小鼠为受体建立小鼠心脏移植模型,对Chenzh的小鼠颈部异位心脏移植模型进一步改进。方法:在颈总动脉远心端将其横断,向近心端剖开,将此断端与供心升主动脉吻合,静脉吻合仍采用端侧吻合的方法。建立了小鼠颈部异位心脏移植模型。术后通过视诊、触诊及心电图检查,观察移植心搏动情况。移植受体于术前及术后30 min各给予青霉素100万u/kg各1次,预防感染。术后腹腔注射环孢霉素1.5 mg◦kg-1◦d-1,连续10 d。
实验分组:实验组(n=8),受体于术前 1 d、术后 2周分别经尾静脉注入供体抗原特异性的CD4+CD25+Treg各1×106;阳性对照组(n=8),建立小鼠心脏移植模型,术前、术后不给予抗排斥措施;空白对照组(n=8),正常未进行心脏移植的C57bl/6大鼠。
1.2.3 心脏移植受体体内B细胞功能的检测 于心脏移植术后1个月切取小鼠脾脏,分离单个核细胞,按试剂盒说明检测血清中IgG、IgA水平。以尼龙毛柱分离获得小鼠B细胞,将其置于含10%BSA的 RPMI-1640培养液中培养,以IgM抗体刺激B细胞增,培养 72 h后掺入3H-TdR(5 uCi/mL),并继续培养18 h,以细胞收集仪收集细胞至玻璃纤维膜上,液体闪烁测定cpm值,判断各组B细胞增殖水平。
1.3 统计学方法 实验数据采用SPSS12.0软件进行统计分析。结果以±s表示。统计方法为单因素方差分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 流式细胞仪检测供体抗原特异性的CD4+CD25+Treg纯度 经流式细胞仪检测以免疫磁珠法分离所获供体抗原特异性的CD4+CD25+Treg纯度为87.3%(图1),达到实验要求。
2.2 小鼠心脏移植受体IgG、IgA水平的检测 正常C57bl/6小鼠外周血IgG水平为(12.58±1.49)g/L,IgA水平为(2.58±0.16)g/L。以Balb/c小鼠为供体,C57bl/6小鼠为受体建立心脏移植模型后,受体在给予CD4+CD25+Treg干预时术后1个月外周血IgG水平为(12.83±1.60)g/L,IgA水平为(2.61±0.23)g/L。受体在没有CD4+CD25+Treg干预时术后1月外周血IgG水平为(16.81±1.33)g/L,IgA水平为(3.97±0.41)g/L,3组之间差异均有统计学意义(图2)。实验结果证实供体抗原特异性的CD4+CD25+Treg经尾静脉注入受体大鼠体内后对其体内的B细胞的分泌功能产生了明显的影响。

图1 免疫磁珠法分离所获CD4+CD25-T细胞纯度

图2 各组小鼠脾脏中IgG、IgA水平
2.3 小鼠心脏移植受体B细胞增殖能力的检测 正常C57bl/6小鼠脾脏B细胞在IgM抗体刺激下培养90 h后cpm值为2 717.39±356.23;以 Balb/c小鼠为供体,C57bl/6小鼠为受体建立心脏移植模型后,受体在给予CD4+CD25+Treg干预时脾脏B细胞在IgM抗体刺激下培养90 h后cpm值为2 351.11±135.09;无CD4+CD25+Treg干预时脾脏B细胞在IgM 抗体刺激下培养 90 h后 cpm值为3 819.80±232.26。3者之间差异有统计学意义(P<0.05)(图3)。实验结果证实CD4+CD25+Treg进入受体体内后对B细胞的增殖能力产生了显著的影响。
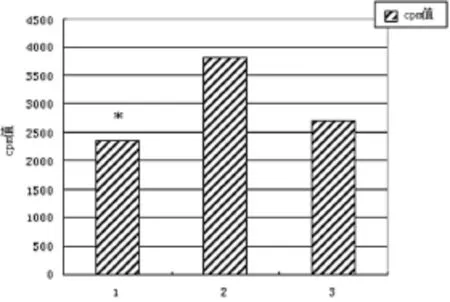
图3 B细胞体外刺激培养增殖水平
2.4 小鼠移植心脏存活情况观察 实验组小鼠移植心脏存活时间为(93.63±14.04)d,长于阳性对照组的(72.38±11.08)d,二者差异有统计学意义(P<0.05),提示供体抗原特异性的CD4+CD25+Treg在受体体内能够特异性地阻断B细胞对移植心脏的免疫反应,从而达到控制排斥反应程度,诱导免疫耐受,延长移植物存活时间的作用。

表1 实验组与阳性对照组小鼠移植心脏存活时间(d)
3 讨 论
同种器官移植中排斥反应主要由受体的抗原特异性T细胞介导,这些抗原特异性T细胞对移植物不反应或低反应是诱导耐受的关键。20世纪90年代初,Qin等[5]发现,采用非清除性抗CD4单抗可使小鼠产生对移植物的耐受,将耐受小鼠CD4+T细胞过继输入未移植同品系小鼠,可使其获得对同基因移植物的耐受,这一过程可连续传代,表明过继输入的CD4+T细胞具有特殊的功能,可使受体针对移植物抗原的T细胞产生耐受,该现象被称作传染性耐受(Infectious tolerance)。但并非所有CD4+T细胞均具有传染性致耐受能力,直到近年,才进一步明确:该类CD4+T细胞是一群CD4+CD25+T细胞,它们通过细胞-细胞直接接触机制“传染”抗原特异性的抑制信号给CD4+细胞,使之成为具有抑制功能的Th,抑制受体抗原特异性CD4+T、CD8+T对移植抗原的反应,控制排斥反应[6]。器官移植是挽救终末期患者的有效手段,自20世纪80年代中期,强力免疫抑制剂应用于临床,急性排斥反应得到了有效的控制。目前在临床治疗中,慢性排斥反应是移植后器官功能丧失的主要原因。因此,探索一条控制慢性排斥反应的治疗措施已成为器官移植领域的当务之急。既往的研究证实,抗原抗体复合物在移植组织上的沉积、轻度的细胞性排斥和由此引起的血管内皮细胞损伤与激活,并触发不适当的修复反应等[1-3]是引起慢性排斥反应的主要机制。其中由移植物抗原刺激启动的体液免疫应答生成抗体并由此而形成的抗原抗体复合物,与通过激活补体和抗体依赖性细胞介导的细胞毒作用,是导致慢性排斥反应发生的最主要致病因素。B细胞是机体惟一的抗体形成细胞,所以欲控制慢性排斥反应的主要致病因素——体液免疫应答,则必须调控体液免疫的主要功能执行细胞——B淋巴细胞[7-10]。迄今,国内外在这方面采取的干预措施有:利用特异性的单克隆或多克隆抗体阻断受体本身的排斥性抗体与移植物抗原的结合,或阻断清除受体排斥性B细胞等[8]。但这些措施由于有效靶阻率很低、费用昂贵,且不良反应很多,因此没有成为也够不上调控慢性排斥反应的理想的常规应用手段。
在前期实验中证实,体外淋巴细胞混合培养中,与CD4+CD25+Treg、供体淋巴细胞混合培养时B细胞功能可明显受到抑制,表现为细胞培养上清中的IgG、IgA水平明显降低。进一步的研究证实CD4+CD25+Treg对效应性B细胞的抑制作用主要是通过细胞间直接接触机制发生作用,TGF-β1和CTLA4在这一机制中起着一定作用。以供心脏组织匀浆抗原刺激可使受体CD4+CD25+Treg获得供体抗原特异性,其抑制效应性淋巴细胞对供体抗原的反应能力明显增强,而不影响效应性T细胞对第3方抗原的免疫应答[9]。CD4+CD25+Treg细胞具有负调B细胞抗体形成的这一免疫学特性,使其具备了对抗慢性排斥反应的潜能。基于以上实验结果,作者推测采用供体特异性的CD4+CD25+Treg细胞体内应用,可选择性阻抑受体内的供体反应性B细胞,从免疫应答起始阶段阻断供体反应性B细胞产生供体抗原特异性抗体,而不造成对受体免疫功能的进一步阻抑,从而达到控制慢性排斥反应的理想状态。在本实验中,在体使用了供体抗原特异性的CD4+CD25+T reg,从实验结果可以看出,小鼠心脏移植受体应用供体抗原特异性CD4+CD25+T reg后,其外周血血清中 IgG、IgA水平与空白对照组比较差异无统计学意义,二者均明显低于阳性对照组,提示体内应用的供体抗原特异性的CD4+CD25+Treg特异性地阻断了B细胞对移植心脏的免疫反应。体外刺激实验进一步证实供体抗原特异性的CD4+CD25+Treg在体应用后B细胞的增殖活性明显降低。
本实验验证了供体抗原特异性的CD4+CD25+Treg在体应用后对B细胞的特异性免疫抑制作用,进一步阐明Treg细胞对抗慢性移植排斥反应的免疫学机制,为推动抗移植后慢性排斥反应的深入研究和对开发利用Treg细胞作为介导其他实体器官移植耐受的临床应用工具细胞铺垫理论、应用和实验支持基础。
[1]He X,Johnston A.Early acute rejection does not affect chronic allograft nephropathy and death censored graft failure[J].Transplantation Proceedings,2004,36(10):2993.
[2]Yvo WJ,Sijpkens SA,Joosten,et al.Chronic rejection in renal transplantation[J].Transplantation Reviews,2003,17(3):117.
[3]Scott HA,Laurence A,Turka,et al.Immunotherapy as a means to induce transplantation tolerance[J].Current O-pinion in Immunology,2002,14(5):660.
[4]Gavin MA,Clarke SR,Negrou E,et al.Homeostasis and anergy of CD4+CD25+suppressor T cells in vitro[J].Nature Immunology,2002,3(1):33.
[5]Qin S,Cobbold SP,Pope H,et al.“ Infectious” transplantation tolerance[J].Sciencek,2005,259(97):974.
[6]Lechler RI,Ng WF,Camara NO.Infectious tolerance Mechanisms and implications[J].Transplantation,2007,72(8 Suppl):S29.
[7]王琦,郑峻松,张艮甫,等.Foxp3基因转染小鼠CD4+CD25-T细胞对同种T细胞增殖反应的影响[J].重庆医学,2006,35(4):1671.
[8]Kathryn J,Wood,Shimon S.Regulatory lymphocytes:regulatory T cells in transplantation tolerance[J].Nature Reviews Immunology,2003,3:199.
[9]Wood K,Luo SQ,Ahmed A.Regulatory T cells:potential in organ transplantation[J].Transplantation,2004,77(1):6.
[10]Park YH,Min SK,Lee JN,et al.Risk factors on graft survival of living donor kidney transplantation[J].Transplantation Proceedings,2004,36(7):2023.
