贝类单孢子虫和折光马尔太虫二重PCR检测方法的建立*
2010-05-31谢丽基谢芝勋庞耀珊刘加波邓显文谢志勤
谢丽基,谢芝勋,庞耀珊,刘加波,邓显文,谢志勤
(广西兽医研究所,广西南宁 530001)
贝类单孢子虫和折光马尔太虫二重PCR检测方法的建立*
谢丽基,谢芝勋*,庞耀珊,刘加波,邓显文,谢志勤
(广西兽医研究所,广西南宁 530001)
根据基因库中单孢子虫和折光马尔太虫的基因序列,分别设计了2对特异性引物,通过对二重PCR扩增条件的优化,研究建立了可同时检测鉴别这2种原虫的二重PCR。对同一样品中的单孢子虫和折光马尔太虫模板DNA进行扩增,得到2条大小与试验设计相符的244 bp(单孢子虫)和478 bp(折光马尔太虫)的特异性扩增带,而对派琴虫、嗜水气单胞菌、荧光假单胞菌、副溶血弧菌、溶藻弧菌、河弧菌和拟态弧菌等病原体的检测,结果均为阴性。敏感性试验表明,该技术最低能检测到10 pg的单孢子虫和折光马尔太虫DNA。
单孢子虫;折光马尔太虫;二重PCR
随着养殖规模的日益扩大及养殖密度的增高,贝类的病害也频繁出现。目前,危害最严重的贝类原虫有单孢子虫(Haplosporidiumspp.)和折光马尔太虫(Marteilia ref ringens)。单孢子虫主要感染血细胞,结缔组织和消化道上皮,可引起较高的死亡率[1-2]。马尔太虫可引起贝类消瘦,消化道变色,停止生长并死亡[3-4]。
单孢子虫和折光马尔太虫的传统检测方法有电镜观察、组织细胞学检查和原位杂交等。这些方法费时费力,缺乏专一性,在实际工作中具有一定的局限性[5-9]。病原检测、筛选建立无特定病原体的健康群,仍然是目前预防与控制这些原虫病的最有效办法。PCR方法具有操作简便、敏感性高、特异性强、重复性好等优点,已成为动物病原检测的重要方法。至今仍未见有应用二重PCR技术对贝类单孢子虫和折光马尔太虫进行检测和诊断的报道。本试验设计2对引物,建立了单孢子虫和折光马尔太虫的二重PCR快速检测技术,现将结果报告如下。
1 材料与方法
1.1 材料
1.1.1 菌株和DNA 嗜水气单胞菌和荧光假单胞菌均购自中国农业部动植物病原库;折光马尔太虫、派琴虫、副溶血弧菌、溶藻弧菌、河弧菌和拟态弧菌等由广西壮族自治区兽医研究所生物技术室提供;尼氏单孢子虫、沿岸单孢子虫的DNA由美国维吉尼亚海洋科学研究所的Stokes N赠送。
1.1.2 主要仪器与试剂 PCR仪为美国Perkin Elmer Cetus公司生产的PE9600仪。PCR试剂盒及PMD18-T试剂盒购自宝生物工程(大连)有限公司;DNA片段回收试剂盒购自BioDev公司;海洋动物组织基因组DNA提取试剂盒购自天根公司。
1.2 方法
1.2.1 引物设计与合成 根据单孢子虫和折光马尔太虫的基因保守序列,通过Blast验证,设计了2对特异性引物(表1)。

表1 试验所用引物序列Table 1 The primers used in the study
1.2.2 核酸抽提 取待检贝类的心脏、鳃、消化腺组织等共约100 mg,匀浆后根据海洋组织DNA提取试剂盒的说明书进行DNA的提取。参照Sambrook方法测定核酸的浓度和纯度[10],保存于-20℃备用。对照病原DNA的抽提按同样方法进行。
1.2.3 PCR扩增介质及PCR反应条件的优化100 μ L 的反应体系中含 :25 mmol/L MgCl25 μ L,10 ×PCR buffer10 μ L,10mmol/L dNTP 2 μ L,Taq聚合酶(5 U)0.5 μ L,适当浓度的上游引物和下游引物,模板各5 μ L。以抽提的DNA为模板,对PCR各循环参数和各引物浓度等进行优化,以确定最佳的PCR模式。
1.2.4 PCR特异性试验 将提取的折光马尔太虫、单孢子虫、派琴虫、嗜水气单胞菌、荧光假单胞菌、副溶血弧菌、溶藻弧菌、河弧菌和拟态弧菌的DNA分别加入到多重PCR反应体系中进行扩增,检测其特异性。
1.2.5 PCR的敏感性 测定单孢子虫和折光马尔太虫模板的DNA含量后,按10倍递增稀释,同时加入到最佳的PCR反应体系中进行扩增,检测其敏感性。
1.2.6 PCR产物的电泳分析及克隆测序 取50 μ L PCR产物分别与5 μ L溴酚兰混合,在10 g/L琼脂糖凝胶中电泳,经溴化乙锭染色后,在紫外光下观察拍照,与DNA标准分子质量作比较,分析并记录结果。在紫外灯下用刀片切割所需的片段,然后用凝胶回收试剂盒纯化回收。取适量纯化回收的PCR产物,与PMD18-T于16℃连接过夜,转化DH5α大肠埃希菌。挑取在含氨苄青霉素的选择培养基上长出的白色菌落,37℃培养,用碱裂解法抽提质粒进行PCR检测,阳性克隆菌送宝生物工程(大连)有限公司进行测序,测序结果进行Blast比对分析。
1.2.7 临床样品检测 利用建立的贝类单孢子虫和折光马尔太虫二重PCR方法,对美国维吉尼亚海洋科学研究所的Stokes N赠与的尼氏单孢子虫、沿岸单孢子虫的DNA进行检测。同时用建立的方法对广西沿海的119份牡蛎样品进行检测。
2 结果
2.1 PCR条件优化
通过对PCR的引物浓度、反应温度、时间及循环次数等进行优化,最后确定 PCR 中Haplosporidium7和Haplosporidium8引物的最佳工作终浓度为 0.3 μ mol/L,Marteilia1和Marteilia2引物的最佳工作终浓度为0.4 μ mol/L,PCR的最佳反应条件为:94℃5 min;94℃1 min,57℃1 min,72℃ 1 min,35个循环;再经72℃10 min后。
2.2 PCR特异性扩增结果
应用建立的PCR方法对单孢子虫和折光马尔太虫DNA,以及对照病原(派琴虫、嗜水气单胞菌、荧光假单胞菌、副溶血弧菌、溶藻弧菌、河弧菌和拟态弧菌)的DNA进行PCR扩增,结果含有单孢子虫和折光马尔太虫核酸模板的样品分别能扩增出与预期大小相符的244 bp和478 bp的条带;而其他对照菌株DNA无任何扩增条带(图1)。

图1 PCR特异性试验Fig.1 The specificity assay of PCR
2.3 PCR敏感性试验结果
经敏感性测定,该PCR最低能检出10 pg单孢子虫和折光马尔太虫的DNA模板(图2)。
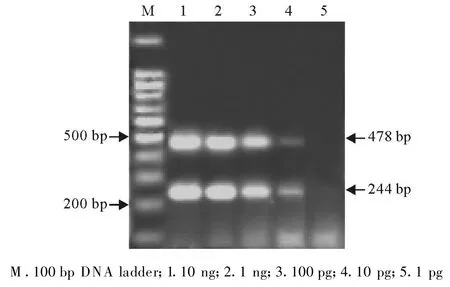
图2 敏感性试验Fig.2 The sensitivity assay of PCR
2.4 测序结果与序列分析
经测序分析及Blast比对分析,证明了单孢子虫和折光马尔太虫PCR扩增产物大小分别为244 bp和478 bp,与设计大小相符。PCR产物的核酸序列与引物设计模板的基因对应片段的同源性一致。
2.5 临床样品的检测
建立的方法对尼氏单孢子虫和沿岸单孢子虫DNA的检测均为阳性。对广西沿海的119份牡蛎样品进行检测,结果检出2份折光马尔太虫阳性,阳性率为1.68%,未检出单孢子虫。
3 讨论
单孢子虫和折光马尔太虫是危害海水养殖贝类的重要病原体,在欧洲、美洲和大洋洲等国家的感染普遍存在[11-17]。我国从国外引进了多种海洋贝类作为贝种用于海水养殖,但在进口过程中都没有进行单孢子虫和折光马尔太虫感染的检测,单孢子虫和折光马尔太虫可能会随着贝类的引进而进入我国,并在不同贝类间传播。因此,迫切需要建立一种快速敏感的单孢子虫和折光马尔太虫检测方法。目前国内检测这两种原虫的方法有组织学和细胞学检测法、电镜检测法和原位杂交法,但这些方法操作繁琐费时,在实际工作应用中存在一定的局限性。
PCR方法具有操作简便、敏感性高、特异性强和重复性好等优点。多重PCR是一种特殊的PCR技术,由于多重PCR反应体系中存在2种以上的引物和模板,反应过程中相互之间会有一定的影响,而且反应总是有利于较小片段扩增的原则,为使多重PCR中各片段都得到最佳扩增,应尽可能使各扩增片段之间大小不要相差太悬殊,各引物所需扩增条件接近一致,特别是各引物退火条件应尽可能相同,最终确保2种扩增产物量相对平衡。本试验中,根据单孢子虫和折光马尔太虫的基因序列设计出特异性引物,从而达到一次二重PCR扩增,就可检测并鉴别单孢子虫和折光马尔太虫。由于单孢子虫和折光马尔太虫在临床上可能会出现混合感染,单孢子虫和折光马尔太虫二重PCR方法的建立就很有意义;通过对引物用量和PCR扩增条件优化,单孢子虫和折光马尔太虫2种引物的最佳工作浓度分别为0.3 μ mol/L 和 0.4 μ mol/L,说明了要使二重 PCR反应体系中每一目的片段都得到最佳扩增结果,适当的引物浓度是十分重要的。
本研究建立的单孢子虫和折光马尔太虫二重PCR方法全程(包括核酸提取、PCR扩增)仅需约5 h,最低能同时检出10 pg单孢子虫和折光马尔太虫的DNA模板,这说明该二重PCR与常规PCR一样,都具有很高的敏感性,可以同时进行单孢子虫和折光马尔太虫的检测和鉴别,这对于在贝类单孢子虫和折光马尔太虫的发病早期提供准确的诊断结果,切断其传播途径有重要意义,同时这也是有效防控以上贝类原虫病,选育建立无单孢子虫和折光马尔太虫病的健康贝类养殖群所必要的。
牡蛎是中国南方沿海养殖的主要经济贝类,也是中国传统的出口海产品。因此,本研究应用所建立的二重PCR技术,对取自广西沿海的119份牡蛎样品进行检测,检测折光马尔太虫的感染率为1.68%,表明在广西沿海地区养殖贝类中存在折光马尔太虫的感染。单孢子虫的感染在欧洲和美洲国家的感染普遍存在[14-17],该方法对单孢子虫和折光马尔太虫的检测具有相同的敏感性,而广西沿海的119份牡蛎样品未检出单孢子虫,提示需要进行更多临床样品的检测。
[1]Hine P M,Thorne T.Haplosporidiumsp.(Alveolata:Haplosporidia)associated with mortalities among rock oy stersSaccostrea cuccullatain north Western Australia[J].Dis Aquat Organ,2002,51(2):123-133.
[2]Ulrich P N,Ewart J W,Marsh A G.Prevalence ofPerkinsus marinus(dermo),Haplosporidium nelsoni(MSX),and QPX in bivalves of Delaware's inland bays and quantitative,highthroughput diagnosis of dermo by QPCR[J].J Eukaryot Microbiol,2007,54(6):520-526.
[3]Audemard C,Barnaud A,Collins C M,et al.Claire ponds as an experimental model forMarteilia re f ringenslife-cycle studies:new perspectives[J].J Exp M ar Bio Ecol,2001,257(1):87-108.
[4]Itoh N,Momoyama K,Ogawa K.First report of three protozoan parasites(a haplosporidian,Marteiliasp.andMarteilioidessp.)from theManila clam,Venerupis(=Ruditapes)philippinarum in Japan[J].J Invertebr Pathol,2005,88(3):201-206.
[5]Perkins F O.Electron microscope studies of sporulation in the oyster pathogenMinchinia costalis(Sporozoa:Haplosporida)[J].J Parasitol,1969,55:897-920.
[6]Stokes N A,Burreson E M.A sensitive and specific DN A probe for the oyster pathogenHaplosporidum nelsoni[J].J Euk Microbiol,1995,42:350-357.
[7]Lopez-Flores I,Robles F,Valencia J M,et al.Detection ofMarteilia re fringensusing nested PCR and in situ hybridisation inChamelea gallinafrom the Balearic Islands(Spain)[J].Dis Aquat Organ,2008,82(1):79-87.
[8]Carrasco N,Arzul I,Berthe F C,et al.In situ hybridization detection of initial infective stages ofMarteilia re fringens(Paramy xea)in its hostMytilus galloprovincialis[J].J Fish Dis,2008,31(2):153-157.
[9]K leeman S N,Le Roux F,Berthe F,et al.Specificity of PCR and in situ hybridization assays designed for detection ofMarteilia sy dneyiandM.re fringens[J].Parasitology,2002,125(Pt2):131-141.
[10]Sambrook J,Fritsh E T,Maniatis T.Molecular cloning:a laboratory manuel[M].New York:Cold Spring Harbor.Cold Spring Harbor Laboratory Press,1989.
[11]Audemard C,Sajus M C,Barnaud A,et al.Infection dy namics ofMarteilia ref ringensin flat oy sterOstrea edulisand copepodParacartia graniin a claire pond of Marennes-Olon Bay[J].Dis Aquat Organ,2004,61(1-2):103-111.
[12]Lopez-Flores I,Garrido-Ramos M A,Herran R la,et al.I-dentification ofMarteilia ref ringensinfecting the razor clamSolen marginatusby PCR and in situ hybridization[J].M ol Cell Probes,2008,22(3):151-155.
[13]Carrasco N,Lopez-Flores I,Alcaraz M,et al.Dynamics of the parasiteMarteiliaref ringens(Paramyxea)inMytilus galloprov incialisand zooplankton populations in Alfacs Bay(Catalonia,Spain)[J].Parasitology,2007,134(Pt 11):1541-1550.
[14]Russell S,Frasca S J,Sunila I,et al.Application of a multiplex PCR fo r the detection of protozoan pathogens of the eastern oysterCrassostrea virginicain field samples[J].Dis Aquat Org,2004,59:85-91.
[15]Haskin H H,Stauber L A,M ackin J A.Minchinia nelsonin.sp.(Haplosporidia,Haplosporidiidae):causative agent of the Delaware Bay oyster epizootic[J].Science,1966,153:1414-1416.
[16]Barber B J,Langan R,Howell T L.Haplosporidiumnelsoni(MSX)epizootic in the Piscataqua River Estuary(Maine/New Hampshire,USA)[J].J Parasitol,1997,83:148-150.
[17]Sunila I,Karolus J,Volk J.A new epizootic ofHaplosporidia(MSX),a haplospo ridian oyster parasite,in Long Island Sound[J].J Shellfish Res,1999,18:169-174.
Development of a Duplex PCR Assay for Detection ofHaplosporidiumandMarteilia ref ringensin Shellfish
XIE Li-ji,XIE Zhi-xun,PANG Yao-shan,LIU Jia-bo,DENG Xian-wen,XIE Zhi-qin
(Guang xi Veterinary Research Institute,N anning,Guang xi,530001,China)
A duplex polymerase chain reaction was optimized to simultaneously detect two pathogens,Haplosporidiumsp.andMarteilia ref ringensin shellfish.Two pairs of specific primers were designed according to the conserved regions on the sequences ofHaplosporidiumsp.andMarteilia ref ringensin Gen-Bank.All samples containingHaplosporidiumsp.andMarteilia ref ringenscould be amplified into two specific bands,244 bp forHaplosporidiumsp.and 478 bp forMarteilia ref ringensby this duplex PCR,but no specific bands of the same sizes were amplified from other shellfish pathogens,such asPerkinsussp.,Aeromonas hydrophila,Pseudomonas f luorescens,Vibrio parahaemolyticu,Vibrio alginolyticu,Vibrio f luvialisandVibrio mimicus.As little as 10 pg ofHaplosporidiumsp.andMarteilia ref ringensDNA could be detected.
Haplosporidiumsp.;Marteilia ref ringens;duplex PCR
S852.723
A
1007-5038(2010)01-0054-04
2009-07-25
国家百千万人才工程人选专项资金项目(945200603);广西科技攻关项目(桂科攻0630001-3M)
谢丽基(1981-),女,广西灵山人,硕士,主要从事动物传染病病原分子生物学研究。*通讯作者
