银杏叶提取物对体外培养大鼠肾成纤维细胞作用的实验研究
2010-05-30李相军苗春生
李相军,王 丹,石 艳,苗春生,孙 波
(吉林大学药学院实验药理与毒理学教研室,吉林长春130021)
肾间质纤维化是肾脏重要且常见的病理过程,成纤维细胞是主要的肾间质细胞,能够产生细胞外基质(ECM),在肾间质纤维化的发生发展过程中发挥重要作用。AngⅡ是引起肾间质纤维化发生重要原因之一。研究表明,银杏叶提取物(GBE)具有广泛的药理作用,其主要成分黄酮化合物具有明显的抗氧化和自由基清除活性[1],并对肝纤维化的预防有一定作用[2],但GBE对肾纤维化的防治效果尚未见报道。本研究主要探讨GBE对大鼠肾间质成纤维细胞增殖作用及其对AngⅡ诱导的TGF-β1和CTGF mRNA表达的影响。
1 材料与方法
1.1 主要试剂 体重100 g Wistar大鼠由吉林大学实验动物中心提供,DMEM培养基(Gibco),标准胎牛血清(天津灏洋生物技术有限公司),逆转录酶SuperScriptII(Invitrogen),TaqDNA聚合酶(北京鼎国生物技术公司),DNA Marker(DL-2000,Takara),PCR引物(上海生工生物技术公司合成),兔抗大鼠TGF-β1多克隆抗体(武汉博士德生物工程公司),兔抗大鼠CTGF多克隆抗体(武汉博士德生物工程公司)。
1.2 大鼠肾成纤维细胞的培养与鉴定 大鼠肾间质成纤维细胞从正常Wistar大鼠肾髓质中培养获得。参考Rodemann等[3]的方法进行分离培养,具体步骤为:将肾髓质切成1 mm3小块,加入0.25%胰酶37℃消化5-10 min,将消化后组织悬液过200目筛网,滤液于1 000 r/min离心10 min,弃上清,用培养液洗涤两次,加入含 20%胎牛血清的培养液,置37℃、5%CO2培养箱中培养。根据长出细胞形态学和免疫学表型确定为成纤维细胞。
1.3 GBE对细胞增殖能力的影响 应用MTT比色法测定肾间质成纤维细胞增殖能力。取传代4-8代肾间质成纤维细胞,接种于96孔板中,每孔1×104个/孔,加无血清培养液37℃孵育24 h,使细胞生长同步化后加入AngⅡ(10-6mol·L-1)刺激,并在AngⅡ基础上加入不同浓度GBE(终浓度分别为0,25,50,100 和 200 mg·L-1),分别为 M 、GBE1、GBE2、GBE3和GBE4。分别作用2 h、6 h、16 h、24 h、48 h、72 h后收集细胞。对照组和处理组均重复3次。于刺激结束前4 h加入MTT 20 μ L/孔(5 g/L),37 ℃继续孵育4 h,终止培养,吸弃上清液,每孔加入150 μ L DMSO,振荡混匀10 min后在酶联免疫检测仪上490 nm波长处测定光吸收值,用只加培养液不加细胞的空白孔调零。
1.4 RT-PCR检测TGF-β1及 CTGF mRNA表达细胞经各种处理后,以Trizol法提取总RNA,按逆转录试剂盒操作说明将 RNA逆转录为cDNA,进行PCR 扩增 。TGF-β1上游引物5′-CCA AGG AGA CGG AAT ACA GG-3′,下游引物 5′-GTG TTG GTT GTA GAG GGC AAG-3′,CTGF 上游引物 5′-CTA AGA CCT GTG GAA TGG GC-3′,下游引物 5′-CTC AAA GAT GTC ATT GCC CCC-3′。GAPDH上游引物PCR产物经2%琼脂糖凝胶电泳(含0.5 mg·L-1溴化乙锭),用计算机凝胶成像分析系统进行吸光度扫描分析,以GAPDH密度作为参考定量标准,TGF-β1和CTGF mRNA表达水平用所测定的TGF-β1和CTGF扩增产物的电泳条带密度与GAPDH电泳条带密度的比值表示。
1.5 统计学处理
2 结果
2.1 GBE对细胞增殖能力的影响
与正常对照组(C组)比较,含AngII(10-6mol·L-1)的模型组(M组)在培养16 h后,肾间质成纤维细胞增殖开始加快,培养24 h后,M组细胞增殖能力明显增强(P<0.05)。Ang II的这种作用可被含GBE的培养液所抑制,且与GBE的浓度和培养时间有关。在培养24 h时,当银杏叶提取物浓度为50 mg·L-1(GBE2 组)和 25 mg·L-1(GBE1 组)时抑制作用最明显(与M组比较,差异显著,P<0.01,P<0.05);在培养 48 h时,除上述GBE1、GBE2组外,GBE3组(银叶提取物浓度为100 mg·L-1)也显示出明显的抑制成纤维细胞过度增殖的能力(P<0.05);而在培养72 h后,所有浓度的GBE均表现出了抑制成纤维细胞过度增殖的能力(P<0.05)。见表1。
Tab.1 Effects of GBE extract on fibroblast proliferation in renal interstitium(n=8,±s)
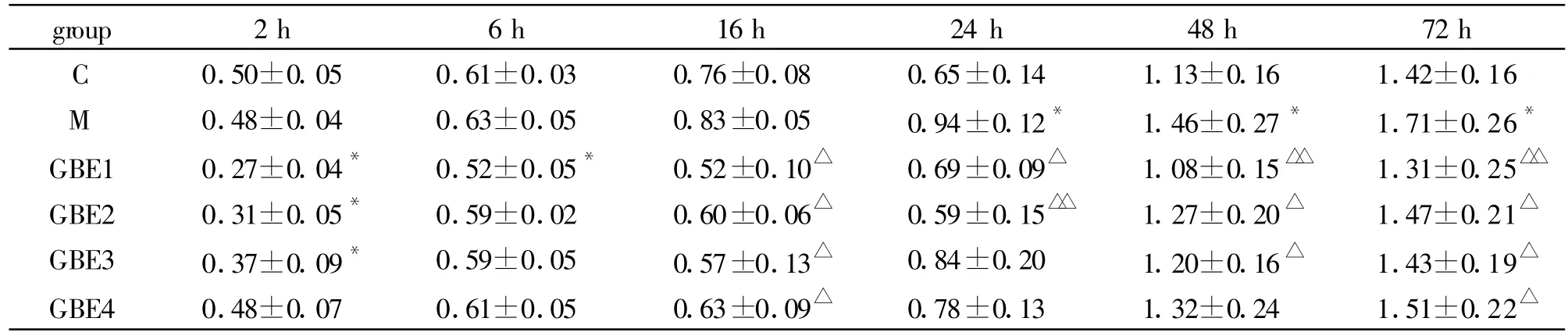
Tab.1 Effects of GBE extract on fibroblast proliferation in renal interstitium(n=8,±s)
*P<0.05 vs C group;△P<0.05,△△P<0.01 vs M group
group 2 h 6 h 16 h 24 h 48 h 72 h C 0.50±0.05 0.61±0.03 0.76±0.08 0.65±0.14 1.13±0.16 1.42±0.16 M 0.48±0.04 0.63±0.05 0.83±0.05 0.94±0.12* 1.46±0.27* 1.71±0.26*GBE1 0.27±0.04* 0.52±0.05* 0.52±0.10△ 0.69±0.09△ 1.08±0.15△△ 1.31±0.25△△GBE2 0.31±0.05* 0.59±0.02 0.60±0.06△ 0.59±0.15△△ 1.27±0.20△ 1.47±0.21△GBE3 0.37±0.09* 0.59±0.05 0.57±0.13△ 0.84±0.20 1.20±0.16△ 1.43±0.19△GBE4 0.48±0.07 0.61±0.05 0.63±0.09△ 0.78±0.13 1.32±0.24 1.51±0.22△
2.2 各组培养细胞 TGF-β1和 CTGF mRNA表达
RT-PCR结果显示,不同条件培养液培养肾间质成纤维细胞48 h后,M 组细胞TGF-β1及CTGF mRNA表达量明显高于C组细胞的表达量(P<0.01)。除GBE1组细胞TGF-β1表达量与M组差异无显著性外,其他不同浓度GBE组细胞TGF-β1及CTGF mRNA表达量均明显低于M组(P<0.05,P<0.01)。见图1。
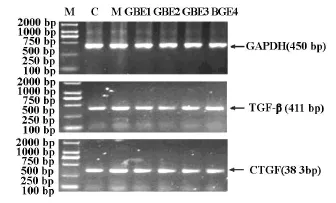
Fig.1 Comparison of TGF-β1and CTGF mRNA expression in various groups
3 讨论
肾间质纤维化是所有慢性肾脏疾病进行性发展的共同通路,是导致慢性肾衰竭的病理学基础,其发生机制较为复杂,可表现为肾间质成纤维细胞增殖、活化和表型转分化,并在一些促纤维化因子的参与下,使细胞外基质过度积聚等[3]。参与肾间质纤维化发病机制的信号转导途径众多,TGF-β1信号转导通路的激活是促进肾间质纤维化进展的信号通路之一[4]。在正常的肾脏内仅有微量的TGF-β1,而纤维增生的肾间质、受损的肾小管上皮细胞内TGF-β1表达显著增加,且表达量与肾间质纤维化程度正相关。CTGF是 TGF-β1的下游因子 ,主要介导 TGF-β1的促细胞外基质分泌作用。因此本研究主要以肾间质成纤维细胞为研究对象,观察不同浓度、不同时间银杏叶提取物对其影响以及对TGF-β1和CTGF的干预作用。
GBE是从银杏叶中提取的天然活性物质,其有效成分为黄酮甙及银杏内酯。临床上多用于心脑血管病、哮喘等的防治。有学者用银杏叶片治疗糖尿病肾病等肾小球病变,可降低血浆BUN和Cr浓度,改善患者的肾功能[5]。近年来发现其对肾脏具有明显保护作用[6,7]。我们既往的研究结果也表明,银杏叶制剂对UUO大鼠肾脏功能和结构具有明显保护作用[8]。
本研究发现AngⅡ对肾间质成纤维细胞的促增殖作用可被含GBE的培养液所抑制,且与GBE的浓度和培养时间有关。在培养24 h时,银叶提取物浓度为25 mg·L-1和50 mg·L-1时抑制作用最明显 ,而在培养72 h后,所有浓度的GBE均表现出了抑制成纤维细胞过度增殖的能力。RT-PCR结果显示,不同浓度GBE培养液培养肾间质成纤维细胞48 h后,TGF-β1及CTGF mRNA表达量均明显低于模型组,说明GBE可能通过抑制纤维细胞的增殖及致纤维化因子的表达,进而阻断纤维化进程,为肾纤维化的防治开辟一个新的领域。
[1]TakeuchiM,Bucala R,Suzuki T,et al.Neurotoxicity of advanced glycation end-products for cultured cortical neurons[J].J Neuropathol Exp Neurol,2000,59(12):1094.
[2]刘 浩,于皆平,时昭红,等.银杏叶提取物对实验性大鼠肝纤维化的预防作用[J].胃肠病学和肝病学杂志,2005,14(5):476.
[3]Eddy AA.Molecular insights into renal interstitial fibrosis[J].J Am Soc Nephrol,1996,7(12):2495.
[4]SchnaperHW,Hayashida T,Hubchak SC,et al.TGFbeta signal transduction and mesangial cell fibrogenesis[J].Am J Physiol Renal Physiol,2003,284(2):F243.
[5]吴本芬.伍用银杏叶片治疗肾小球病变40例[J].医药导报,2000,19(4):340.
[6]赵艳玲,王宗谦,冯江敏,等.银杏叶提取物对大鼠马兜铃酸肾病纤维化相关免疫组化指标的影响[J].中国中西医结合肾脏病杂志,2005,6(11):636.
[7]刘晓刚,刘素雁,隋满姝.银杏叶提取物治疗实验性肾病综合征的实验研究[J].中国中西结合肾病杂志,2006,7(4):205.
[8]李相军,李 才,孙广东.银杏叶片对单侧输尿管梗阻大鼠肾脏的保护作用[J].吉林大学学报(医学版),2007,33(1):29.
