不同消化条件对小鼠胰岛分离纯化效果的影响
2010-05-25钟嘉明张佳林李晓航张成钧程颖刘永锋
钟嘉明,张佳林,李晓航,张成钧,程颖,刘永锋
(中国医科大学 附属第一医院普通外科教研室,肝胆外科暨器官移植科,沈阳 110001)
胰岛移植是治疗1型糖尿病的一种理想方法。但目前临床疗效尚不理想,主要原因在于缺乏足够数量的胰岛、胰岛移植后排斥反应及胰岛移植后早期功能丢失等问题尚未解决[1]。因此,如何获得足量、纯净且有良好活性的胰岛非常重要。尽管胰岛细胞分离与纯化技术正在不断改善,但获得的胰岛细胞在收获量、活性及纯度上仍然不尽人意[2]。由于影响胰岛分离效果的因素较多,胰岛的收获量与纯度难以同时达到标准。目前小鼠胰岛分离方法主要采用经胆道胰管逆行灌注胶原酶充分消化胰腺后,通过梯度离心法来分离纯化胰岛。本研究主要从胶原酶浓度和消化时间方面来探讨如何提高小鼠胰岛细胞分离纯化后的产量和质量。
1 材料与方法
1.1 材料
8~12周BALB/c雄性小鼠,购自中国医科大学和中科院动物实验中心。Hanks液自行配制;Eurocollins-Ficoll液、双硫腙(dithizon,DTZ)、吖啶橙(acridine orange,AO)和碘化丙锭(propidium iodide,PI),均购于美国Sigma公司;胶原酶P和HEPES,购于德国Boehringer Mannheim公司;RPMI 1640培养基、胎牛血清,购于Gibco公司。
1.2 方法
1.2.1 胰岛分离:Balb/c小鼠共15只,非禁食,用乙醚吸入性麻醉后四肢固定,喷洒75%乙醇消毒胸腹部,腹部楔形切开,暴露腹腔,沿十二指肠找到胆总管。近十二指肠处结扎胆总管,“破心”处死小鼠,用27G静脉注射针经胆总管分别逆行灌注浓度为0.5、1.0和1.5 mg/ml胶原酶P溶液3~4 ml。当胰腺膨胀后迅速剪取胰腺,置入含3ml胶原酶P溶液(1 mg/ml)的离心管(50 ml)中,于37℃恒温水浴箱中边振荡边消化,分别消化20、25和30min,然后加入4℃含5%胎牛血清和10mmol/LHEPES的Hanks液稀释并终止消化,4℃条件下800rpm离心2min,洗3遍。
1.2.2 胰岛纯化:将上述分离的胰岛沉淀物加入3 ml密度为1.110的Eurocollins-Ficoll液,充分混匀,随后依次缓慢加入密度为 1.096(3 ml)、1.074(2 ml)和1.069(2 ml)的Eurocollins-Ficoll液,最后加入Hanks液2 ml,4℃条件下2 000 rpm离心20 min,吸取1.069~1.074及1.074~1.096界面上的细胞团,Hanks液洗3遍。纯化的胰岛细胞悬浮于含10%胎牛血清的RPMI 1640培养基中,在37℃、5%CO2培养箱中培养。
1.2.3 胰岛形态观察及计数:采用DTZ染色法观察计数,DTZ为螯合指示剂,可与含锌的胰岛B细胞螫合而使胰岛呈猩红色[3],其他外分泌腺细胞不着色。用100μl加样器在胰岛悬液中重复取样3次,分别置于24孔板内,加入少量DTZ染液,混合后室温下孵育l0 min,镜检计数DTZ阳性细胞团数,按以下公式计数胰岛:胰岛数=3次阳性总数÷3×10×样本量(m1),将1个直径为150μm的胰岛团块称为1个胰岛当量(islet equivalent,IEQ)。
1.2.4 胰岛细胞活性测定:采用AO/PI荧光染色法判定胰岛细胞活性。AO/PI溶液配制:用Hanks液配制储存液 AO 为 670μmol/L,PI为 750μmol/L,4℃避光保存。用前取0.01 ml AO与l ml PI混合,用Hanks液稀释10倍,与胰岛制备物混合10 min,在荧光显微镜下用490 nm激发光滤光片、510 nm光栅滤光片可同时见到绿色(AO)和红色(PI)荧光,绿色标记的为活细胞,红色标记的为死细胞。胰岛细胞成活率用胰岛活细胞占所有胰岛活细胞和死细胞总数的百分比表示,每份标本重复计算4次,取其平均值。
1.3 统计学分析
所有数据均为计量资料,用x±s表示。用SPSS11.5统计软件进行统计学分析,各组数据的比较采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 胶原酶浓度及消化时间对胰岛分离产量的影响
分离纯化后的胰岛细胞被DTZ染成猩红色,镜下表现为大小不一的圆形或卵圆形细胞团和散在细胞(图1)。胶原酶浓度和消化时间对胰岛产量有重要影响,在胶原酶有效发挥活性的条件下(37℃、pH7.8、[Ca2+]7.5 mmol/L)[4],当胶原酶 P 浓度为 1.0 mg/ml、消化时间为25 min时胰岛产量最高,与其他酶浓度和消化时间相比有统计学差异(P<0.05)。见表1。
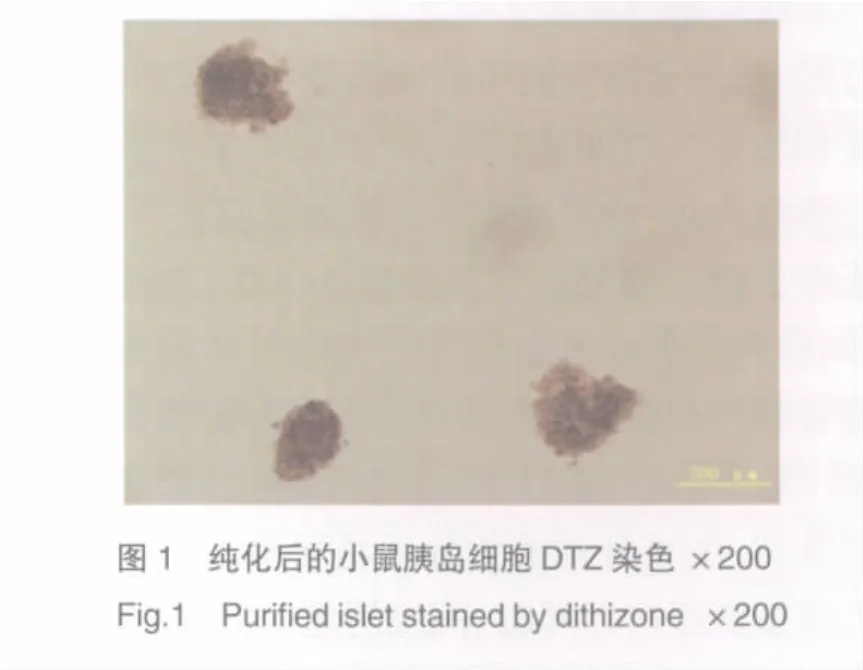
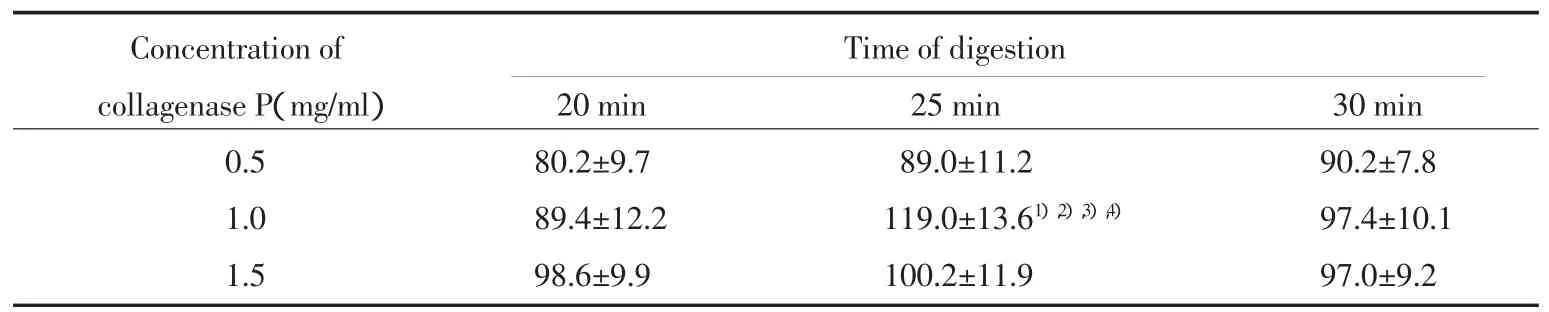
表1 不同消化条件分离纯化单个胰腺获得的胰岛数量(x±s)Tab.1 Islet yield of one pancreas under different digestive conditions(x ±s)
2.2 胶原酶浓度及消化时间对胰岛分离纯度和活性的影响
分离纯化的胰岛被AO/PI染成绿色或红色(图2)。当胶原酶P浓度为1.0 mg/ml、消化时间为25 min时,纯化后的胰岛纯度和活性均较其他消化条件高,但没有统计学差异(P>0.05)。见表2。
3 讨论

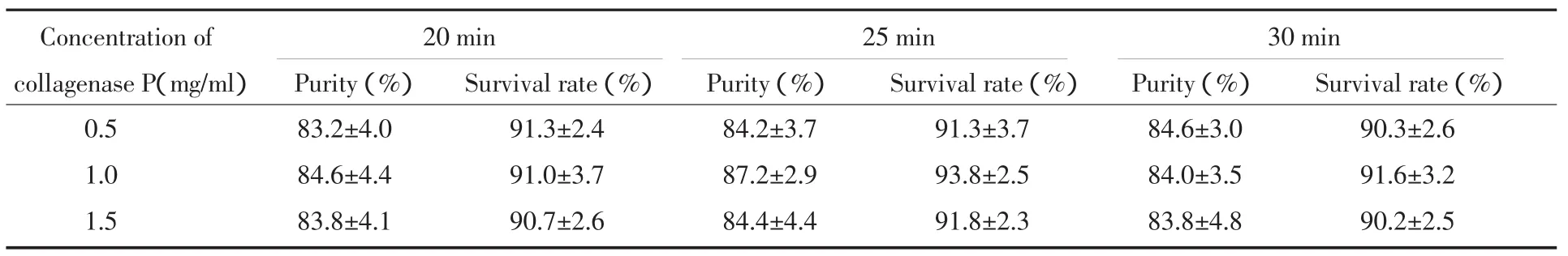
表2 不同消化条件分离纯化胰岛的纯度和成活率(x±s)Tab.2 Islet purity and viability after different digestive conditions(x ±s)
胰岛移植物的数量和纯度是决定移植成功与否的关键因素[5]。胰腺由内分泌部分胰岛和外分泌部分胰腺腺泡组成,胰岛散在于胰腺的腺泡实质中,其总体积仅占整个胰腺的1%~2%,因此胰岛分离需将其从丰富的外分泌腺泡中分离开来。消化是胰岛分离过程中最重要的一步,通过胶原酶消化可以使胰腺内分泌腺和外分泌腺完全分开;当胰岛被完全消化下来时再进行纯化,才可有效保证胰岛的产量和质量,从而获得较纯的、有活性和功能的胰岛细胞。
本研究通过采用不同浓度胶原酶灌注和不同消化时间,探讨如何提高小鼠胰岛分离纯化后的产量、纯度和活性。有研究表明,经胆总管灌注胶原酶后进行胰腺消化,分离纯化后的胰岛细胞在产量、纯度和活性方面均明显高于其他灌注方法(如经胆囊灌注、间质内注射或不灌注)[6~8]。因此,本研究采用经胆总管灌注胶原酶消化方法进行胰岛分离。经胆总管灌注胶原酶后,一方面,通过机械扩张破坏胰腺外分泌腺泡,能更好地消化外分泌腺组织;另一方面,胶原酶在胰腺内外同时、同质消化,可减轻对胰岛的损伤,也为有效地纯化胰岛创造了条件,保证胰岛的产量和质量[6,9]。然而,由于小鼠胰胆管细而薄,插管难度较大,无法保证均可成功插管,尤其是初学者插管技术尚未熟练时更易失败。因此,成功插管进行胆总管灌注是提高胰岛产量和质量的前提,可以借助解剖镜进行插管来提高成功率。为有效提高插管成功率,应充分暴露胆总管,通过胆总管下端结扎可使胆总管膨胀而变得明显,充分游离胆总管后进行插管,有效固定针头再进行灌注,一般每个胰腺可灌注3~4 ml胶原酶。
胰腺消化是胰岛分离的关键步骤,许多因素可以影响胰岛产量和质量,其中最重要的是胶原酶浓度和活性以及消化时间。目前最常用的是胶原酶V和胶原酶P,常用胶原酶浓度介于0.3~2.0 mg/ml。消化时间的把握对胰岛产量和质量至关重要,如果消化时间过短,胰岛将不能从胰腺组织中完全分离,其密度发生改变,使后续的纯化过程中丢失大量胰岛;反之,如果消化时间过长,容易破坏胰岛,并产生胶状物网罗大量胰岛细胞团,也影响胰岛产量和质量[10]。本研究探讨了不同胶原酶浓度和消化时间对胰岛分离纯化的影响。为使胶原酶在最适条件下发挥高效的活性,我们设定消化温度为37℃、胶原酶溶液 pH 7.8、[Ca2+]7.5 mmol/L,并用 10 mmol/L HEPES保持pH相对稳定。研究发现,在较高酶浓度下(1.5 mg/ml),虽然胰岛能更彻底地从腺泡组织中释放出来,但消化时间不好把握,如果时间过长,不利于胰岛的纯化并减少产量;在较低酶浓度下(0.5 mg/ml),胰岛不易从腺泡组织中脱落,须延长消化时间;在1.0 mg/ml的酶浓度下,消化时间相对比较好把握,振荡消化25 min能获得最高的胰岛产量。需要注意的是,在消化过程中振荡动作应轻柔,避免过度用力,否则也容易产生胶状物并降低胰岛产量和质量。另外,不同类型、不同批号的胶原酶其酶活性是不一样的[11],即使是同一批酶,新鲜配置的酶溶液活性要强于配置后储存的酶溶液。因此,在不同情况下,小鼠胰岛分离条件的具体方案可能需做适当调整以期达到最佳效果。
总之,影响胰岛细胞分离纯化的因素较多,包括胶原酶灌注方法的差异、不同消化酶的应用、消化条件的不同程度地掌握以及操作人员熟练度等,这些因素始终贯穿着整个胰岛细胞分离纯化的过程,要提高胰岛分离效果,关键在于对细节的把握和处理。本研究比较了不同胶原酶浓度和不同消化时间对小鼠胰岛分离纯化后产量和质量的影响,为小鼠胰岛分离纯化提供了实验依据。
[1]Cattan P,Berney T,Schena S,et al.Early assessment of apoptosis in isolated isletsof Langerhans[J].Transplantation,2001,71(7):857-862.
[2]蒋铁建,胡敏.啮齿类动物胰岛的分离与纯化[J].国外医学内分泌学分册,2001,21(1):36-38.
[3]Latif ZA,Noel J,Alejandro R.A simple method of staining fresh and cultured islets[J].Transplantation,1988,45(4):827-830.
[4]Amoli MM,Moosavizadeh R,Larijani B.Optimizingconditionsfor rat pancreatic isletsisolation[J].Cytotechnology,2005,48(1-3):75-78.
[5]Nano R,Clissi B,Melzi R,et al.Islet isolation for allotransplantation:variablesassociated with successful islet yield and graft function[J].Diabetologia,2005,48(5):906-912.
[6]Andrades P,Asiedu C,Ray P,et al.Islet yield after different methods of pancreatic liberasedelivery[J].Transplant Proc,2007,39(1):183-184.
[7]Lakey JR,Warnock GL,Shapiro AM,et al.Intraductal collagenase delivery into the human pancreas using syringe loading or controlled perfusion[J].Cell Transplant,1999,8(3):285-292.
[8]陈创奇,詹文华,汪建平,等.多种分离纯化大鼠胰岛细胞的实验方法比较[J].中山医科大学学报,2002,23(2):118-120.
[9]周茂华,陈东明,唐军民,等.大鼠胰岛移植物制备与异种移植[J].中华器官移植杂志,1998,19(4):200-201.
[10]要秀,保庭毅.大鼠胰岛分离与纯化的实验研究[J].第四军医大学学报,2001,22(4):383-384.
[11]Saudek F,Cíhalová E,Karasová L.Islet yield and early function in rat-to-mousetransplantation usingdifferent typesof collagenase[J].Transplant Proc,1997,29(4):1963-1964.
