维生素E在青年和老年大鼠肾脏缺血/再灌注损伤中的作用*
2010-05-24王燕凌王惠娟苗智慧夏晓红2
张 伟,王燕凌,王惠娟,苗智慧,夏晓红2,△
(1.华北煤炭医学院生理教研室,河北 唐山 063000;2.河北医科大学生理教研室,石家庄 050017;3.河北省医学科学院医学研究所,石家庄 050021)
肾脏缺血/再灌注损伤(renal ischemia/reperfusion injury,RI/RI)是缺血性急性肾功能衰竭的重要环节,而后者是临床常见急危重症,预后险恶,死亡率高。以往的研究表明,肾脏缺血再灌注损伤的发病机制与氧自由基(oxygen free radical,OFR)所致的脂质过氧化损伤密切相关。目前研究认为,活性氧的蓄积容易引起氧化损伤,这与老年肾脏疾病及衰老过程密切相关。而机体内抗氧化系统在阻止活性氧(reactive oxygen species,ROS)的氧化损伤作用时起着关键性的作用。本实验以青年和老年大鼠作为主要研究对象,探讨氧化和抗氧化防御系统失衡以及热休克蛋白70(heat shock protein,HSP70)、一氧化氮(nitrc oxide,NO)、诱生型一氧化氮合酶(inducible nitric oxide synthase,iNOS)在肾损伤中的作用,为预防老年肾脏疾病提供理论依据。
1 材料与方法
1.1 实验动物分组
雄性SD大鼠36只(由河北医科大学实验动物中心提供),分为青年鼠组(10周龄,体重200~300g)18只,老年鼠组(20月龄,体重500~650g)18只。每组又随机分为假手术组(YC和AC组)、缺血/再灌注组(YI/R和AI/R组)、缺血/再灌注+维生素E组(YI/R+VE和AI/R+VE组)。
1.2 药品与仪器
血尿素氮(blood urea nitrogen,BUN)、血肌酐(serum creatinine,Scr)试剂盒购自北京北化康泰临床试剂有限公司,丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)、NO试剂盒购于南京建成生物工程研究所,HSP70抗体购自Santa Cruz公司,iNOS试剂盒购自上海沪尚生物科技有限公司,Epics-XLⅡ型流式细胞仪(Beckman Coulter)等。
1.3 肾脏缺血/再灌注损伤模型制作
将SD大鼠用3%的戊巴比妥钠溶液(100mg/kg)腹腔麻醉,开腹,暴露双侧肾动、静脉。采用夹闭双侧肾动、静脉45 min后恢复血流的方法,复制肾缺血/再灌注损伤模型。再灌后逐层缝合腹膜,腹壁肌肉和皮肤。假手术组除不夹闭双侧肾动、静脉外,余手术操作同实验组。给药组于手术前灌胃给药饲养一个月,VE的给药剂量为24h 500mg/kg,再灌注后24h取腹主动脉血和肾皮质组织,待测各规定指标。
1.4 测定指标
1.4.1 血清MDA含量测定 采用硫代巴比妥法。过氧化脂质降解产物中的丙二醛可与硫代巴比妥酸缩合,形成红色降解产物,在532 nm处有最大吸收峰。结果以nmol/ml表示。严格按照试剂盒说明书进行操作。
1.4.2 血清SOD含量测定 通过黄嘌呤及黄嘌呤氧化酶反应体系产生超氧阴离子自由基(O2-),后经氧化羟胺形成亚硝酸盐,在显色剂的作用下呈现紫蓝色,用可见分光光度计测量其吸光度。酶的活力单位:每毫升反应液中SOD抑制率达50%时所对应的SOD量为一个活力单位(U)。结果以U/ml表示。严格按照试剂盒说明书进行操作。
1.4.3 血清BUN含量测定 采用OPA法。在酸性环境中,尿素在催化剂的作用下,可与显色剂反应,生成蓝色化合物,其颜色的深浅与尿素含量成正比。结果以mg/L表示。严格按照试剂盒说明书进行操作。
1.4.4 血清Scr含量测定 采用苦味酸不除蛋白法。应用血清肌酐测定试剂盒检测再灌后24h血清中肌酐含量,结果以mg/L表示。严格按照试剂盒说明书进行操作。
1.4.5 血清NO含量测定 采用硝酸还原酶法。NO化学性质活泼,在体内代谢会很快转变成和,而又进一步转化成,本法应用硝酸还原酶特异性将还原为,通过显色深浅测定其浓度的高低。应用血清NO测定试剂盒检测再灌后24h血清中NO含量,结果以μmol/L表示。严格按照试剂盒说明书进行操作。
1.4.6 血清iNOS含量测定 采用双抗体夹心酶标免疫分析法测定标本中iNOS水平。用纯化的抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入iNOS抗原、生物素化的抗大鼠iNOS抗体、HRP标记的亲和素,经过彻底洗涤后用底物TMB显色。TMB在过氧化物酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。颜色的深浅和样品中的iNOS呈正相关。用酶标仪在450nm波长下测定吸光度(A值),计算样品浓度。
1.5 组织标本的处理
1.5.1 肾皮质细胞凋亡率 将70%乙醇固定的肾皮质组织在120目不锈钢网上剪、搓碎,300目铜网过滤制备为单细胞悬液,悬液浓度为1×108cells/L,取悬液0.1 ml加入10%鸡红细胞作为内参标准,与样品同步染色,加入碘化丙啶(PI)(PI:50mg/L,triton-x 1001.0%)1 ml,4℃冰箱染色 30min,500目铜网过滤,488 nm上机检测。
1.5.2 肾皮质细胞HSP70表达 肾组织石蜡切片,切片厚4μm,应用免疫组织化学方法检测肾皮质细胞中的HSP70,操作按试剂盒说明书进行。HSP70结果判断:细胞胞浆呈棕黄色者为HSP70阳性反应,不着色者为阴性。
1.6 统计学分析
2 结果
2.1 VE对RI/RI大鼠血清中BUN和Scr的影响
RI/RI后大鼠肾功能明显受损,YI/R和AI/R组BUN和Scr均分别高于YC和AC组(P<0.01),而YI/R+VE和AI/R+VE组BUN和Scr均分别低于YI/R和AI/R组(P<0.05,P<0.01,表1)。
2.2 VE对RI/RI大鼠血清中MDA和SOD的影响
YI/R组MDA含量与YC组相比无显著性差异,AI/R组MDA含量大于AC组,而YI/R+VE和AI/R+VE组MDA含量均分别明显低于YI/R和AI/R组(表1);YI/R和AI/R组SOD含量均分别明显低于YC和AC组,而YI/R+VE和AI/R+VE组SOD含量均分别明显高于YI/R和AI/R组(表1)。
2.3 VE对RI/RI大鼠血清中NO和iNOS的影响
YI/R和AI/R组NO均分别高于YC和AC,而YI/R+VE和AI/R+VE组NO均分别显著高于YI/R和AI/R组;YI/R和AI/R组iNOS均分别显著低于YC和AC,而YI/R+VE和AI/R+VE组iNOS均分别显著低于YI/R和AI/R组(表1)。
2.4 VE对肾皮质HSP70表达的影响
YC和AC组正常肾近曲小管上皮细胞,未见棕黄色颗粒。YI/R和AI/R组肾近曲小管上皮细胞明显坏死并伴有少量的棕黄色颗粒。YI/R+VE和AI/R+VE组肾近曲小管上皮细胞坏死较轻并伴有大量的棕黄色颗粒,并且YI/R+VE组HSP70的表达强于AIR+VE组(图1)。
2.5 VE对肾皮质细胞凋亡的影响
YI/R和AI/R组出现明显的凋亡峰,凋亡率分别高于YC和AC组;YI/R+VE和AI/R+VE组凋亡率均明显低于YI/R和AI/R组(图2)。
Tab.1 Effects of VE on contents of BUN,Scr,MDA,SOD,iNOS and NO in RI/RI rats(,n=6)
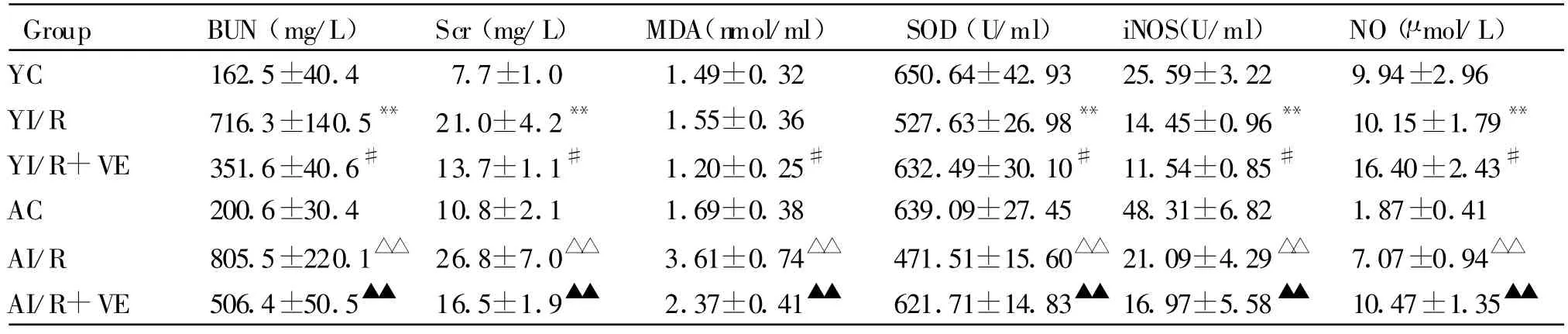
Tab.1 Effects of VE on contents of BUN,Scr,MDA,SOD,iNOS and NO in RI/RI rats(,n=6)
YC:Young control;YI/R:Young ischemia/reperfusion;YI/R+VE:Young ischemia/reperfusion+vitamin E;AC:Aged control;AI/R:Aged ischemia/reperfusion;AI/R+VE:Aged ischemia/reperfusion+vitamin E**P<0.01 vs YC;#P<0.05 vs YI/R;△△ P<0.01 vs AC;▲▲ P<0.01 vs AI/R
Group BUN(mg/L) Scr(mg/L) MDA(nmol/ml) SOD(U/ml) iNOS(U/ml) NO(μmol/L)YC 162.5±40.4 7.7±1.0 1.49±0.32 650.64±42.93 25.59±3.22 9.94±2.96 YI/R 716.3±140.5** 21.0±4.2** 1.55±0.36 527.63±26.98**14.45±0.96** 10.15±1.79**YI/R+VE 351.6±40.6# 13.7±1.1# 1.20±0.25# 632.49±30.10# 11.54±0.85# 16.40±2.43#AC 200.6±30.4 10.8±2.1 1.69±0.38 639.09±27.45 48.31±6.82 1.87±0.41 AI/R 805.5±220.1△△ 26.8±7.0△△ 3.61±0.74△△ 471.51±15.60△△ 21.09±4.29△△ 7.07±0.94△△AI/R+VE 506.4±50.5▲▲ 16.5±1.9▲▲ 2.37±0.41▲▲ 621.71±14.83▲▲ 16.97±5.58▲▲ 10.47±1.35▲▲
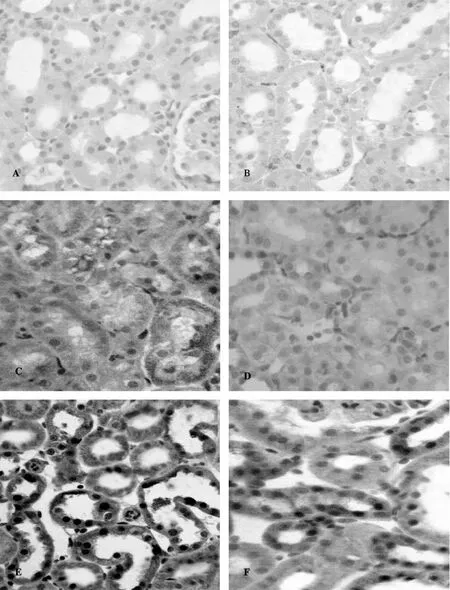
Fig.1 Microphotographs showing the expression of HSP 70in renal tubular epithelial cells by immunohistochemistry in different groups(SP×400)
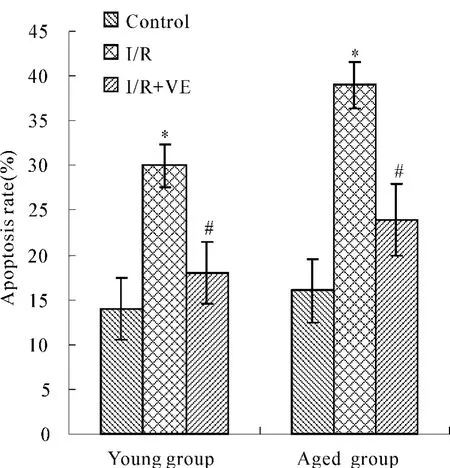
Fig.2 Effect of VE on the apoptosis rate of renal cortex cells in RI/RI rat(¯x ± s,n=6)
3 讨论
本实验采用我室以往的研究方法[1],夹闭双侧肾动、静脉45 min后恢复血流,复制肾缺血/再灌注损伤模型,观察再灌注后24h青年和老年大鼠的肾功能指标。结果显示再灌注后BUN和Scr含量均升高并且老年组升高的更明显,表明老年大鼠肾功能损伤更严重。青年IR组与青年control组相比MDA变化不明显(P>0.05),这可能与青年大鼠体内抗氧化防御系统功能较好,能够在一定范围内抵御外来的或体内的氧化损伤有关。老年IR组MDA含量高于青年IR组而SOD含量低于青年IR组,提示随着增龄,SOD活性逐渐减低,而MDA含量却明显增高与Loong CC等人的报导相一致[2]。SOD的测量可反映组织内的自由基水平及脂质过氧化的程度[3]。抗氧化剂的缺乏使ROS等自由基的水平更高,导致肾脏细胞内生物大分子的损伤,诱导生命体逐渐衰老。老年大鼠抗氧化酶活性逐渐减弱,当发生缺血/再灌注时,更容易受到自由基的攻击,引发肾脏的疾病。Rusting等[4]培养出一种寿命几乎两倍于野生型的果蝇,发现这种长寿命果蝇体内的SOD活性非常高。很多实验也证明SOD减少加重了肾脏氧化损伤[5],与本实验研究结果相吻合。而给予VE治疗后BUN、Scr、MDA 较IR组明显降低,并且青年组降低的更明显与国外的文献报道一致[2,6],其机制可能为:(1)VE可能通过抑制黄嘌呤氧化酶的活性,减少OFR的产生来保护肾脏对抗缺血再灌注损伤[7],每一摩尔的VE氧化时能还原两摩尔自由基,它能插入到生物膜中而且其苯环上酚羟基易失去H+而被氧化,从而清除自由基防止生物膜中磷脂被氧化;(2)VE可提高血浆SOD水平,SOD可使有毒的O2-和H2O2经过歧化和还原得到清除,从而阻止其引起自由基的链锁反应而降低自由基代谢产物(MDA)的生成;③VE还能提高谷胱甘肽过氧化物酶(GSH-Px)和过氧化氢酶(CAT)水平,CAT可清除过氧化氢而GSH-Px催化分解部分H2O2,从而使VE清除自由基的范围更加扩大。
本实验观察到,I/R组NO和HSP70表达较正常对照组增加而iNOS表达较正常对照组减弱;I/R+VE组NO和HSP70表达较I/R组增加而iNOS表达含量较I/R组减弱,并且青年组NO和HSP70的表达高于相应老年组结果提示老年大鼠抵抗缺血性损伤的能力逐渐减弱,当发生缺血再灌注时,不容易激发更多的HSP70来保护肾脏。给予VE后NO含量升高而iNOS表达下降,有文献报道[8]HSP70能抑制NFkB的活化,NFkB调控着诸多因子(如细胞因子和iNOS等)的表达[9]。国外实验研究证实HSP70可以抑制人成纤维细胞中iNOS的表达[10]。本实验结果中NO含量增加可能是HSP70抑制iNOS的表达,从而直接或间接的促进了由cNOS诱导的具有保护作用的NO表达。
一些研究表明,RI/RI时NO产生增多。其机制为:RI/RI时缩血管物质产生增多,机体为了维持组织器官的血流灌注,NO生成增多,对机体发挥生理性的保护作用本实验中I/R组肾皮质细胞凋亡显著,I/R+VE组肾皮质细胞凋亡明显轻于IR组。可能是VE促进HSP70大量表达,抑制NFkB的活化,从而抑制参与凋亡的促炎因子表达,降低肾皮质细胞的凋亡。由cNOS诱导的NO可能通过以下途径保护肾脏,抑制凋亡:(1)生理性调节血管紧张性,抑制血小板聚集、减少白细胞粘附于血管内皮细胞、清除氧自由基、维持血管渗透压。(2)抑制平滑肌细胞增殖、免疫防御、刺激内皮细胞再生。(3)与自发或SOD歧化的O2发生反应来减少H2O2在缺血器官的聚集,避免其转变为具有更大细胞毒性的OH-损伤内皮细胞。
程序化细胞死亡通路的激活在RI/RI机制中起重要作用,随着年龄的增长机体清除自由基的能力以及激发HSP70和NO的能力越来越弱,当遭遇RI/RI时肾皮质细胞凋亡的更严重,在缺血再灌注前灌胃给予VE,可显著保护老年大鼠缺血再灌注肾脏的功能,减轻肾脏的结构损伤,缩小损伤范围,加之其具有药源广泛、吸收迅速等特点,因此,进一步对VE开展深入研究将可能为临床防治老年肾缺血再灌注损伤提供新的可能性。
[1]夏晓红,申玉学,石纪才,等.内皮素抗体在大鼠肾缺血/再灌注损伤的作用[J].中国病理生理杂志,1999,15(5):415-417.
[2]Loong C C,Chang Y H,Wu T H,et al.Antioxidant supplementation may improve renal transplant function:a preliminary report[J].Transplant Proc,2004,36(8):2438-2439.
[3]Yokoyama I,Negita M,Liu D G,et al.Prevention of freeradical induced apoptosis by induction of human recombinant Cu,Zn-SOD in pig endothelial cells[J].Transpl Int,2002,15(5):220-225.
[4]Rusting R L.Why do we age[J]?Sci Am,1992,267(6):130-135.
[5]Son D,Kojima I,Inagi R,et al.Chronic hypoxia aggravates renal injury via suppression of Cu/Zn-SOD:a proteomic analysis[J].Am J Physiol Renal Physiol,2008,294(1):62-72.
[6]Shimizu M H,Araujo M,Borges S M,et al.Influence of age and vitamin E on post-ischemic acute renal failure[J].Exp Gerontol,2004,39(5):825-830.
[7]Unal D,Yeni E,Erel O,et al.Antioxidative effects of exogenous nitric oxide versus antioxidant vitamins on renal ischemia reperfusion injury[J].UrolRes,2002,30(3):190-194.
[8]Chen H,Wu Y,Zhang Y,et al.Hsp70inhibits lipopolysaccharide induced NF-kappaB activation by interacting with TRAF6 and inhibiting its ubiquitination[J].FEBS Lett,2006,580(13):3145-3152.
[9]刘少青,姜佑三,权昌益,等.HSP 70和iNOS的表达在大鼠肾脏缺血再灌注损伤中的作用[J].中华泌尿外科杂志,2001,15(4):245.
[10]RenisM,Cardile V,Grasso S,et al.Switching of HSP70and i-NOS to study their role in normal and H2O2-stressed human fibroblasts[J].Life Sci,2003,74(6):757-769.
