血清HPLC指纹图谱法研究芍药甘草汤伍用的合理性
2010-05-22陈梅姚楠周秋香黄卫华李友宾
陈梅,姚楠,周秋香,3,黄卫华,3,李友宾#
(1.南京中医药大学,南京市 210046;2.江苏省中医药研究院中药化学室,南京市 210028;3.中国药科大学,南京市 210009)
芍药甘草汤源于医圣张仲景的《伤寒论·太阳篇》,为解痉、缓急止痛的经典古方,由芍药和甘草等份组成。药虽两味,但结构严谨,配伍精当。白芍药味苦酸、性微寒,入肝脾两经,功专养血敛阴、柔肝止痛,症见脘腹诸痛、四肢挛急等证候。甘草性味甘平,入十二经,炙用益气补血、缓急止痛。两药相伍,其效倍增。本方已广泛应用于临床各科,其药理作用主要集中在解痉、镇痛镇静及抗炎方面。
“血清药理学”和“血清药物化学”概念的提出,使人们渐渐认识到中药中的众多成分只有被吸收入血者才能产生作用,血中含有的成分才可能是中药体内直接作用物质。中药的药效物质基础应在给药后的血清组成中进行探讨,对进入血清的成分进行研究,能在相对有限的成分中探明与复方效应相关的药效物质基础[1]。因此,可通过比较单味药、复方水煎液与单味药、复方含药血清HPLC指纹图谱,确定单味药和组成复方后入血成分“数”与“量”的变化,从而探讨芍药与甘草伍用的合理性。
1 材料
1.1 仪器
Waters Alliance高效液相色谱(HPLC)系统,包括Empower色谱工作站(美国Waters公司);AT-201型十万分之一电子天平(瑞士梅特勒-托利多仪器上海有限公司);R-200型旋转蒸发仪(瑞士步琪公司);Coulter Allegra 64R型多功能台式高速离心机(美国Beckman公司);涡旋混合器(江苏省金坛市医疗仪器厂);Milli-PORE纯水器(美国密理博公司)。
1.2 试药
炙甘草(批号:080919)、白芍(批号:080919)购自上海药房股份有限公司亳州徐重道中药饮片厂,经江苏省中医药研究院中药化学室李友宾研究员鉴定为真品;甘草酸(批号:ZL200806010)、甘草次酸(批号:ZL0807010A)购自南京泽朗医药科技有限公司;甘草酸二钾对照品(中国药品生物制品检定所,批号:100551-200401);乙腈(色谱纯,德国 Merck公司);甲醇(色谱纯,江苏汉邦科技有限公司);三氟乙酸(分析纯,上海天莲精细化工有限公司);甘草苷、甘草素、异甘草素、新甘草苷、芒柄花苷、异芒柄花苷、白芍苷、芍药苷、苯甲酸、4″-羟基白芍苷标准品为笔者自制(纯度>99%);水为Milli-PORE纯水器净化水。
1.3 动物
健康SD大鼠24只,♂,体质量(200±20)g,由江苏省中医药研究院实验动物中心提供(动物生产许可证号:SCXK(沪)2008-0005)。
2 方法与结果
2.1 色谱条件
色谱柱:AlltimaTMC18(250 mm×4.6 mm,5 μm);流动相:乙腈(A)-0.05%三氟乙酸水溶液(B),二元梯度系统(洗脱程序:0~5 min,15%A;5~10 min,15%A→20%A;10~17 min,20%A;17~30 min,20%A→25%A;30~42 min,25%A;42~85 min,25%A→40%A;85~105 min,40%A→50%A;105~125 min,50%A→82%A;125~150 min,82A%);检测波长:232 nm;流速:0.8 mL·min-1;柱温:25 ℃;进样量:20 μL。
2.2 供试品溶液的制备
取白芍、炙甘草药材各72 g,于10倍量蒸馏水中浸泡30 min,加热煮沸10 min,转文火煮1 h,趁热过滤。药渣继续加8倍量蒸馏水加热煮沸10 min,转文火煮1 h。合并2次煎出液,浓缩,定容至1 mL含生药1.44 g的芍药甘草汤水煎液,供灌胃和分析用。另取白芍、炙甘草各72 g,同法单煎、浓缩,配制成每1 mL含生药0.72 g的白芍水煎液与炙甘草水煎液,供灌胃和分析用。取上述药液各0.1 mL,置于10 mL量瓶中,蒸馏水定容,进样前0.45 μm微孔滤膜滤过。
2.3 对照品溶液的制备
取对照(标准)品甘草酸、甘草酸二钾、甘草次酸、甘草苷、甘草素、新甘草苷、芒柄花苷、异芒柄花苷、白芍苷、芍药苷、苯甲酸、4″-羟基白芍苷各1 mg,精密称定,加甲醇配制成一定浓度的对照品溶液,进样前0.45 μm微孔滤膜滤过。
2.4 受试大鼠给药方案
取SD大鼠24只,禁食过夜15 h(自由饮水),于次日早晨随机分成4组,即空白、白芍、甘草、芍药甘草汤组。ig给药(20 mL·kg-1),连续3次,每次间隔1 h,于末次给药后45 min眼底静脉丛取血。室温静置0.5 h,4000 r·min-1离心20 min,分离出血清冷冻(-20℃)至分析。
2.5 血清样品的制备
取待测血清1.5 mL,置于10 mL离心管中,加6 mL甲醇沉淀蛋白,涡旋振荡3 min,6000 r·min-1离心20 min去除蛋白质,取上清液5 mL,于40℃水浴上N2吹干,残渣加0.1 mL甲醇溶解,振荡2 min,进样前0.45 μm微孔滤膜过滤,供HPLC检测分析。
2.6 色谱条件的选择及优化
为了获得分离度好、灵敏性高以及检测峰数量尽可能多的色谱,对以下色谱条件及参数进行了选择及优化:流动相的组成、检测波长、流速以及运行时间。芍药甘草汤中主要含有黄酮类、皂苷类、单萜苷类、有机酸类等,这些化合物类群的极性差别很大,只能用梯度洗脱。根据文献[2],用乙腈和0.05%三氟乙酸水溶液组成的流动相进行梯度洗脱,结果得不到比较好的色谱。因而对梯度洗脱程序进行优化,选择乙腈和0.05%三氟乙酸水溶液梯度系统,流速最终确定为0.8 mL·min-1,检测波长为232 nm,运行时间为150 min。通过色谱条件的优化,得到的流动相系统和洗脱程序获得了较多的峰及较好的峰形。经200~400 nm全波长扫描检测,白芍、甘草及芍药甘草汤水煎液样品在上述优化的色谱条件下分离较好。单、复方水煎液样品的色谱见图1。
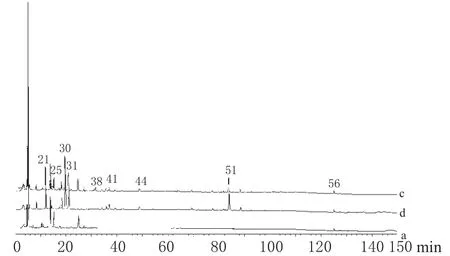
图1 单、复方水煎液样品的HPLCa.白芍水煎液;b.甘草水煎液;c.芍药甘草汤水煎液;21.白芍苷;25.芍药苷;30.新甘草苷;31.甘草苷;38.苯甲酸;41(.异)芒柄花苷;44(.异)甘草素;51.甘草酸;56.4″-羟基白芍苷Fig 1 HPLC fingerprint of decoctionsa.P.lactiflora decoction;b.G.uralensis decoction;c.Shaoyao gancao decoction;21.albiflorin;25.paeoniflorin;30.neoliquiritin;31.liquiritin;38.benzoic acid;41.(iso)ononin;44.(iso)liquirtigenin;51.glycyrrhizic acid;56.4″-hydroxyl-albiflorin
2.7 采血时间点的考察
取9只大鼠ig芍药甘草汤水煎液后9个时间点的血清样品,进行HPLC分析检测。由大鼠重复ig芍药甘草汤水煎液后不同时间点血清样品色谱图可见,重复给药后不同时间点色谱峰差异较小,说明重复多次给药有利于各成分保持稳定的血药浓度,避免了因单次给药不同类群化合物吸收速度不同所造成的影响。通过比较发现,45 min血清样品图谱中色谱峰峰数较多,峰值较高,故选择芍药甘草汤水煎液重复多次ig后45 min采血。色谱见图2。
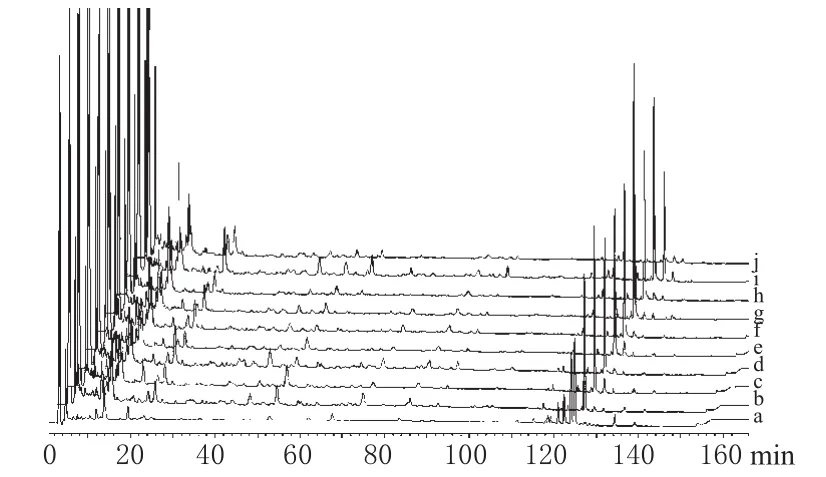
图2 芍药甘草汤水煎液给药后不同时间点血清样品的HPLCa.空白血清;b.15 min;c.30 min;d.45 min;e.60 min;f.90 min;g.120 min;h.240 min;i.300 min;j.360 minFig 2 HPLC fingerprints of Shaoyao gancao decoction at different administration timea.blank serum;b.15 min;c.30 min;d.45 min;e.60 min;f.90 min;g.120 min;h.240 min;i.300 min;j.360 min
2.8 方法有效性考察
为保证建立芍药甘草汤水煎液指纹图谱及大鼠给药后血清药物化学动态指纹图谱方法的稳定性、精密度、重复性,笔者对方法的有效性进行了考察。方法的精密度通过分析考察45 min血清样品,测定日内、日间各共有峰的相对保留时间(RRT)和相对峰面积(RPA)的相对标准偏差(RSD),其RSD分别<5%和<15%(n=5)。方法的重复性通过对同组6份大鼠ig芍药甘草汤水煎液后45 min血清样品RRT和RPA的RSD进行考察,其RSD分别<3%和<40%(n=6)。方法的稳定性主要考察了血清样品的稳定性,血清样品被冷冻0、24、48、72 h后解冻处理进行分析,其RRT和RPA的RSD分别<5%和<10%。以上数据可确保我们建立药材水煎液指纹图谱及血清药物化学动态指纹图谱方法的有效性。芍药甘草汤含药血清样品的精密度、重复性及稳定性试验结果见表1。
2.9 血清HPLC指纹图谱分析
对大鼠重复多次ig给药后45 min血清样品图谱进行色谱指纹图谱相似度分析,获得其共有峰。根据其相应的紫外光谱数据,与空白血清HPLC图谱色谱峰比较,芍药甘草汤给药后血清样品有32个血中移行组分(SGT1~SGT32),其中17个为原方直接入血成分,15个为代谢产物。白芍水煎液给药后血清样品有8个入血成分(S1~S8);甘草水煎液给药后血清样品有23个血中移行成分(G1~G23)。复方入血成分SGT1、SGT2、SGT6、SGT7、SGT14、SGT16、SGT20、SGT26来源于白芍血中移行成分 S1~S8,其中 SGT1、SGT2、SGT6、SGT7、SGT14为白芍所含成分直接入血形成;复方入血成分SGT2、SGT3、SGT4、SGT5、SGT8、SGT9、SGT10、SGT11、SGT13、SGT15、SGT17、SGT18、SGT19、SGT21、SGT22、SGT24、SGT 25、SGT27、SGT28、SGT29、SGT30、SGT31、SGT32 来源于甘草血中移行成分G1~G23,其中SGT2、SGT3、SGT4、SGT8、SGT9、SGT10、SGT11、SGT15、SGT17、SGT18、SGT21、SGT 25、SGT29为甘草所含成分直接入血形成,SGT2为白芍、甘草共同含有的物质入血而成;复方给药后血清中产生了单煎液给药后未出现的新物质SGT12与SGT23。经与对照品比较,SGT6、SGT7分别为白芍苷、芍药苷;SGT10、SGT11、SGT29、SGT32分别为新甘草苷、甘草苷、甘草酸和甘草次酸。复方配伍与单味生药相比,其入血成分存在差异。因此,在研究复方药物的作用物质基础时,不能直接以单味药血中移行成分的简单加和来代替全方,而应该充分考虑到配伍后化学成分间的相互作用。
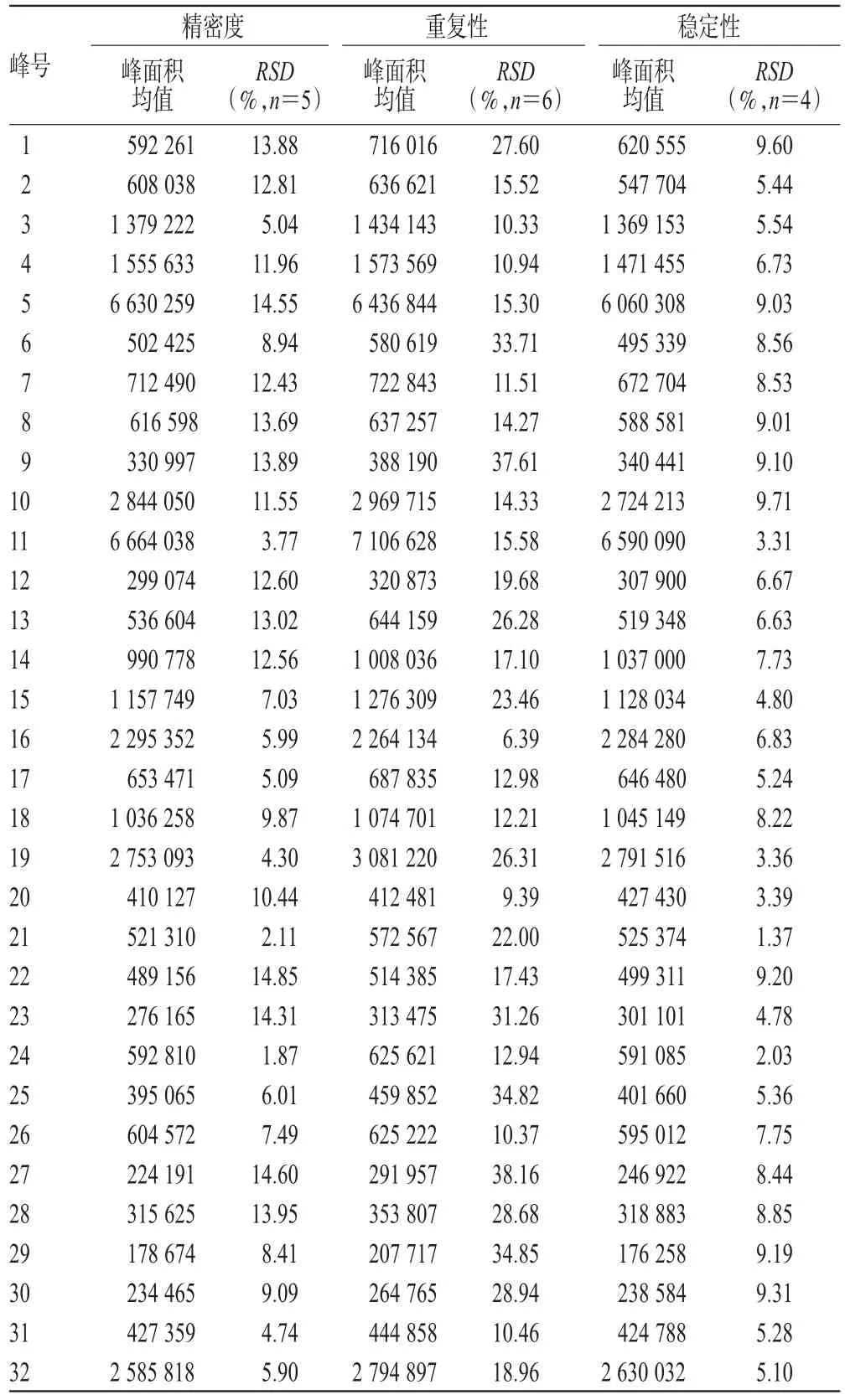
表1 芍药甘草汤含药血清样品的精密度、重复性及稳定性试验结果Tab 1 Results of precision,repeatability and stability of serum samples of Shaoyao gancao decoction
由白芍水煎液、甘草水煎液及芍药甘草汤水煎液给药后血清样品HPLC可见,相较单方水煎液给药后血清样品,大鼠ig芍药甘草汤复方水煎液后吸收入血的成分明显增多。白芍单方水煎液ig后入血成分含量较低,但配伍甘草后,SGT6(白芍苷)、SGT7(芍药苷)、SGT14、SGT16、SGT26峰面积则明显增加;复方血清样品中SGT10(新甘草苷)、SGT11(甘草苷)、SGT15、SGT17、SGT18、SGT24、SGT25、SGT27、SGT28、SGT29(甘草酸)、SGT32(甘草次酸)峰面积也相应较甘草单方水煎液血清样品高。
3 讨论
有文献[3]报道,以甘草的甲醇提取物FM100(主成分为甘草酸及多种甘草黄酮)代表甘草,芍药苷代表芍药,对本方的药理作用进行研究,发现二者并用在镇痛方面有明显的协同作用。木村正康[4]用芍药、甘草的提取物芍药苷和甘草皂苷研究本方对骨骼肌的松弛作用,结果表明以单味作用不明显的浓度将芍药苷和甘草皂苷按4∶1的克分子比相互组合,可对神经肌肉接合部位呈阻断作用;将单用呈现作用浓度的芍药苷和单用不呈作用浓度的1/4量的甘草皂苷共存,可使芍药苷的反应增强2倍左右,提示本方对骨骼肌的松弛作用较单味药强。Kimura M等[5]发现,芍药苷与甘草酸同用时可以间接阻断因刺激引起的颤搐,而在相同浓度情况下两者单用时无阻断作用。也有学者[6]研究发现,芍药苷和甘草酸对小鼠神经刺激的骨骼肌细胞内Ca2+的流通具有互补作用,从而阻断神经肌肉传递,缓解肌肉疼痛。可见,芍药、甘草效应组分(芍药苷、甘草黄酮、甘草酸部位)是芍药甘草汤解痉、镇痛、镇静作用的有效部位[7]。
有学者[8]发现,甘草总苷和白芍总苷的抗炎镇痛作用明显弱于本方总苷。可见,本方组成成分甘草总苷和白芍总苷具有一定的协同效应。另有学者[9]通过动物实验研究发现,全方作用贡献度为芍药>甘草,两药之间具有协同作用。经拆方研究[10]发现,本方对小鼠胃排空功能可出现较甘草单独使用时更为明显的抑制作用,芍药可加强其对胃排空的抑制作用。
此外,通过药动学研究发现,大鼠分别灌胃给予本方和单味甘草汤后,本方中甘草酸和甘草次酸的血药浓度、生物利用度显著增高[11]。另有研究[12]表明,口服芍药苷的生物利用度是很低的,但是甘草能有效增强芍药苷的吸收,提高其在血液中的浓度;与单独口服芍药提取物后芍药苷的动力学参数相比,口服本方后芍药苷的吸收明显增强。药动学研究结果表明,本方在临床应用中具有药理学上的协同作用。
本文采用血清HPLC指纹图谱法研究芍药甘草汤伍用的合理性,由单方及芍药甘草汤复方血清指纹图谱可见,因为与甘草配伍,使芍药效应组分白芍苷、芍药苷等更多地吸收进入血液,提高其生物利用度;甘草与芍药伍用后,其效应组分甘草苷、新甘草苷、甘草酸、甘草次酸等的入血峰面积明显较甘草单方水煎液血清样品增加,可见甘草的生物利用度也明显提高。综上,两者伍用存在相互协同的作用,这和其他研究方法得出的结论一致,但比其他方法简便直观,从另一个角度验证了本方组方配伍的科学合理性。
[1]Xijun Wang,Wenjun Sun,Hui Sun,et al.Analysis of the constituents in the rat plasma after oral administration of Yin Chen Hao Tang by UPLC/Q-TOF-MS/MS[J].J Pharmaceut Biomed,2008,46(3):477.
[2]张 梁,徐德生,冯 怡.芍药甘草复方大鼠血中移行组分归属分析研究[J].中国中药杂志,2007,32(17):1789.
[3]Keijiro T,Masatoshi H.Pharmacological studies on herb paeony rootⅠ.Central effects of paeoniflorin and combined effects with licorice component FM100[J].Yakugaku zasshi,1969,89(7):879.
[4]木村正康.芍药甘草汤对骨骼肌松弛作用的机制[J].国外医学-中医中药分册,1983,5(6):21.
[5]Kimura M,Kimura I,Takahashi K,et al.Blocking effects of blended paeoniflorin or its related compounds with glycyrrhizin on neuromuscular junctions in frog and mouse[J].Jpn J Pharmacol,1984,36(3):275.
[6]Katsuya D,Ikuko K,Kayoko M,et al.Complementary effects of Paeoniflorin and Glycyrrhizin on intracellular Ca2+mobilization in the nerve-stimulated skeletal muscle of mice[J].Jpn J Pharmacol,1995,69(3):281.
[7]郝 飞.甘草酸国外研究进展[J].中国药房,2001,12(8):501.
[8]刘陶世,赵新慧,段金廒,等.芍药甘草汤总苷抗炎镇痛作用的配伍研究[J].中药新药与临床药理,2007,18(6):427.
[9]钟志勇,龚奥娣,韩 坚,等.用多指标正交设计合并线性回归法探讨芍药甘草汤的最佳配比[J].中药药理与临床,2005,21(6):7.
[10]李 岩,陈苏宁,李宇权,等.芍药甘草汤、四逆散对胃排空及小肠推进功能影响的拆方研究[J].中国消化杂志,1996,16(1):18.
[11]项 琪,程 刚,陈济民.芍药甘草汤在大鼠体内药代动力学研究[J].中国药学杂志,2000,35(9):615.
[12]Lih-Chi Chen,Mei-Huei Chou,Ming-Fang Lin,et al.Pharmacokinetics of Paeoniflorin after oral administration of Shao-yao Gan-chao Tang in mice[J].Jpn J Pharmacol,2002,88(3):250.
