流式细胞仪分选纯化人脂肪干细胞体外成骨活性的实验研究
2010-03-27李俊宪孙恒赟袁捷赵明衍韦敏
李俊宪 孙恒赟 袁捷 赵明衍 韦敏
流式细胞仪分选纯化人脂肪干细胞体外成骨活性的实验研究
李俊宪 孙恒赟 袁捷 赵明衍 韦敏
目的利用流式细胞仪分选人脂肪干细胞(Human adipose-derived stem cells,hADSCs)并检测其体外成骨活性。方法分离hADSCs,通过流式细胞仪以CD105作为表面标志进行分选,所得细胞成骨诱导培养,以CD105-细胞、未分选细胞作为对照。2周后进行碱性磷酸酶(AKP)和骨钙蛋白(OCN)定量PCR和Western-blot检测。结果流式细胞分选所得CD105+hADSCs细胞约占单核细胞的50%。定量PCR和Western-blot检测均显示分选hADSCs成骨诱导后,AKP和OCN的表达均显著高于CD105-细胞组及未分选细胞组(P<0.05)。结论诱导分选纯化后的hADSCs有较好的成骨活性,可作为骨组织工程的种子细胞。
脂肪干细胞 碱性磷酸酶 骨钙蛋白
目前,组织工程技术在骨缺损修复中已经成为研究热点。骨髓基质干细胞(BMSCs)具有能大量扩增,诱导培养时可稳定向成骨细胞转化,并且获取时对机体损伤小等特点,被认为是修复骨缺损较理想的种子细胞[1]。
近年来的研究发现,脂肪干细胞(ADSCs)同样可以在体外大量扩增,具有多向分化潜能,且获取容易,获取量大,患者极易接受,已成为当前种子细胞研究的新热点[2]。ADSCs作为种子细胞可修复鼠颅骨、腭骨缺损[3-4];ADSCs中成骨分化细胞相对不纯,影响了修复长骨缺损效果[5]。所以,我们需要进一步对其进行纯化。有文献报道通过免疫磁珠分选出CD105+细胞,其增殖活性较强,且植入体内可良好成骨[6]。因此,本研究旨在采用CD105作为表面标志流式细胞分选ADSCs,并体外诱导后检测其成骨活性表达情况,为进一步构建可承力组织工程骨提供理论依据。
1 材料与方法
1.1 材料
人腹部脂肪颗粒来自20~30岁行脂肪抽吸术女性(n=6);地塞米松、β-磷酸甘油钠和2-磷酸抗坏血酸(Sigma公司)。 培养皿、离心管(Falcon公司)。超声匀浆机(Sonics&Materials公司)。DU-640紫外分光光度计及流式细胞仪(Beckman Coulter公司)。CD105荧光标记抗体(BD公司)。定量PCR检测相关试剂(Invitrogen和Promega公司),荧光定量PCR仪为Applied Biosystems 7000 Real Time PCR System。Western-blot检测相关抗体(SANT CRUZE公司)。电泳仪、垂直电泳槽、半干转膜仪(BIO-RAD公司)。凝胶成像仪为TANON GIS-2008。
1.2 实验方法
人腹部脂肪颗粒获取后以PBS清洗,0.1%胶原酶消化分离出单核细胞,以4×104cells/cm2的密度接种于培养皿中,加入DMEM培养液,置 37℃、5% CO2培养箱内培养。培养4~5 d后,0.25%胰蛋白酶消化,制备成单细胞悬液,300 g离心 5 min,去上清,加入含4%FBS的PBS,加入CD105抗体,4℃30 min,再离心去上清,用含4%FBS的PBS洗2遍,流式细胞仪进行细胞分选,分选出CD105+hADSCs。CD105+hADSCs和CD105-hADSCs,以及未分选的hADSCs均以4×104cells/cm2的密度接种于培养皿中,加含有地塞米松 (10 nmol/L)、β磷酸甘油钠(2.16 g/L)和2-磷酸抗坏血酸(37.5 mg/L)的DMEM成骨条件培养液,置37℃、5%CO2培养箱内培养,培养2周后进行各项检测。
1.2.2 定量PCR检测
分别取上述3组细胞(n=6),以0.25%胰蛋白酶消化,制备成单细胞悬液,对AKP和OCN表达情况进行定量PCR检测。AKP引物:上游序列 5-GGAAGGAGGCAGAATTGACCA-3;下游序列5-GCCATACAGGATGGCAGTGAA-3。OCN引物:上游序列5-AAAGGTGCAGCCTTTGTGTCC-3;下游序列5-ACTCGTCACAGTCCGGATTGAG-3。
首先抽提总RNA,随后进行逆转录反应,所用总RNA量为2 μg,反应总体积为20 μL体系。在65℃水浴处理5 min,室温放置10 min,高速(高于5 000 g)离心5 sec。随后按下列顺序在1.5 mL离心管中加入下列反应物 (加入之后总体积为20 μL):RNA酶抑制剂(50 U/μL)0.5 μL,5×buffer(Promega)4 μL,dNTP MIX(10 mM/each)2 μL,DTT 2 μL,MMLV(200 U/μL)1 μL。水浴37℃下反应1 h,90℃处理5~10 min,冰浴5 min,高速离心5 sec。
随后进行荧光定量PCR,为20 μL体系置入定量PCR仪反应,并预制标准曲线。
1.2.3 Western-blot检测
分别在上述3组细胞 (n=6)中加入PBS溶液200 μL,同时加入适当浓度的蛋白抑制剂PMSF,冰上超声波处理至组织完全分散,离心,然后测定蛋白含量。将样品稀释至相同总蛋白含量,取150 μL样品加入5×SDS上样buffer 20 μL,95℃处理10 min。每上样孔加样30 μL。随后按下述步骤对AKP和OCN表达情况进行Western-blot检测。
首先进行SDS-PAGE电泳,待跑出分离胶后再进行 Western-Blot。小心将胶放入 100 mL阴极buffer,平衡15 min;用尺子量胶的大小,剪同样大小的一片PVDF膜,用甲醇(100%)浸泡15 sec,再用双蒸水浸泡2 min,取出用阳极bufferII平衡10 min;随后以半干法转膜:按顺序放胶、膜和滤纸,插上电源,1.2 mA/cm2转膜1 h;转膜完成后,将膜与胶及滤纸小心剥离,将膜放入甲醇中10 sec,用镊子取出置于滤纸上,待甲醇蒸干(约15 min);用丽春红溶液检测转膜效率,再用去离子水洗去丽春红;将膜在一抗中孵育2 h或4℃过夜 (一抗溶于封闭液,1∶200稀释);用TTBS洗3次,每次轻摇 10 min;在二抗(1∶2 000,用封闭液稀释)中孵育1 h;用TTBS洗3次,每次轻摇10 min;用DBA溶液显色;当显色达到需要时,用水洗膜以终止反应;膜用TANON GIS-2008凝胶成像仪拍照并用天能GIS凝胶图像处理系统进行数据分析,采用平均密度×净面积进行比较 (即各组蛋白电泳条带平均密度×净面积/各自对应 β-actin蛋白电泳条带平均密度×净面所得比值)。
素养考查分析:该题以立体几何为知识载体,考查学生对“面面垂直”的判定定理、直线与平面所成角等几何学科知识的掌握,要求学生根据平面图形进行空间想象,结合已知条件进行逻辑推理,书写完整的几何证明过程,并进行相关计算.
1.3 统计学方法
数据以(均数±标准差)表示,所测数据采用方差分析,组间采用Student-Newman-kewls方法进行比较。P<0.05认为有显著性差别,统计软件包为SAS Ver.6.12。
2 结果
2.1 流式细胞仪分选
流式细胞仪以CD105作为表面标志阳性,分选出具有成骨分化潜能的hADSCs,其比例约占单核细胞的50%,进一步流式细胞仪验证其CD105+纯度可达80%,体外成骨诱导培养后生长良好,形成钙结节,较未分选细胞组好(图1)。

图1 流式细胞仪分选

图3 Real-time PCR各组扩增平均拷贝数
2.3 Western-blot检测
AKP和OCN的比值均为CD105+hADSCs组最高 (分别为3.21±0.25和3.82±0.52),CD105-hADSCs组最低 (分别为0.47±0.13和0.90±0.24),未分选hADSCs组(分别为1.42±0.15和2.13±0.43)介于两者之间,CCD105+hADSCs组与其他两对照组间AKP和OCN蛋白表达均有显著性差异(P<0.05)(图4)。
2.2 定量PCR检测
AKP和OCN表达均是CD105+hADSCs组最高,CD105-hADSCs组最低,未分选hADSCs组介于两者之间,CD105+hADSCs组与其他两对照组间均有显著性差异(P<0.05)(图2,3)。
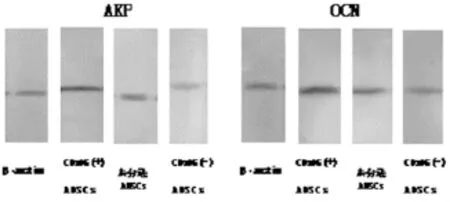
图4 Western-blot检测结果

图2 Real-time PCR所有样品扩增曲线
3 讨论
BMSCs作为骨组织工程的种子细胞,其体外成骨活性已获肯定。我们的前期研究已采用BMSCs复合珊瑚及磷酸三钙构建骨组织,成功修复了羊股骨节段缺损和犬下颌骨节段缺损[7-9]。但是,人体的骨髓量有限,而且骨髓还是造血干细胞的来源之一,过量抽取骨髓可能对人体健康产生影响[10]。为此,我们还需寻找一种来源更为广泛、获取量更多且更易获取的种子细胞。
ADSCs是近来的研究热点,但有报道称ADSCs复合纤维胶修复兔部分胫骨缺损效果明显差于BMSCs和骨膜细胞组,并认为BMSCs和骨膜中的间充质干细胞成骨活性更稳定均一,而ADSCs中成骨分化细胞相对不纯,影响了长骨缺损的修复效果[5]。同样,我们在以自体ADSCs复合珊瑚修复犬标准颅骨缺损时,也发现缺损修复面积差别较大 (76%~90%),ADSCs中成骨种子细胞不纯,使成骨速率无法配合材料降解可能是原因之一[11]。当然,通过基因转染成骨蛋白(BMPs)可使ADSCs稳定表达成骨活性,并修复骨缺损[12-13],但转基因载体(尤其是常用效率较高的腺病毒载体)对机体健康影响的争议较大,所以转基因细胞修饰与临床应用仍有一定距离。
Zuk等[10]认为,ADSCs中包含多能干细胞和专向干细胞,这提示我们可考虑如何分选出ADSCs中具有成骨倾向的干细胞(包括多能干细胞,成骨专向干细胞)来作为骨组织工程的种子细胞。有文献报道,通过免疫磁珠分选出 CD105+BMSCs细胞,其增殖活性较强,且植入体内后成骨良好[6]。我们在实验中采用 CD105作为表面标志流式细胞分选出CD105+hADSCs,其比例约占单核细胞的50%左右,而进一步流式细胞仪验证其CD105+纯度可达80%,经体外成骨诱导培养后,通过定量检测AKP和OCN的表达,证实其体外成骨活性明显强于CD105-hADSCs和未分选hADSCs,为进一步构建组织工程骨修复承重部位的骨缺损提供了实验依据。
由于采用流式细胞分选对细胞损伤相对较大,我们发现培养过程中有部分细胞破碎。因此,如果需要构建大块的骨组织,细胞量可能尚有不足。下一步实验可考虑采用免疫磁珠分选的方法,在保持分选纯度无明显下降的情况下提升细胞的活力,以满足大块骨组织构建的需要。
[1] Oreffo RO,Triffitt JT.Future potentials for using osteogenic stem cells and biomaterials in orthopedics[J].Bone,1999,25(2):S5-S9.
[2] Fraser JK,Wulur I,Alfonso Z,et al.Fat tissue:an underappreciated source of stem cells for biotechnology[J].Trends Biotechnol,2006, 24(4):150-154.
[3] Cowan CM,Shi YY,Aalami OO,et al.Adipose-derived adult stromal cells heal critical-size mouse calvarial defects[J].Nat Biotechnol,2004,22(5):560-567.
[4] Conejero JA,Lee JA,Parrett BM,et al.Repair of palatal bone defects using osteogenically differentiated fat-derived stem cells [J].Plast Reconstr Surg,2006,117(3):857-863.
[5] Hui JH,Li L,Teo YH,et al.Comparative study of the ability of mesenchymal stem cells derived from bone marrow,periosteum, and adipose tissue in treatment of partial growth arrest in rabbit [J].Tissue Eng,2005,11(5-6):904-912.
[6] Aslan H,Zilberman Y,Kandel L,et al.Osteogenic differentiation of noncultured immunoisolated bone marrow-derived CD105+cells[J].Stem Cells,2006,24(7):1728-1737.
[7] Zhu L,Liu W,Cui L,et al.Review article:tissue-engineered bone repair of goat-femur defects with osteogenically induced bone marrow stromal cells[J].Tissue Eng,2006,12(3):423-433.
[8] Yuan J,Cui L,Zhang WJ,et al.Repair of canine mandibular bone defects with bone marrow stromal cells and porous β-tricalcium phosphate[J].Biomaterials,2007,28(6):1005-1013.
[9] Yuan J,Zhang WJ,Liu GP,et al.Repair of canine mandibular bone defects with bone marrow stromal cells and coral[J].Tissue Eng Part A,2010,16(4):1385-1394.
[10] Zuk PA,Zhu M,Ashjian P,et al.Human adipose tissue is a source of multipotent stem cells[J].Mol Biol Cell,2002,13(12): 4279-4295.
[11] Cui L,Liu B,Liu GP,et al.Repair of cranial bone defects with adipose derived stem cells and coral scaffold in a canine model [J].Biomaterials,2007,28(36):5477-5486.
[12] Peterson B,Zhang J,Iglesias R,et al.Healing of critically sized femoral defects, using genetically modified mesenchymal stem cells from human adipose tissue[J].Tissue Eng,2005,11(1-2): 120-129.
[13] Lin L,Shen Q,Wei X,et al.Comparison of osteogenic potentials of BMP4 transduced stem cells from autologous bone marrow and fat tissue in a rabbit model of calvarial defects[J].Calcif Tissue Int,2009,85(1):55-65.
Osteogenesis Ability of Purified hADSCs Through Flow Cytometry Sorting in Vitro
LI Junxian1, SUN Hengyun2,YUAN Jie3,ZHAO Minyan3,WEI Min3
1 Department of Oral and Maxillofacial Surgery,Shanxi Province People′s Hospital,Shanxi 030012,China;2 Shanghai Key Laboratory of Tissue Engineering,Shanghai 200011,China;3 Department of Plastic and Reconstructive Surgery,Shanghai Ninth People′s Hospital,Shanghai Jiaotong University School of Medicine,Shanghai 200011,China.Corresponding author:YUAN Jie.
Objective To explore the osteogenesis ability of purified hADSCs through flow cytometry sorting in vitro. Methods hADSCs were isolated and separated through flow cytometry using CD105 as surface marker.These cells were cultured in osteogenic-induced medium,CD105-hADSCs and non-seperated hADSCs were served as control groups.The cells were examined for alkaline phosphatase(AKP)and osteocalcin(OCN)by real-time PCR and western-blot after 2 weeks culture.Results The percentage of CD105+hADSCs in monocytes was about 50%through flow cytometry sorting.Real-time PCR and western-blot both revealed the AKP and OCN activity of CD105+hADSCs were significantly higher than CD105-hADSCs and non-seperated hADSCs after 2 weeks osteogenic-induction(P<0.05).Conclusion The hADSCs purified have good osteogenesis ability and could be the seeding cells for bone engineering.
Adipose-derived stem cells; Alkaline phosphatase; Osteocalcin
Q813.1+1
A
1673-0364(2010)06-0311-04
2010年9月9日,
2010年10月23日)
10.3969/j.issn.1673-0364.2010.06.003
上海市教育委员会自然科学类科研创新项目(08YZ49)
030012山西省太原市 山西省人民医院口腔外科(李俊宪);200011上海市 上海组织工程研究重点实验室 (孙恒赟);200011上海市 上海交通大学医学院附属第九人民医院整复外科(袁捷,赵明衍,韦敏)。
袁捷。
