异种关节软骨与MSCs体外共同培养的实验研究
2010-03-02
(南京医科大学附属南京儿童医院,江苏南京,210029)
小儿骨科临床工作中会面临较多的由于软骨破坏、软骨缺损而带来的一系列问题。关节软骨是一种无血管的组织,依靠关节液营养,一旦损伤,自我修复能力有限,治疗困难。近年来由于骨组织工程学的兴起,为临床软骨缺损的修复带来了希望。其主要内容包括种子细胞的选择、支架材料的应用和培养环境的构造三个方面[1]。其中种子细胞的获得及培养是整个组织工程学的基础。因此选择一种具有多向分化能力、免疫原性低、来源广的种子细胞显得尤为重要。但细胞来源问题成了组织工程技术的一个难题。现在可以成功的应用扩增培养的自体软骨细胞、扩增软骨细胞形成的类似软骨组织和生物材料技术通过体内移植的方式修复受损的关节软骨[2]。然而,研究结果表明这种方法并不是很理想:一是由于供体组织和供体部位病变的限制,二是无法获得所需要的大量的软骨细胞,三是在体外培养时软骨细胞会向成纤维细胞分化[3]。另一方面,来自于骨髓的间充质干细胞已被证实可以在不同的诱导方法下向软骨细胞、成骨细胞和脂肪细胞方向分化[4]。在体外试验中,高浓度间充质干细胞在已知成分培养基中可以被诱导向软骨细胞方向分化[5]。将间充质干细胞和成熟的软骨细胞共培养不仅解决了诱导信号问题也解决了细胞来源问题。本实验中,作者将间充质干细胞和成熟软骨细胞在体外混合培养并分析相关的效应。
1 材料与方法
1.1 细胞培养
1.1.1 人间充质干细胞的培养:髋关节骨盆截骨术中所截取的股骨,采用全骨髓法分离培养BMSCs,用咬骨钳剪成碎块然后用吸管反复吹打,使骨块中的骨髓基质细胞充分溢出,500 r/m in离心6min,弃上清,加入完全培养基(含10%胎牛血清,100 U/m L青霉素及100 g/m L链霉素),反复吹打制成单细胞悬液;以每毫升2×104个细胞接种培养瓶,37℃,5%CO2,饱和湿度孵箱内孵育。4 d后首次全量换液,弃去大量的悬浮细胞,以后隔1d换液。待细胞长满单层后,用0.025%的胰蛋白酶消化以1∶2传代(图1)。
1.1.2 兔软骨细胞的培养:2~3月龄的健康白兔,体质量2~2.5 kg,雌雄不限。无菌条件下取髋关节软骨,PBS反复洗涤去掉血污,仔细剥离附着的滑膜、纤维组织,剪碎组织至1 mm×1 mm大小,加入4m L 0.0 5%的Ⅱ型胶原酶消化30min,离心去上清,加入0.1%的Ⅱ型胶原酶3m L和0.25%的胰酶3m L 37℃振荡消化60~100 min,肉眼见消化液浑浊,将消化后的小软骨块均匀贴在25 cm2培养瓶下壁,加入少量含体积分数为10%FBS的完全培养基(含青霉素100U/m L,链霉素100 mg/L),将培养瓶翻转放置在培养箱内20~30min,待小软骨块贴牢培养瓶下壁后,加入5 m L完全培养基,置于37℃、5%CO2、饱和湿度条件的培养箱内培养,1周后换液,以后每周2次换液。当细胞增殖到铺满培养瓶底的80%~90%后传代。加入1m L 0.25%胰蛋白酶0.02%EDTA消化,为了加快消化速度可以边消化边晃动培养瓶,在显微镜下观察,当70%贴壁细胞被消化下来时(约1m in),加入2m L培养基终止消化,用吸管吹打2~3次使细胞完全脱落下来成为单细胞悬液,计数后离心,按1∶2 或 1∶3传代(图2)。
1.1.3 间充质干细胞与关节软骨细胞共培养:将收集到的第3代关节软骨细胞和第2代间充质干细胞先用含0.15%胰蛋白酶和0.02%EDTA的PBS液冲洗1次,再用无血清培养基冲洗,然后将细胞混悬于含 50 mg/m L ITS+Premix(6.25 μg/m L胰岛素,6.25μg/m L转铁蛋白,6.25 ng/m L硒酸,1.25 mg/m L苯磺酸和5.35 mg/m L亚油酸)100μg/m L丙酮酸盐、50μg/m L抗坏血酸盐-2-磷酸盐、10 U/L地塞米松和10μg/m L TGF-β3的高糖DMEM 培养液中。以5种不同的比率进行细胞培养(见表1):间充质干细胞单独培养,间充质干细胞和关节软骨细胞分别以1∶2、1∶1、2∶1的比例培养,关节软骨细胞单独培养细胞混合后放入15 m L聚丙烯试管中37℃,5%CO2培养,每周换液3次,4周后用PBS液冲洗后用福尔马林固定。

表1 间充质干细胞和兔软骨细胞的培养比例(105)
1.2 RNA的抽提与real-time PCR
TRIZOL法抽提总RNA,进行浓度和纯度测定后M-M LV法逆转录为c-DNA。PCR反应体系为:2×PCRMaster Mix 12.5μL,cDNA模板1μL,上下游引物各1μL,加水至终体积2 5μL。cbfa 1的扩增条件为 :9 5℃预变性5 min,94℃变性30 s,55℃退火30 s,72℃延伸30 s,共循环30次,最后72 ℃延伸7 min;βactin的扩增条件为95℃预变性5 m in;94℃变性30 s,55℃退火30 s,72℃延伸30 s,共循环26次;最后72℃延伸7 min。取5μL PCR产物,2.0%琼脂糖/溴化乙锭凝胶电泳。UVP凝胶密度扫描仪及其分析软件进行半定量分析。以18 s rRNA为内参,行相对定量比较,引物序列如下:

2 结 果
2.1 间充质干细胞与软骨细胞形态(图1、2)
2.2 混合培养中的细胞比例
采用人类特异性β2微球蛋白引物,同时针对人和兔共有序列18 s rRNA设计引物,PCR扩增,以单独培养的间充质干细胞为对照计算不同混合比例试验组中β2微球蛋白与18 s rRNA的相对比例。在开始阶段,在混合培养的试管中β微球蛋白基本没有变化,经过4周的培养后这种比例没有明显的变化(图3),这表明两种细胞的增殖比例接近相同。
图1 间充质干细胞 40倍
图2 软骨细胞 40倍
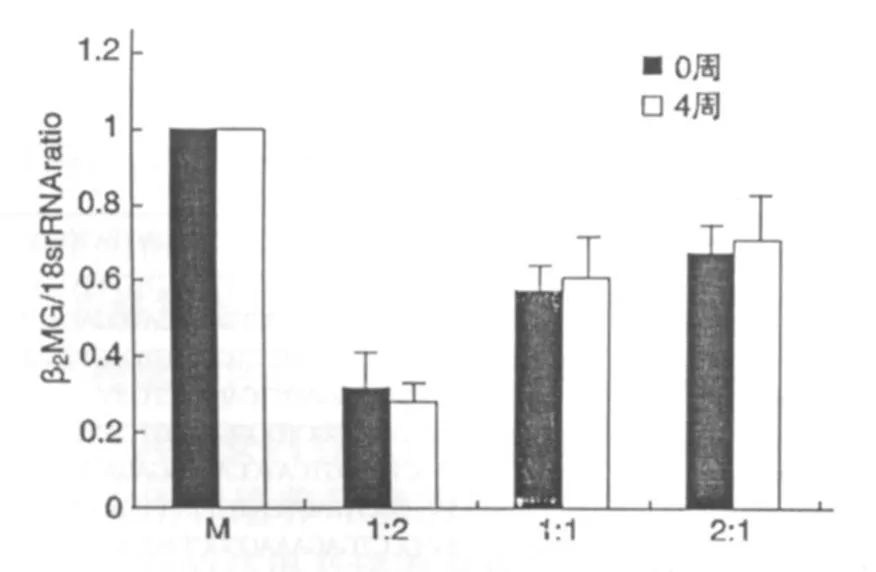
图3 共培养中细胞比例的变化
2.3 混合培养试管中的软骨细胞表型
用Ⅱ型胶原与Ⅰ型胶原表达的比例来估计软骨细胞表型,实验数据表明在软骨细胞单独培养、间充质干细胞和软骨细胞比例为1∶2、1∶1和2∶1的试管中Ⅱ型胶原与Ⅰ型胶原表达的比例分别为:1.71、0.72、0.63、0.50, 在最初的培养中 Ⅱ型胶原与Ⅰ型胶原表达的比例随着间充质干细胞百分比的增加而降低。在经过四周的培养后这种比例分别增加至2.39、1.12、1.42、1.81,见图4。在混合培养中间充质干细胞比例高的样本其Ⅱ型胶原与Ⅰ型胶原表达的比例增高,高比例的间充质干细胞促进Ⅱ型胶原的表达。

图4 Ⅱ型胶原与Ⅰ型胶原的比例随时间变化的规律
2.4 Ⅱ型胶原、β2微球蛋白、总Ⅱ型胶原、SOX9的表达
人特有的Ⅱ型胶原在人间充质干细胞向软骨细胞转化时表达增加,人特有的β2微球蛋白是人间充质干细胞的特异标志,在经过四周的培养后,在各个实验组中几乎没有人特有的Ⅱ型胶原表达,而人特有的β2微球蛋白的表达是明显的(图5),这表明人间充质干细胞没有出现明显的向软骨细胞方向分化的现象。总Ⅱ型胶原和SOX9基因是软骨形成的标志,在实验中总Ⅱ型胶原的表达增加(图6),SOX9的表达随着混合比例的增加而增加(图7),表明了软骨形成增加。

图5 β2微球蛋白的表达
3 讨 论
组织工程学要求提供独立的自体细胞,多数用于组织修复的自体细胞使用的是健康调查的活组织检查提供的或者用动物的关节软骨进行关节软骨的修复。这些方法的缺点是很明显的:可获得的细胞数量非常有限,有创途径会造成供体部位的损害而增加了以后发生股关节炎的可能性,而且在体外扩增时会发生去分化的现象,限制了其的临床应用[6]。现在更多的研究集中在多能干细胞或相关细胞的组织再生。从骨髓分离的间充质干细胞有分化成不同的细胞表型的多向分化能力并且可以在不同的诱导因子的诱导下向不同的表型分化[7]。参与MSCs向软骨分化过程的生长因子有多种:TGF-β、BMP、IGF。它们的作用不尽相同,有的单独诱导软骨形成,有的促进软骨细胞分泌细胞外基质,有的维持软骨细胞的表型。
细胞通讯系统赋予一种组织可以有几种相似的细胞功能,例如细胞新陈代谢的调节。细胞通讯系统不仅对同一组织的同种细胞起作用,而且可以通过细胞间隙对不同的细胞起作用[8]。在成骨细胞生成过程中细胞通讯系统和旁分泌系统共同调节细胞之间的信号传导,并且协同调节细胞内环境来适应外环境的变化[9]。有研究表明,从成熟软骨组织获得的软骨细胞拥有细胞间隙功能[10]。
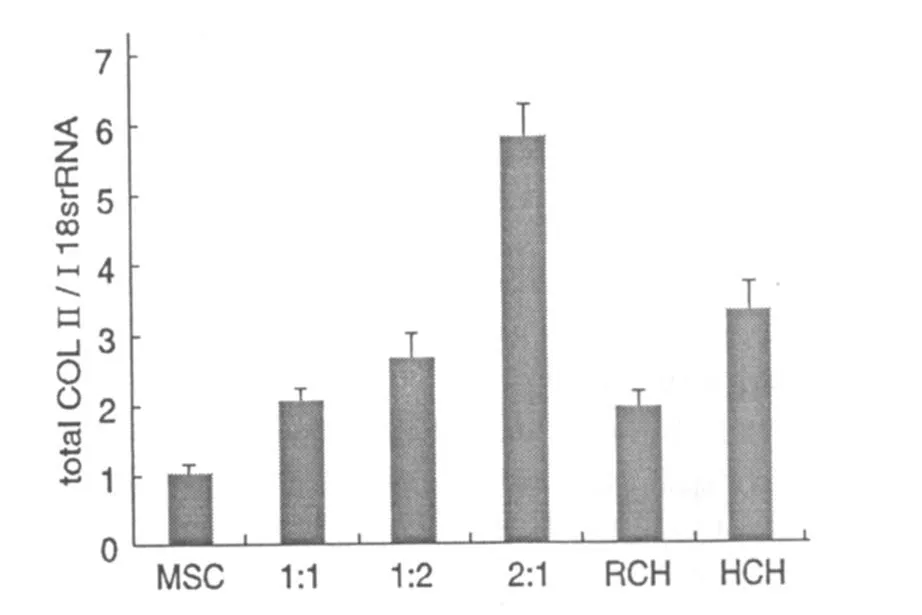
图6 总Ⅱ型胶原的表达

图7 SOX 9的表达
所有这些表明离体的软骨细胞有很大的可能性给予或接收来自间充质干细胞的信号,如果将间充质干细胞和软骨细胞混合培养在一个能够相互作用的环境,那么这种培养方法将有可能成为软骨修复工程中一种非常有用的方法,在我们的实中,我们用β2微球蛋白相对表达量与不同比例人间充质干细胞变化的相关性验证了人间充质干细胞和兔软骨细胞能够共存并在四周的培养期内保持最初的混合比例。因此,试管中软骨表型的变化不是根据细胞性质变化而变化。如先前描述的那样所有试管培养中都有明确的软骨形成介质。单独培养的间充质干细胞没有表现出任何明确的向软骨细胞方向分化的信号。有报告表明,间充质干细胞经过多次传代后逐渐丧失向软骨细胞分化的潜力,第3代和第8代细胞向软骨方向分化能力最强[11]。本组选用的第3代干细胞在实验中并未表现出明显的向软骨细胞分化的现象。RT-PCR分析人类Ⅱ型胶原蛋白在任何一个试管中均未检测到,而人特有的β2微球蛋白的表达是明显的,这表明间充质干细胞并不是直接向软骨方向分化。Ⅱ型胶原蛋白和软骨基质形成的增加可能是由于间充质干细胞对软骨细胞的正反馈调节。软骨细胞再分化和去分化需要一个三维立体的环境和生长因子来增强其分化效率[12]。已有研究报告FGF-2能够维持软骨分化能力,同时TGF-β、IGF-1、BMP-2能够正反馈调节软骨基质的形成。这些生长因子在间充质干细胞单层培养中能够持续分沁或者是在软骨形过程中分沁开始增加。以前的研究证明SOX 9在软骨细胞形成时表达增高[13]。实验中SOX9基因和总Ⅱ型胶原的表达随着间充质干细胞和软骨细胞比例的增加而增加,这表明在共培养时软骨形成增多。结合以上的结果,一个可能的机制是在共培养当中间充质干细胞以间接的旁分沁的方式影响软骨细胞形成和正向调节软骨细胞的表达。
间充质干细胞和兔软骨细胞共培养正反馈调节软骨细胞表型的表达,增加了软骨细胞形成。这种共培养方法适用于在体外扩增成熟软骨细胞并且不会降低他们的分化能力。在以前的研究中没有观察到间充质干细胞和软骨细胞之间的这种诱导区别,下一步的研究有必要用原始间充质干细胞或自体细胞系统分析这种效应。
[1] Tuan RS.Stemm ing cartilage degeneration:adultmesenchymalstem cellsasa cell sou rce for articular cartilage tissue engineering[J].Arthritis,2006,54(10):3075.
[2] Peterson L,M inas T,Brittberg M,et al.Tw o-to 9-year outcome after autologous chondrocytetransplantation of the knee[J].C lin Orthop Relat Res,2000,(374):212.
[3] M iljkovic ND,Cooper GM,Marra KG.Chondrogenesis,bonemorphogenetic protein-4 and mesenchymal stem cells[J].Osteoarthritis Cartilage,2008,16(10):1121.
[4] CsakiC,Matis U,MobasheriA,et al.Chondrogenesis,osteogenesisand adipogenesisof caninemesenchymalstem cells:a biochem ical,morphological and ultrastructural study[J].Histochem Cell Biol,2007,128(6):507.
[5] Jungu.Yoo,M.D.T racis,Barthel,et al.The Chondrogenic Potential of Human Bone-Marrow-Derived M esenchymal Progenitor Cells[J].The Journal of Bone and Joint Su rgery,1998,80:1745.
[6] Bulte JW,Kostura L,Mackay A,et al.Feridex-labeled mesenchymal stem cells:cellular differentiation and M R assessment in a canine myocardial infarction model[J].Acad Radiol,2005,12(1):S2.
[7] A lexandros.E.Beris,MariosG.Lykissas,Ch ristos D.Papageorgiou.Advances in articular cartilage repair[J].Perm issions&Reprin ts,2005,36(4):S14.
[8] Baluska F,Volkmann D,Menzel D.Plant synapses:actinbased domains for cell-to-cell communication[J].T rends Plant Sci,2005,10(3):106.
[9] Romanello M,Veronesi V,D′AndreaP.Mechanosensitivity and intercellular communication in HOBIT osteoblastic cells:a possible role for gap junction hemichannels[J].Biorheology,2003,40(1-3):119.
[10] DonahueHJ,Guilak F,Vander Molen MA,et al.Chondrocytes isolated from matu re articular cartilage retain the capacity to form functional gap junctions[J].J Bone M iner Res,1995,10(9):1359.
[11] Frank P.Barry,J.Mary Murphy.Mesenchymalstem cells:clinical applications andbiological characterization The International Journal of Biochem istry&Cell Biology,2004,36(4):568.
[12] Sechriest VF,M iao YJ,Niyibizi C,et al.GAG-augmented polysaccharide hydrogel:a novel biocompatible and biodegradable material to support chondrogenesis[J].J Biomed Mater Res,2000,49(4):534.
[13] Sekiya I,Vuoristo JT,Larson BL,et al.In vitro cartilage formation by human adult stem cells from bonemarrow stroma defines the sequenceof cellular andmolecular events during chondrogenesis[J].Proc Natl Acad Sci U SA,2002,99(7):4397.
