内皮抑素30肽基因真核表达载体的构建及实验研究
2010-02-16袁丽杰刘远莉赵恒宇刘兴汉
袁丽杰,刘远莉,赵恒宇,刘兴汉
(1.哈尔滨医科大学大庆校区,大庆 163319;2.大庆油田总医院;大庆 1633001;3.哈尔滨医科大学;哈尔滨 150081)
内皮抑素(endostatin)通过抑制血管生成间接限制肿瘤细胞生长[1]。内皮抑素治疗肿瘤具有广谱、低毒、不产生耐药性等优点[2]。用内皮抑素治疗肿瘤只是限制肿瘤细胞生长,并没有消灭肿瘤细胞,停药后肿瘤会复发。因此需要长期用药,反复注射。国内外都有研究者试图采用基因疗法,在体内直接持续表达内皮抑素以避免反复注射给病人带来的痛苦。由于表达水平等多种原因,结果并不令人满意。
2004年,本课题组运用定点诱变技术将人内皮抑素中的RGI RGAD改为RGDRGD,获得更强抗肿瘤活性的重组内皮抑素[3]。2005年,Tjin Tham Sjin等[4]发现内皮抑素抗肿瘤活性区主要在N端的1~27个氨基酸。随后,本课题组在保留内皮抑素的N端抗肿瘤活性区的基础上,引入RGD串联序列,组成30肽[5]。实验表明,此30肽在细胞体外培养实验中对脐静脉内皮细胞生长抑制活性是内皮抑素的4倍,对胃癌细胞生长抑制活性是内皮抑素的5倍。对小鼠体内肝癌的抑瘤率几乎比内皮抑素翻了一番,由于提高了抗肿瘤活性,推测将此30肽基因转入动物体内,即使表达水平稍低一些,也有可能产生较好的治疗作用。本文采用被FDA批准可进行人体实验的质粒pVAX1,构建表达分泌型内皮抑素的重组载体pVAX1-30E,探讨体内直接注射该重组载体对小鼠体内肝癌生长的影响。
1 材料和方法
1.1 试剂和质粒
限制性内切酶EcoRI、BamHI、BstXI,T4-DNA连接酶,质粒pVAX1购自Invitrogen公司;内皮抑素ELISA检测试剂盒购自Oncogene公司;质粒小量抽提试剂盒、DNA胶回收试剂盒购自上海生工生物工程公司;含有人内皮抑素30肽的质粒pTYB-30E由本室构建并保存;通用型二步法免疫组化PictureTM试剂盒,一抗:CD34(1:100),PCNA(1:200)购自北京中山生物技术有限公司;HE染色试剂为Bio-Rad公司产品。
1.2 细胞和动物
小鼠H22肝癌细胞由哈尔滨医科大学免疫教研室李殿俊教授惠赠,5~6周龄BALB/C鼠购自哈尔滨医科大学动物中心,合格证号:SCXK黑20020002。
1.3 引物合成
根据内皮抑素30肽基因序列设计引物,P1引物5′端为BamHI酶切位点和两个保护碱基,随后是胶原蛋白XVIII信号肽编码序列,内皮抑素氨基端6个氨基酸残基的编码序列,具体序列如下:5′-ACGGATCCATGGCTCCGTACCCATGTGGCTGCCAC ATCCTGCTGCTGCTCTTCTGCTGCCTGGCGGCTGCCA GA GCGCACAGCCACCGTGACTTC-3′.P2引物5’端加入EcoRI酶切位点及保护碱基,终止密码,具体序列如下:5′-CGGAATTCTTAGTCACCACGG TCACC-3′。上述引物由上海博亚生物工程公司合成。
1.4 重组真核表达载体的构建
以本课题组构建的内皮抑素30肽原核表达载体pTYB-30E质粒为模板,P1、P2为引物进行PCR扩增内皮抑素30肽基因。扩增产物经电泳鉴定,用BamHI和EcoRI双酶切。质粒pVAX1亦用BamHI和EcoRI双酶切,电泳回收大片段,与酶切后的目的基因重组,转化JM109,筛选出的重组质粒分别用EcoRI和BstXI单酶切鉴定并送上海博亚生物工程公司进行序列测定。具体的实验方法参见分子克隆实验指南和相关的产品说明书。
1.5 质粒的提取及鉴定
按试剂盒说明书大规模提取pVAX1和pVAX1-30E质粒,测A260值推算质粒浓度,A260/A280评价质粒纯度。
1.6 H22肝癌小鼠动物模型的建立及体内抑瘤实验
将冻存的小鼠H22肝癌细胞置于37℃水浴,快速融化后取0.2mL注入一只小鼠的腹腔。10d后,待小鼠腹腔长满腹水后,将其处死取腹水,用生理盐水调整细胞浓度为3×107个/mL。每只Ba lB/c小鼠右前肢腋窝皮下注射0.15mL上述浓度的腹水,制造肝癌动物模型。7d后将成瘤小鼠随机分为3组:生理盐水组、空质粒组、pVAX1-30E组。pVAX1-30E组每次向瘤内注射pVAX1-30E质粒20μg,每周2次,共注射4次。空质粒组注射等量的pVAX1质粒。生理盐水组注射等体积生理盐水。末次注射后4d,处死动物称鼠重,瘤重,测肿瘤长短径,计算体积V=0.52×长×宽2,用SPSS13.0进行多个样本均数比较的单因素方差分析。
1.7 肿瘤局部内皮抑素30肽浓度的检测
对照组、pVAX1组及pVAX1-30E组各取等量新鲜肿瘤组织,加入PBS缓冲液研磨,超声破碎,5 000g离心取上清液,用EL ISA法检测内皮抑素30肽浓度,纯化的重组内皮抑素30肽为阳性对照,成骨生长肽为阴性对照。具体操作见试剂盒说明书。
1.8 苏-伊染色及免疫组化研究
将上述处死小鼠的肿瘤切成组织块,经甲醛固定,石蜡包埋,组织病理学切片后HE染色,显微镜下观察分析。
免疫组化采用SP法,具体按照说明书操作。微血管密度(MVD)采用CD34为一抗,排除肿瘤出血及边缘反应区,低倍镜下(×10)观察确定血管密度最高的区域,然后高倍镜(×40)计数10个视野中肿瘤内微血管数,以平均每高培镜(×40)视野血管数表示MVD[4]。增殖细胞核抗原(PCNA)染色方法同前。PCNA以细胞核内出现棕黄色颗粒为阳性细胞。高倍镜下计数10个视野,以阳性细胞占总细胞数的百分率表示PCNA指数。
2 实验结果
2.1 真核表达载体构建
PCR产物在琼脂糖电泳中只有一条DNA条带,碱基数与设计的相同,结果见图1。重组质粒在重组过程中丢失了BstXI酶识别序列,只能被EcoRI酶切,不被BstXI酶切,酶切样品电泳结果见图2。DNA序列测定结果与设计完全吻合。
2.2 质粒浓度和纯度测定
提取的质粒用紫外分光光度计测A260和A280,pVAX1的A260为1.820,A280为1.006,A260/A280为1.809。pVAX1-E30质粒的A260为1.836,A280为0.964,A260/A280为1.9。
2.3 小鼠肝癌动物模型体内抑瘤试验
小鼠肝癌动物模型瘤体内直接注射pVAX1-30E,抑瘤效果见表1。
pVAX1-30E组的抑瘤率=(1-1.3123/1.8275)×100%=28.19%
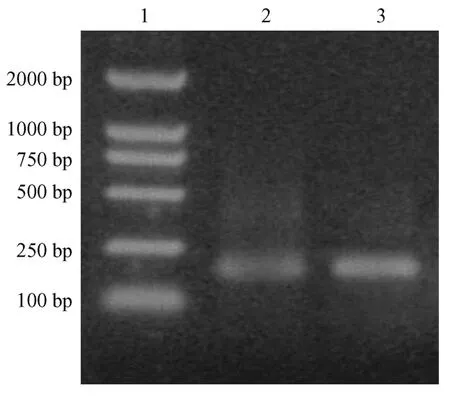
1.分子量标准2,3.PCR产物图1 E30肽基因PCR产物电泳结果1.pVAX1-E30;2.pVAX1-E30//EcoR I;3.pVAX1-E30/BstX IFig.1 The PCR produsts of E-30 peptide
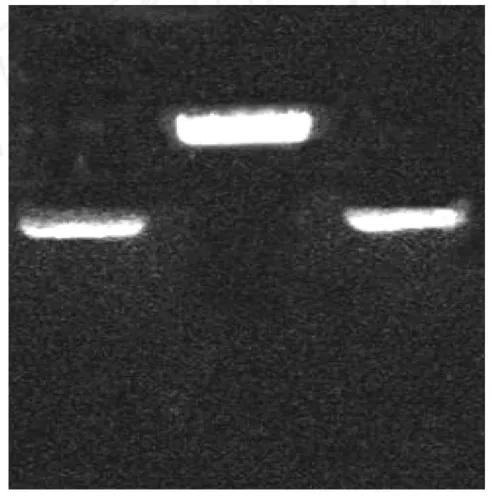
1.pVAX1-E30质粒;2.pVAX1-E30质粒/EcoR I;3.pVAX1-E30质粒/BstX I图2 pVAX1-E30质粒酶切鉴定1.marker;2,3.PCR productFig.2 Identification of the recombinantplasmids pVAX1-E30
2.4 pVAX1-30E介导的内皮抑素30肽在肿瘤组织局部的表达
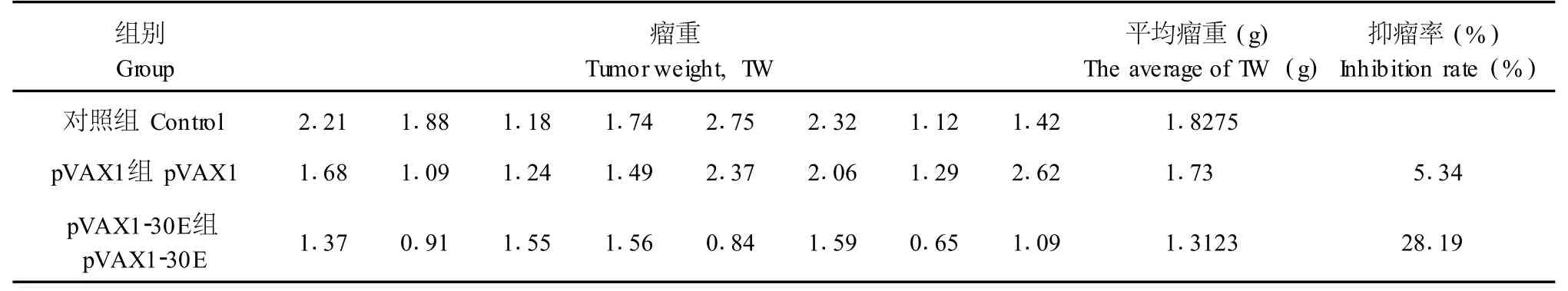
表1 pVAX1-30E对小鼠H22腹水型转移型肝癌实体瘤大小的影响Tab.1 Effect of pVAX1-E30 on mouse transplanted hepatocellular carcinoma
在pVAX1-30E组肿瘤局部组织中,内皮抑素30肽特异表达,抗体作1 000倍稀释时A值为0.724。阳性对照组为0.948,阴性对照组为0.436,pVAX1组为0.408。pVAX1-30E组内皮抑素30肽表达量明显高于pVAX1组。EL ISA结果见图3。
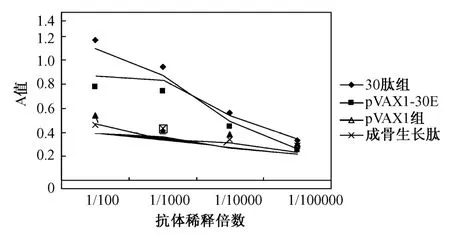
图3 EL ISA法检测内皮抑素30肽在肿瘤中的表达Fig.3 Expression of E-30 peptide in the tumor tissue
2.5 苏-伊染色及免疫组化研究
HE染色可见,pVAX1组肿瘤细胞生长良好,坏死区少见,血管丰富,形态正常无塌陷。pVAX1-30E组可见肿瘤组织坏死灶,血管少见,管壁塌陷、闭塞,见图4。
CD34免疫组化显示,pVAX1对照组有大量的呈棕黄色的微血管,部分血管无明显管腔,呈条索状,而pVAX1-30E组的棕黄色着色减少,提示微血管新生受到抑制,见图5A。肿瘤增殖抗原Ki-67值经方差分析,pVAX1组pVAX1-30E组比较差异显著(p<0.05),结果见图5B(图4,5见彩插3)。
3 讨论
内皮抑素通过抑制肿瘤组织的血管新生,断绝肿瘤细胞的血液供应,间接地限制肿瘤细胞的生长。用内皮抑素治疗肿瘤,可以使肿瘤细胞退回到原初状态潜伏下来,但停止用药后肿瘤细胞又迅速生长。所以用内皮抑素治疗肿瘤必须坚持大剂量、长期用药。为解决内皮抑素必须长期用药的困扰,有人构建内皮抑素真核表达载体,转入荷瘤小鼠,观察到治疗组肿瘤体积小于生理盐水对照组和空载体对照组。肿瘤组织HE染色显示治疗组肿瘤细胞有坏死,而生理盐水组和空载体组肿瘤细胞生长旺盛,证明重组内皮抑素基因瘤内注射对肿瘤的生长具有一定的抑制作用。
本课题组曾将内皮抑素24-30位的氨基酸残基改为RGDRGD序列,将这种改构的内皮抑素30肽基因与质粒pTYB2重组,转化大肠杆菌BL21(DE3)。在细胞实验中,重组30肽对内皮细胞的半数抑制量只有内皮抑素的1/4,对肿瘤细胞的半数抑制量只有内皮抑素的1/5。在对肝癌模型小鼠的治疗实验中,重组30肽的抑瘤率几乎是内皮抑素的1倍。重组30肽不仅增强了内皮抑素的抗血管生成活性,而且能直接抑制肿瘤细胞的生长和转移。相信将内皮抑素30肽基因注入肿瘤组织会产生比内皮抑素更有效的治疗作用。
本课题选择美国FDA批准可在人体内使用的质粒pVAX1为载体,与改构的内皮抑素30肽基因重组,30肽基因的5′端加入胶原蛋白ⅩⅧ信号肽编码序列。重组质粒直接注入肿瘤组织后,在肿瘤组织中检测到内皮抑素30肽,证实注射到肿瘤组织中的重组质粒能够进入肿瘤细胞,在肿瘤细胞中表达的内皮抑素30肽可以借助信号肽分泌到肿瘤组织中。20μg重组质粒肿瘤组织内注射,每周2次,共注射4次。末次注射后4d处死动物检测抑瘤率,重组30肽的抑瘤率为28.19%。HE染色治疗组肿瘤组织出现明显的坏死,空质粒组肿瘤细胞生长良好。治疗组肿瘤组织微血管数明显减少,增殖细胞核抗原减少。基因治疗产生确切的治疗效果。
虽然本研究证实pVAX1-30E可以转染小鼠的肿瘤细胞并在其中得到表达,产生一定的抗肿瘤作用,但研究中所采用的注射剂量是否最佳,这种治疗作用能够维持多长时间,如何进一步提高质粒转染及表达效率,会否产生毒、副作用等问题,还需经过进一步的研究才能得出结论。
[1]O′Reilly MS,Boehm T,Shing Y,et al.Endostatin:An endogenous inhibitor of angiogenesis and tumor growth[J].Cell,1997,88:277-285.
[2]Boem T,Folkman J,Browder T,et al.Antiangiogenic therapy of experimental cancer does not induce acquired drug resistance[J].Nature,1997,390:404-407.
[3]任明华,王淑静,林雪松,等.重组人内皮抑素的结构改造及抗肿瘤活性变化[J].中国生物化学与分子生物学报,2005,21:45-52.
[4]Tjinthamsjin RM,Satchi-fainaro R,Birsner AE,et al.A 27-amino-acid synthetic peptide corresponding to the NH2-terminal zinc-binding domain of endostatin is responsible for its antitumor activity[J].Cancer Res,2005,65:3656-3663.
[5]李丹,刘兴汉,赵炜明,等.人内皮抑素肿瘤相关肽基因的克隆表达及活性研究[J].医学分子生物学杂志,2007,4:475-479.
