TMD2前断裂CFTR翻译后的连接及氯离子通道功能
2010-02-09朱甫祥宫贤弟刘泽隆杨树德屈慧鸽迟晓艳
朱甫祥,宫贤弟,刘泽隆,杨树德,屈慧鸽,迟晓艳
1 鲁东大学生命科学学院,烟台 264025
2 Department of Physiology & Biophysics, Medical college of Dalhousie University, Halifax B3H 4H7, Canada
CFTR (Cystic fibrosis transmembrane conductance regulator) 为cAMP依赖性氯离子 (Cl−) 通道蛋白,由5个结构域组成:2个跨膜结构域 (Transmembrane domains,TMDs)、2个核苷酸结合域 (Nucleotidebinding domains,NBDs) 和1个调节域 (Regulatory domain,RD)。囊性纤维化 (Cystic fibrosis,CF) 是由该基因突变引起的一种常染色体隐性遗传疾病[1]。属于单基因突变的该病是体细胞基因治疗的适应症。因此自1989年CFTR基因的成功克隆,对CF的基因治疗研究成为热点。基因治疗中合适的基因运载体系是关键,在众多已开发的载体系统中,腺辅助病毒 (Adeno-associated viruses,AAV) 由于非致病性、可感染非增殖期细胞、定点整合宿主基因组使转基因稳定表达且安全性高以及不会引起宿主免疫反应等优点,为基因治疗的理想载体,而且AAV5具有靶向感染呼吸道上皮细胞的特性[2],使其特别适合CFTR基因的呼吸道上皮细胞的定向转移。CFTR的编码序列长4.4 kb,加上基因调控序列,难以为包装容量上限为4.7 kb的AAV所承载。Intein的蛋白质反式剪接作用为双AAV载体转运CFTR基因提供了一种分子手段。Intein为包埋于原核生物和单细胞真核生物某些蛋白前体中的一段多肽序列,翻译后通过蛋白质剪接反应被切除,同时两侧的宿主蛋白以肽键相连[3]。蛋白质剪接分顺式和反式两种形式。对split Ssp DnaB intein的研究表明其可介导非天然宿主蛋白的反式剪接反应[4]。不同的intein之间氨基酸序列同源性较低,只在剪接部位存在直接参与剪接反应的保守氨基酸残基[5]。
本文选择于CFTR cDNA紧邻NBD2的Ser839密码子前将其断裂成两部分,分别与split Ssp DnaB intein基因融合,构建一对真核表达载体,共转染培养的真核细胞,瞬时表达观察CFTR的剪接,膜片钳记录细胞的 CI−电流和通道开放活性,为运用双AAV载体转CFTR基因的CF基因治疗研究提供实验依据。
1 材料与方法
1.1 实验材料
质粒pMST (含split Ssp DnaB intein编码序列)由加拿大Dalhousie大学医学院Paul Liu教授实验室提供。含CFTR的质粒pIRES2-EGFP-CFTR和幼年仓鼠肾脏细胞 (Baby hamster kidney,BHK) 由加拿大Dalhousie大学医学院Paul Linsdell教授提供。绿色荧光蛋白表达质粒 pEGFP-N1和黄色荧光蛋白表达质粒EYFP-N1购自Clontech公司。内切酶、DNA连接酶试剂盒为New England Biolabs公司产品。高保真Pfu Turbo DNA聚合酶购自Stratagene公司。Gel Extraction Kit、PCR Purification Kit、Spin Miniprep Kit为 Qiagen公司产品。DMEM 和Opti-MEM培养基、Lipofectamine 2000转染试剂盒购自Invitrogen公司。胎牛血清购自Hyclone公司。山羊抗人CFTR的N端和C端抗体N-20和C-19购自Santa Cruz公司。兔抗山羊HRP-二抗和ECL plus Western Blotting Detection试剂盒购自 Amersham Pharmacia Biotech (GE) 公司。其他试剂均为国产或进口分析纯,电生理实验所用试剂除注明外均为Sigma公司产品。
1.2 真核表达载体的构建
考虑到 intein下游剪接位点附近氨基酸组成对剪接反应的影响,选择于CFTR的TMD2后与Ssp DnaB intein天然宿主蛋白具有2个相同残基的Ser839Ile840前断裂CFTR。用Pfu Turbo DNA聚合酶、引物P1和P2进行PCR从pIRES2-EGFP-CFTR扩增CFTR的N端编码序列,用引物P3和P4从pMST扩增split Ssp DnaB intein N端106个氨基酸 (IntN)的编码序列,分别用Pst I/Nsi I和Nsi I/BamH I酶切2种 PCR产物,与 EcoR I/BamH I酶切的载体pEGFP-N1连接,得到CFTR的N端与IntN的融合表达质粒pEGFP-NInt。用P5、P6和P7、P8引物对分别从pMST和pIRES2-EGFP-CFTR扩增split Ssp DnaB intein的C端48个氨基酸 (IntC) 的编码序列和CFTR的C端编码序列,分别用EcoR I/ApaL I和ApaL I/BamH I酶切,与EcoR I/BamH I酶切的载体pEYFP-N1连接,得到IntC与CFTR的C端的融合表达质粒pEYFP-IntC。同时构建CFTR的N端和C端表达载体 pEGFP-N和 pEYFP-C以及全长CFTR的表达载体pEGFP-CFTR作为对照,构建作为所用引物及序列见表1,由上海生工公司合成。

表1 构建载体所用寡核苷酸引物及序列Table 1 Primers and sequences used in vector construction
1.3 细胞培养及基因转染
BHK细胞于5% CO2、37℃培养箱以含10%胎牛血清的DMEM培养液贴壁培养。转染前1天用胰蛋白酶消化分散细胞,按每孔5×105个细胞于2 mL DMEM 培养液将细胞接种于含盖玻片的 6孔培养板,待细胞生长融合至80%以上时,用Lipofectamine 2000脂质体按试剂盒说明书进行转染,将2种质粒pEGFP-NInt和pEYFP-IntC按1∶1比率各4 μg混合稀释于250 µL的Opti-MEM培养液,与室温放置5 min的含20 µL脂质体的250 µL Opti-MEM培养液混合后继续室温放置20 min,共转染BHK细胞,同时,用4 μg的pEGFP-N和pEYFP-C共转染并分别单独转染BHK细胞。用4 μg的pEGFP-CFTR作为阳性对照、4 μg的质粒载体pEGFP-N1作为阴性对照 (Mock) 转染BHK细胞。培养箱内温育5 h后换以2 mL的新鲜Opti-MEM培养液,继续培养48 h,收集细胞用于Western blotting检测。用作电生理记录的细胞基因转染于底部放置盖玻片的培养板,使细胞贴壁于玻片生长。
1.4 Western blotting观察CFTR蛋白的剪接
将胰蛋白酶消化收集的细胞,液氮3 min、37℃3 min反复冻融3次,提取细胞总蛋白。用Bradford法进行蛋白定量,取12 μg总蛋白上样进行还原性SDS-PAGE,半干电转法将蛋白印迹至硝酸纤维素膜,5%脱脂奶粉溶液室温封闭2 h,用1∶1 000稀释的CFTR抗体N-20或C-19于37℃轻摇孵育1 h,用HRP-抗山羊血清37℃轻摇孵育1 h,ECL plus法曝光X胶片。
1.5 膜片钳记录
荧光显微镜下观察于盖玻片贴壁生长的转基因BHK细胞,根据转基因所带有的荧光蛋白基因的表达,选择荧光强度高且在细胞膜上表达的细胞进行记录。全细胞膜片钳记录参照笔者以前报道的方法进行[6],细胞浴池液 (细胞外液) 的成分及浓度为:140 mmol/L HCl,2 mmol/L MgCl2,10 mmol/L N-羟甲基-2-氨基乙醇磺酸 (TES);电极液 (细胞内液)的成分及浓度为:110 mmol/L天冬氨酸,30 mmol/L HCl,1 mmol/L MgCl2,10 mmol/L TES,1 mmol/L MgATP,0.1 mmol/L EGTA。两种液体均用N-甲基-D-葡糖胺调至 pH 7.4。用电极吸附细胞获得全细胞构型后,记录背景电流,然后滴加以下混合液至细胞浴池中激活CFTR通道蛋白:2 μmol/L 毛喉素,100 μmol/L 8-(4-氯酚硫-3′,5′-环腺苷酸 (pCPT-cAMP),100 μmol/L 3-异丁基-1-甲基黄嘌呤(IBMX)。单通道膜片钳记录参照笔者以前报道的方法进行[7]。电极液(细胞外液) 和细胞浴池液 (细胞内液) 的成分和浓度为:150 mmol/L NaCl,2 mmol/L MgCl2,10 mmol/L TES,用 NaOH调 pH至 7.4。形成内面向外式(Inside-out membrane patches) 记录结构后,在细胞浴浴滴中加以下溶液激活 CFTR通道蛋白:蛋白激酶A催化亚基 (PKA,80~120 nmol/L,Promega公司产品) 和1 mmol/L MgATP。
细胞电流以2 kHz (全细胞) 或50 Hz (单通道)的低频过滤,用pCLAMP8软件 (Axon instrument)进行分析。用 pCLAMP8软件测得的平均全细胞电容为 (25.9±1.7) pF (n=19)。
1.6 数据处理及统计分析
2 结果
2.1 断裂CFTR基因与intein融合真核表达载体的构建
Intein剪接反应除了其本身剪接位点的保守性氨基酸参与,还有赖于紧临下游剪接位点的宿主蛋白的保守性氨基酸残基,即Ser、Cys或Thr,选择与Ssp DnaB intein下游天然宿主蛋白第1个残基相同的 Ser839前断裂 CFTR,分别与 split Ssp DnaB intein融合,插入pEGFP-N1和pEYFP-N1,得到1对融合intein的CFTR两段基因并于3′末端分别带有绿色荧光蛋白和黄色荧光蛋白基因的真核表达载体pEGFP-NInt和pEYFP-IntC,如图1所示。所构建的载体经酶切电泳进行鉴定并通过 DNA测序进行确认。
2.2 CFTR蛋白表达和剪接的Western blotting结果

图1 断裂CFTR基因与intein融合重组基因结构及剪接示意图Fig. 1 Schematic representation of recombinant intein-fused split CFTR genes and splicing. The split CFTR half genes severed between Glu838-Ser839 were fused with intein respectively. These two fused genes are inserted into pEGFP and pEYFP vectors separately under the control of CMV promoter/enhancer with EGFP and EYFP following their C termili. The separately expressed CFTR half proteins would be ligated to an intact CFTR protein under the intein-mediated protein trans-splicing.
细胞总蛋白Western blotting分别用CFTR的N末端抗体 (N-20) 和 C末端抗 (C-19) 体检测结果显示,转染阳性对照质粒pEGFP-CFTR的BHK细胞可见明显融合有EGFP的CFTR蛋白条带 (195 kDa),Mock转染细胞未见 CFTR蛋白条带,共转染pEGFP-NInt和pEYFP-IntC的细胞用两种抗体均可见一明显的与阳性对照同样大小的剪接形成的CFTR蛋白条带,同时可见未完全剪接的 intein融合蛋白前体 NInt和 IntC。共转染 pEGFP-N和pEYFP-C的细胞只可见分别表达的CFTR的N端蛋白和 C端蛋白,另外,单独转染 pEGFP-N或pEYFP-C的细胞可见表达的CFTR的N端蛋白或C端蛋白 (图2)。

图2 检测CFTR表达和剪接的Western blotting印迹结果Fig. 2 Western blotting assay of CFTR expression and splicing. (A, B) The antibodies against CFTR N-terminus (N-20) and C-terminus (C-19) were used as probes respectively. 1 and 6: mock control; 2 and 7: positive control of wild type CFTR gene transfection; 3 and 8: NInt and IntC co-transfection; 4 and 9: N and C co-transfection; 5: N transfection alone; 10: C transfection alone. N-C: ligated CFTR by protein trans-splicing; NInt and IntC: non-spliced precursor peptides; CFTR-N and CFTR-C: expressed CFTR N and C termini.
2.3 电生理记录结果
全细胞电压钳模式下记录的Cl−电流显示,阳性对照转染wtCFTR的BHK细胞经cAMP激活后,记录到较大的 Cl−电流,而 Mock转染细胞未记录到Cl−电流,NInt+IntC共转染BHK细胞可记录到明显的Cl−电流,表明intein的蛋白质反式剪接产生的完整CFTR蛋白具有与wtCFTR相似的Cl−通道功能,而N+C共转染细胞也可记录到低水平的Cl−电流,而单独转染N或C端基因的细胞未记录到Cl−电流,说明两段 CFTR蛋白尽管没有 intein介导的共价连接,也可通过某种机制形成一定的Cl−通道功能 (图3)。当实验电压为−60 mV时,根据细胞膜电容进行标准化处理得到的电流密度 (用pA/pF表示) (每组n=4),阳性对照转染细胞 (wtCFTR) 经cAMP激活后的电流密度为 495±76,NInt+IntC共转染细胞为445±68,二者无显著差异 (P>0.05),而 N+C共转染细胞为225±34,与NInt+IntC共转染细胞相比明显要小 (P<0.05) (图4)。
内面向外式 (Inside-out) 单通道膜片钳记录结果显示,共转染NInt+IntC的BHK细胞表现的PKA和ATP依赖性Cl−通道开放活性类似于wtCFTR基因转染细胞 (图5A);据此记录计算的NInt+IntC共转染细胞的平均通道开放概率为0.39±0.05,转wtCFTR为0.42±0.03,二者相比差别无显著意义 (P>0.05),而明显高于N+C共转染细胞的0.098±0.01 (P<0.01) (图5B)。
3 讨论
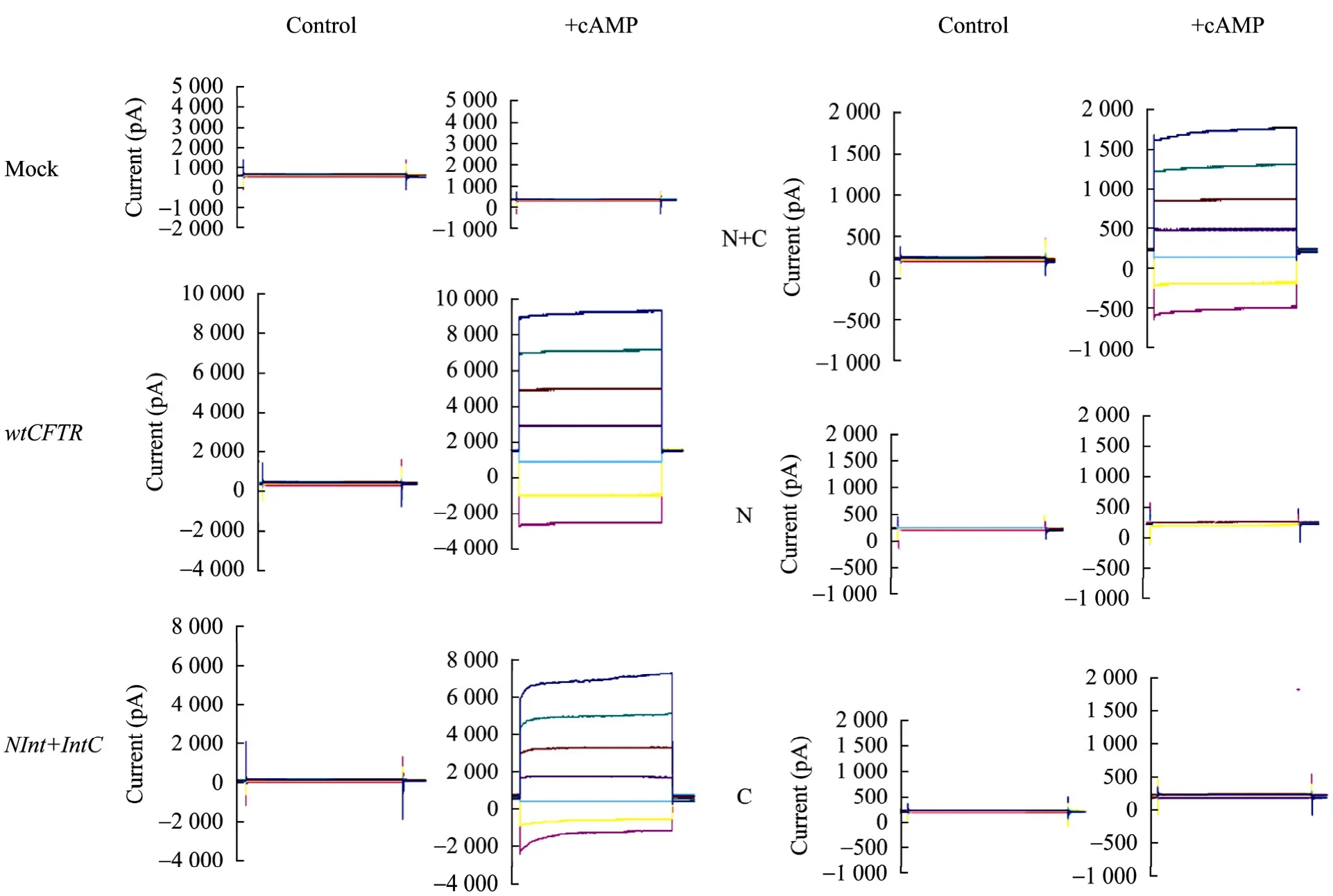
图3 全细胞模式记录的转基因BHK细胞Cl−电流Fig. 3 Recording of whole cell CFTR Cl− currents in gene transfected BHK cells. The cells expressing EGFP alone control or EGFP-fused wtCFTR were set as mock (left top) or positive control (left middle). The whole cell currents of cells coexpressing NInt+IntC (left bottom), N+C (right top), individual N (right middle) or C part (right bottom) of CFTR were recorded both before (Control) and after (+cAMP) addition of forskolin (2 µmol/L), pCPT-cAMP (100 µmol/L) and IBMX (100 µmol/L) to the bath solution. Voltage steps were from −60 mV to +60 mV in 20 mV increments from a holding potential of -14.

图4 转基因细胞的电流密度Fig. 4 Current density of gene transferred BHK cells. Mean cAMP-activated current density was measured at −60 mV from experiments such as those shown in Fig. 3. Mean of data from 4 patches in each case. * P>0.05 vs wtCFTR group, **P<0.01 vs NInt+IntC group.

图5 转基因细胞单CFTR通道门控特征Fig. 5 Gating properties of single CFTR channel from gene transferred cells. (A) Unitary currents recorded from inside-out membrane patches at a membrane potentials of −50 mV (C means channel closed and O means channel open). (B) Mean channel open probability estimated from such recordings lasting at least 60 s. * P>0.05 vs wtCFTR group, ** P<0.01 vs NInt+IntC group.
通过于Ser839前断裂的CFTR与split Ssp DnaB intein融合的双载体培养的BHK细胞基因共转染实验,翻译后 intein的蛋白质反式剪接作用使分别表达的CFTR两段多肽连接成完整的CFTR蛋白,并且较好地恢复了Cl−通道功能,表明intein可作为一种技术手段进行双载体系统的 CFTR基因转移。Intein的蛋白质剪接作用包括4步反应,直接参与剪接反应的保守性氨基酸残基位于 intein与宿主蛋白的交界处,即上游剪接位点 intein的第 1个残基、下游剪接位点的 intein的最后 1个残疾和与之紧邻的宿主蛋白首个残基,蛋白质剪接的特点在于其不依赖细胞机制,也不需要消耗能量,是 1个完全自发的过程[8]。尽管如此,在满足剪接部位保守性氨基酸残基组成的前提下,Intein对不同的外源蛋白表现出不同的剪接效率,说明剪接位点附近特别是下游外源蛋白的其他残基对剪接反应的影响,因此,本研究所选择的CFTR断裂点的Ser839后为Ile840,这2个残基与所用intein下游天然宿主蛋白相同,共转染后的Western blotting结果显示,Intein对此断裂点的两段CFTR多肽可进行有效剪接,但仍可检测到未被完全剪接的前体蛋白,可能的原因为剪接反应本身的不完全,或者两种基因转染效率和/或表达水平的不均衡性所致。电生理结果显示,剪接所形成的CFTR蛋白具有与野生型CFTR相似的Cl−通道功能,全细胞膜片钳记录到较高的cAMP依赖性Cl−电流和较高的电流密度,单通道膜片钳记录到较高的PKA和ATP依赖性Cl−通道开放活性和开放概率,应该注意的是,虽然蛋白质水平表现出CFTR的不完全剪接,但剪接产生的完整CFTR蛋白足以形成与野生型 CFTR相近的 Cl−通道功能。未融合intein的两段CFTR基因共转染细胞结果显示,尽管不能形成完整的 CFTR蛋白分子,亦可记录到较低的Cl−电流,从单独转染CFTR的N端基因说明,两段CFTR蛋白存在某种程度的分子间互补作用,并由此产生部分的Cl−通道电流,但大小和密度明显低于融合 intein的共转染细胞,而且通道开放活性和概率也明显较低。最近有研究者用基于RNA剪接的双AAV载体转CFTR基因,但由于剪接效率不够高使得其使用受到限制[9]。
由于蛋白质剪接反应的精确、无副反应的特点,近年来在蛋白质纯化[10]、多肽环化[11]以及蛋白质相互作用[12]等研究中得到应用。需要指出的是,尽管intein对其天然宿主蛋白的剪接效率极高,甚至观察不到中间产物,但对不同的非天然宿主蛋白,表现出的剪接效率高低不一,因此对于不同的目的蛋白需要测试不同的满足剪接反应的保守氨基酸残基的断裂位点,笔者曾在大肠杆菌表达实验中证明本文中所选择的断裂位点以及于 Ser660前断裂 CFTR,Ser660后亦为保守的Ile661,Intein表现出较高的剪接效率[13],但对另一有 2个保守残基 Ser707Ile708前断裂的CFTR只观察到很低的剪接效率,对只有一个保守残基Ser670或Ser737前断裂的CFTR没有观察到剪接反应 (数据未显示)。最近笔者还用 intein在大肠杆菌中实现了对凝血VIII因子的高效剪接[14]。有报道用 intein的蛋白质反式剪接功能肌肉注射双AAV载体转Dystrophin基因后的肌肉形态学证明对肌营养不良小鼠有较好的治疗效果[15]。
鉴于AAV5对感染呼吸道上皮细胞的靶向特异性感染的特点,Sirninger等构建了一种去除 TMD1的263个氨基酸残基的缩减型CFTR基因的重组型AAV5,Cftr−/−小鼠气管内转基因显示对Cl−通道电流的纠正作用,并改善病菌感染引起的炎症[16]。本研究为进一步地应用双AAV5载体的全长CFTR基因转移进行CF基因治疗研究奠定了基础。
致谢:感谢加拿大Dalhousie大学医学院Paul Liu教授提供的蛋白质剪接技术的帮助和Paul Linsdell教授提供的膜片钳技术帮助。
REFERENCES
[1] Gadsby DC, Vergani P, Csanády L. The ABC protein turned chloride channel whose failure causes cystic fibrosis. Nature, 2006, 440(7083): 477–483.
[2] Zabner J, Seiler M, Walters R, et al. Adeno-associated virus type 5 (AAV5) but not AAV2 binds to the apical surfaces of airway epithelia and facilitates gene transfer. J Virol, 2000, 74(8): 3852–3858.
[3] Saleh L, Perler FB. Protein splicing in cis and in trans. Chem Rec, 2006, 6(4): 183–193.
[4] Wu H, Xu MQ, Liu XQ. Protein trans-splicing and functional mini-inteins of a cyanobacterial dnaB intein. Biochim Biophys Acta, 1998, 1387(1/2): 422–432.
[5] Xu MQ, Perler FB. The mechanism of protein splicing and its modulation by mutation. EMBO J, 1996, 15(19): 5146–5153.
[6] Gong XD, Burbridge SM, Cowley EA, et al. Molecular determinants of Au(CN)2−binding and permeability within the cystic fibrosis transmembrane conductance regulator Cl−channel pore. J Physiol, 2002, 540(Pt 1): 39–47.
[7] Linsdell P, Gong XD. Multiple inhibitory effects of Au(CN)2−ions on cystic fibrosis transmembrane conductance regulator Cl−channel currents. J Physiol, 2002, 540(Pt 1): 29–38.
[8] Xu MQ, Perler FB. The mechanism of protein splicing and its modulation by mutation. EMBO J, 1996, 15(19): 5146–5153.
[9] Song YH, Lou HH, Boyer JL, et al. Functional cystic fibrosis transmembrane conductance regulator expression in cystic fibrosis airway epithelial cells by AAV6.2-mediated segmental trans-splicing. Hum Gene Ther, 2009, 20(3): 267–81.
[10] Sharma SS, Chong S, Harcum SW. Intein-mediated protein purification of fusion proteins expressed under high-cell density conditions in E. coli. J Biotechnol, 2006, 125(1): 48–56.
[11] Williams NK, Prosselkov P, Liepinsh E, et al. In vivo protein cyclization promoted by a circularly permuted Synechocystis sp. PCC6803 DnaB mini-intein. J Biol Chem, 2002, 277(10): 7790–7798.
[12] Paulmurugan R, Umezawa Y, Gambhir SS. Noninvasive imaging of protein-protein interactions in living subjects by using reporter protein complementation and reconstitution strategies. Proc Natl Acad Sci USA, 2002, 99(24): 15608–15613.
[13] Zhu FX, Liu ZL, Qu HG, et al. Intein-mediated trans-splicing of chloride ion channel CFTR. Chin J Biochem Mol Biol, 2009, 25(9): 844–848.朱甫祥, 刘泽隆, 屈慧鸽, 等. 内含肽介导的氯离子通道蛋白CFTR的反式剪接. 中国生物化学与分子生物学报, 2009, 25(9): 844–848.
[14] Zhu FX, Liu ZL, Qu HG, et al. Ssp DnaB intein-mediated ligation of heavy and light chains of coagulation factor VIII in Escherichia coli. Chin J Biotech, 2009, 25(7): 1101–1106.朱甫祥, 刘泽隆, 屈慧鸽, 等. Ssp DnaB intein大肠杆菌中介导 FVIII重链和轻链的连接. 生物工程学报, 2009, 25(7): 1101–1106.
[15] Li J, Sun WC, Wang B, et al. Protein trans-splicing as a means for viral vector-mediated in vivo gene therapy. Hum Gene Ther, 2008, 19(9): 958–964.
[16] Sirninger J, Muller C, Braag S, et al. Functional characterization of a recombinant adeno-associated virus 5-pseudotyped cystic fibrosis transmembrane conductance regulator vector. Hum Gene Ther, 2004, 15(9): 832–841.
