抗山羊ΔfosB基因表达产物抗体的制备及应用
2010-02-09郑惠玲祝珍珍安俊辉杨振宇邢瑞芳闫林慧
郑惠玲,祝珍珍,安俊辉,杨振宇,邢瑞芳,闫林慧
西北农林科技大学动物科技学院,杨凌 712100
抗山羊ΔfosB基因表达产物抗体的制备及应用
郑惠玲,祝珍珍,安俊辉,杨振宇,邢瑞芳,闫林慧
西北农林科技大学动物科技学院,杨凌 712100
ΔfosB是fosB基因的自然截短型,稳定存在于许多组织中,在脂肪细胞和成骨细胞的形成和分化中起到重要作用。ΔFosB蛋白可能与钙在骨和乳腺中的代谢有关,并且调控钙从骨向乳腺转移的信号通路。将奶山羊的 ΔfosB基因亚克隆到pET32a载体得到pET32a-ΔfosB原核表达载体,IPTG诱导其在大肠杆菌中表达,纯化融合蛋白免疫兔子制备多克隆抗体。ELISA检测显示抗体效价达1∶51 200,Western blotting 结果显示制备的抗体能特异性检测原核表达的ΔFosB蛋白以及在HEK-293细胞中表达的ΔFosB蛋白。进一步的组织差异表达检测表明ΔFosB在山羊的乳腺、骨髓、脑髓、肌肉、心脏、肝和肺组织中均有表达。
山羊,ΔFosB,原核表达,多克隆抗体,组织差异表达
本课题组采用 RT-PCR方法从山羊的乳腺组织克隆得到了ΔfosB基因[11],证明了ΔFosB在乳腺中有表达。本实验进一步构建了山羊 ΔfosB的原核表达载体,并在大肠杆菌中表达纯化了ΔFosB蛋白,制备了兔抗羊ΔFosB多克隆抗体,为从蛋白质水平研究山羊ΔFosB的功能提供了特异性工具。
1 材料与方法
1.1 材料
携带His标签的pET32a(+)载体、E. coli BL21 (DE3)菌株、pMD-ΔfosB质粒、pAdTrack-CMV-ΔfosB质粒、DH5α菌株、HEK-293细胞由本实验室保存。琼脂糖购自Biowest公司。T4 DNA连接酶、LA Taq DNA聚合酶、pMD18-T Vector、限制性内切酶BamHⅠ和SalⅠ以及低蛋白质分子量标准为TaKaRa公司产品。IPTG购自Inalc公司。DNA marker、预染蛋白质marker Ⅲ、琼脂糖凝胶DNA片段回收试剂盒及Pro-light HRP化学发光检测试剂购自天根生化科技 (北京) 有限公司。弗氏完全佐剂、弗氏不完全佐剂购自Sigma公司。质粒回收试剂盒购自北京博大泰克/博大泰恒生物技术集团公司。辣根过氧化物酶 (HRP) 标记的羊抗兔IgG以及Anti-β-Actin抗体均购自北京博奥森生物技术有限公司。PVDF膜购自美国 Millipore公司。引物合成及测序工作由上海生工生物工程有限公司完成。DMEM高糖及胎牛血清购自美国 Hyclone公司。Lipofectamine 2000 Reagent购自美国Invitrogen公司。
1.2 方法
1.2.1 原核表达载体的构建及鉴定
根据山羊的 ΔfosB基因 cDNA序列 (GenBank Accession No. FJ455501),设计1对特异性引物,上游:5′-GGAGGATCCATGTTTCAAGCTTTCCCCGG AG-3′ (下划线为BamH I酶切位点);下游:5′-TCC GTCGACTCACTCCGCCAGCGGGCCCG-3′ (下划线为Sal Ⅰ酶切位点)。以pMD-ΔfosB质粒为模板进行PCR反应,反应条件为:95℃预变性5 min;94℃变性 30 s,62℃退火30 s,72℃延伸1 min,30个循环;72 ℃ 10 min 。将回收的 ΔfosB基因克隆到pMD18-T载体得到pMD-ΔfosB,转化感受态大肠杆菌DH5α,挑取阳性克隆,进行菌液PCR检测,然后送上海生工生物工程有限公司测序。
将 pMD-ΔfosB质粒和 pET32a载体分别用BamH I和SalⅠ进行双酶切,琼脂糖凝胶电泳纯化回收 ΔfosB片段及载体片段,按照摩尔比为 8∶1的比例混合ΔfosB和pET32a载体,用T4 DNA连接酶于16℃连接过夜。转化感受态大肠杆菌DH5α,挑选阳性克隆进行菌液 PCR鉴定,鉴定后的阳性克隆再进行质粒双酶切鉴定。鉴定正确的质粒命名为pET32a-ΔfosB,并送上海生工生物工程有限公司测序。
1.2.2 pET32a-ΔfosB的诱导表达及SDS-PAGE分析
将质粒pET32a-ΔfosB转化感受态大肠杆菌菌株BL21(DE3),挑取阳性单克隆接种到含100 μg/mL氨苄青霉素的 LB培养基中,37℃振荡培养,摇菌至OD600≈0.6时,加IPTG至终浓度0.5 mmol/L,37℃诱导表达6 h,同时用载有空质粒 pET32a的大肠杆菌 BL21(DE3) 和未诱导的重组质粒 pET32a-ΔfosB作为空白对照及阴性对照。
收集诱导后重组菌液1 mL,5 000 r/min、4℃离心15 min后PBS重悬,冰上超声破碎,4℃、5 000 r/min离心10 min,保存上清。包涵体沉淀用PBS洗2次,重悬于 8 mol/L尿素中,4℃放置 2~3 h。4℃、10 000 r/min离心20 min,收集上清。将获得的细胞质上清与包涵体上清与 1×SDS上样缓冲液等体积混合,100℃加热10 min后进行 12% SDS-PAGE电泳。
1.2.3 融合蛋白的纯化
裂解后的包涵体进行SDS-PAGE电泳,随后使用0.25 mol/L KCl染色10 min。切下目的条带,放入预冷研钵中,加入液氮研磨至粉末状,加入 PBS 4℃过夜。10 000 r/min、4℃离心5 min,收集上清后,与1× SDS上样缓冲液混合,100℃加热5 min后,取10 μL样品进行12% SDS-PAGE检测。
1.2.4 多克隆抗体的制备
将1 mL纯化后的重组蛋白ΔFosB (约0.6 mg/mL)与弗氏完全佐剂等量混合超声乳化,皮下多点注射分别免疫 2只大耳白兔,免疫前取血作为阴性血清对照。以后每隔 7天使用重组蛋白与弗氏不完全佐剂混合的乳化液再次进行增强免疫,28 d后心脏采血,37℃静置12 h分离血清,2 000 r/min离心10 min去除血细胞,收集血清。
1.2.5 多克隆抗体效价检测及特异性分析
用间接酶联免疫吸附法 (Indirect enzyme-linked immunosorbent assay,iELISA) 测定抗体效价。将融合蛋白用包被缓冲液稀释,取100 μL加入酶标板中4℃包被过夜;PBST洗涤3次,使用PBST配制的5%脱脂奶粉37℃封闭1 h;PBST洗涤3次,加入梯度稀释的血清在37℃孵育1 h;PBST洗涤3次后,使用HRP标记的羊抗兔IgG,37℃孵育1 h;PBST洗涤3次,晾干后加入TMB显色液显色,最后用2 mol/L硫酸终止反应,酶标仪测定抗体效价。
采用Western blotting检测抗体特异性:融合蛋白SDS-PAGE凝胶电泳后,60 V转印约2 h,将蛋白电转移至PVDF膜上,5%脱脂奶粉封闭过夜,TBST洗涤3次;使用血清为一抗 (分别按1∶200,1∶500,1∶1 000稀释),37℃孵育2 h,TBST洗涤3次;HRP标记的羊抗兔 IgG作为二抗 (1∶5 000稀释),37℃孵育1 h,TBST洗涤3次;ECL显影分析结果。
1.2.6 用自制抗体检测HEK-293细胞内外源ΔFosB的表达
HEK-293细胞采用DMEM高糖培养基,37℃、5% CO2的条件进行常规培养,转染前夜将细胞均匀接种于六孔培养皿中,次日待细胞融合度达90%时,将已构建好的pAdTrack-CMV-ΔfosB超表达载体转染 HEK-293细胞,转染过程按照 Lipofectamine 2000 Reagent说明书进行。转染试验设立了pAdTrack-CMV-ΔfosB转染组以及未转染的空白对照组。
转染36 h后,弃细胞上清液,胰酶消化后离心收集细胞。PBS漂洗2遍,加入100 μL预冷的 RIPA裂解液,冰上放置30 min,期间进行振荡使细胞充分裂解。4℃、12 000 r/min离心30 min,收集上清。将上清进行SDS-PAGE电泳,60 V转膜2 h,5%的脱脂奶粉封闭过夜。用自制的ΔFosB多克隆抗体为一抗,37℃孵育2 h,TBST洗涤3次;HRP标记的羊抗兔IgG作为二抗,37℃孵育1 h,TBST洗涤3次;ECL显影分析结果。
1.2.7 山羊ΔFosB组织差异表达分析
采集关中山羊的乳腺、骨髓、脑髓、垂体、肌肉、心脏、肺、胃和肾组织样,各剪取约0.1 g,液氮中研碎,加入 500 μL RIPA裂解液 (50 mmol/L Tris,0.5%脱氧胆酸钠,0.1% SDS,150 mmol/L NaCl,5 mmol/L EDTA,1% Triton X-100。使用前加0.5 mmol/L PMSF),4℃裂解过夜,4℃、10 000 r/min离心20 min,收集上清。将上清进行SDS-PAGE凝胶电泳,60 V转膜2 h,5%脱脂奶粉封闭过夜;分别用自制的anti-ΔFosB多克隆抗体和anti-β-actin抗体 (1∶500稀释) 作为一抗,37℃孵育2 h,TBST洗涤 3次;HRP标记的羊抗兔 IgG作为二抗(1∶5 000稀释),37℃孵育1 h,TBST洗涤3次;ECL显影分析结果。
2 结果
2.1 原核表达载体的构建及鉴定
构建的pET32a-ΔfosB原核表达载体酶切后可见pET32a载体条带和所插入的ΔfosB条带 (图1)。测序结果显示,山羊ΔfosB基因成功插入pET32a载体,原核表达载体pET-ΔfosB构建成功。
2.2 重组蛋白ΔFosB的表达
pET32a-ΔfosB经诱导表达后,收集菌体进行SDS-PAGE分析,发现诱导后的蛋白在55 kDa处出现一条带,其大小与所推测的融合蛋白相对分子量一致 (35 kDa的ΔFosB和20 kDa的标签蛋白)。根据SDS-PAGE分析,IPTG的最佳诱导浓度为0.5 mmol/L,最佳诱导时间为6 h,再增加IPTG浓度和诱导时间并不能提高表达量。超声破碎细菌,分别取上清液和沉淀悬浮液进行SDS-PAGE分析,结果表明:重组蛋白ΔFosB的表达产物主要以包涵体形式存在,上清液中融合蛋白的表达量极其微小 (图2)。

图1 原核表达载体pET32a-ΔfosB的构建及鉴定Fig. 1 Construction and identification of prokaryotic expression vector pET32a-ΔfosB. (A) Construction of prokaryotic expression vector pET32a-ΔfosB. (B) Agarose gel analysis for restriction enzyme treatment of pET32a-ΔfosB vector. 1: λDNA/Hind III marker; 2: pET32a-ΔfosB digested with BamH I and Sal I produced the long fragment of pET32a vector and 750 bp ΔfosB gene; 3: pET32a-ΔfosB plasmid.
2.3 重组蛋白的纯化
诱导表达产物经 SDS-PAGE分析后,使用0.25 mol/L KCl染色,切胶纯化,SDS-PAGE检测纯化结果。结果在55 kDa处显示一条带 (图3),与预期目的蛋白大小一致,所获得的融合蛋白纯度较高,可用于抗体制备。

图2 SDS-PAGE检测重组蛋白ΔFosB的表达Fig. 2 SDS-PAGE analysis of expression of recombinant protein ΔFosB. 1: pre-stained protein marker III; 2: precipitate of induced pET32a-ΔfosB /BL21 after sonication; 3: supernatant of induced pET32a-ΔfosB/BL21 after sonication; 4: precipitate of uninduced pET32a-ΔfosB/BL21 after sonication; 5: supernatant of uninduced pET32a-ΔfosB/BL21 after sonication.

图3 重组蛋白ΔFosB的纯化Fig. 3 SDS-PAGE analysis of purification of recombinant protein ΔFosB. 1: low molecular weight protein marker; 2: pET32a-ΔfosB/BL21, induced; 3,4: purified recombinant ΔFosB.
2.4 多克隆抗体效价检测和特异性分析
iELISA技术测定制备的多克隆抗血清效价达到1∶51 200以上 (图4)。Western blotting印迹结果显示,1∶1 000稀释的自制兔抗羊ΔFosB血清,能够检测到分子量约55 kDa的融合蛋白 (图5),说明所制备的兔抗羊ΔFosB抗体对原核表达的ΔFosB蛋白具有较好的特异性。
2.5 用自制抗体检测HEK-293细胞内外源ΔFosB的表达
用pAdTrack-CMV-ΔfosB转染HEK-293细胞,未转染的细胞作为空白对照,用自制的兔抗羊ΔFosB抗体进行Western blotting检测。结果如图6所示,过表达ΔFosB的细胞有条带,而空白对照无阳性反应,说明制备的抗体对细胞内表达的 ΔFosB有特异性。
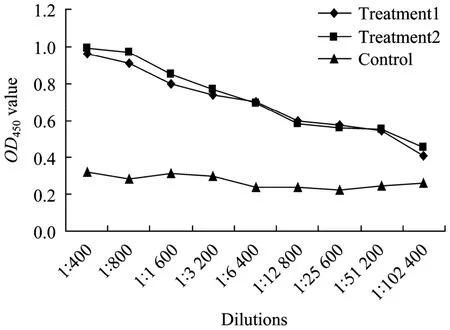
图4 多克隆抗体效价的测定Fig. 4 iELISA analysis of anti-ΔFosB antibody with recombinant ΔFosB. ELISA plates were coated with recombinant ΔFosB, anti-ΔFosB antibodies were serial diluted and dispensed, pipetted into the wells. HRP-labeled goat anti-rabbit IgG antibody was used as second antibody.

图5 Western blotting检测多克隆抗体的特异性Fig. 5 Identification of the specificity of ΔFosB polyclonal antibody by Western blotting. 1: pre-stained protein marker; 2: 1:1 000 diluted polyclonal antibodies; 3: 1:500 diluted polyclonal antibody; 4: 1:200 diluted polyclonal antibody.

图6 用自制抗体检测ΔFosB在HEK-293细胞内的表达Fig. 6 Expression of ΔFosB in HEK-293 examined by homemade antibody. 1: HEK-293 cell transfected by pAdTrack-CMV-ΔfosB; 2: blank control.
2.6 山羊ΔFosB组织差异表达检测
Western blotting 结果显示 ΔFosB在山羊的乳腺、骨髓、脑髓、肌肉、心脏、肝和肺组织中均有表达,而在垂体、脾脏中没有表达 (图7)。
3 讨论

图7 山羊ΔFosB组织差异表达检测Fig. 7 Tissue distribution of dairy goat ΔFosB. 1: pre-stained protein marker; 2: breast; 3: brain; 4: hypophysis; 5: marrow; 6: muscle; 7: heart; 8: liver; 9: spleen; 10: lung.
Fos家族是一种典型的早期“即刻基因”,能被多种刺激因子诱导快速瞬时表达,该家族基因编码的亮氨酸拉链蛋白能与 Jun家族蛋白形成二聚体,参与调控细胞增殖、分化及转化。ΔFosB作为其稳定存在的成员已备受关注,在小鼠中的研究表明ΔFosB参与药物成瘾过程、控制大脑补偿机制[12-15]以及调控骨形成和脂肪形成。我们采用 RT-PCR的方法已经从山羊的乳腺组织克隆出了 ΔfosB基因,证明了 ΔFosB在乳腺中的表达,为进一步研究ΔFosB在乳腺钙代谢中的作用奠定了基础。
本研究将克隆得到的山羊 ΔfosB基因 CDS区(Coding sequences) 亚克隆到pET32a载体上,优化了载体的表达条件,分别在25℃、30℃和37℃条件下加入0.1 mmol/L、0.5 mmol/L、1 mmol/L和1.5 mmol/L IPTG诱导其在大肠杆菌中表达2 h、4 h、6 h和8 h,得到了最佳的表达条件:37℃,0.5 mmol/L诱导表达6 h。在优化的条件下,重组蛋白在大肠杆菌中高效表达,由于难以正确折叠而导致蛋白质聚集从而形成包涵体[16],用8 mol/L的尿素裂解包涵体获得重组蛋白,将其与弗氏佐剂混合给兔子皮下多点注射,免疫5次后得到效价高达1∶51 200的兔抗羊ΔFosB多克隆抗血清。Western blotting检测显示所制备的抗体对于原核表达的ΔFosB融合蛋白以及HEK-293细胞中超表达的ΔFosB蛋白具有特异性反应。进一步将制备的抗体用于组织差异表达检测,用来检测体内ΔFosB的表达情况,结果表明ΔFosB在山羊乳腺、骨髓、脑髓、肌肉、心脏、肝和肺多种组织中有表达,在垂体、脾脏中没有表达。
ΔFosB蛋白比 FosB蛋白少了 C末端转活区(C-terminal transactivation domain 和 TATA-结合蛋白结合区 (TATA-binding protein-binding domain),相比Δ2ΔFosB多了N末端Fos同源区 (N-terminal Fos homology domain,FH),但是它们都具有亮氨酸拉链这个关键功能区[9]。本研究是以ΔfosB基因CDS区全序列表达产物作为抗原制备的抗体,所以理论上也可以和FosB以及Δ2ΔFosB产生免疫反应。但是在最后的组织差异表达检测中只杂交出了与ΔFosB大小一致的一条带,这很可能是因为FosB和Δ2ΔFosB不稳定,在组织中已经降解,或者因为在这些组织中的表达量过低,Western blotting检测不到。
综上所述,本研究成功制备了兔抗羊ΔFosB多克隆抗体,可用于ΔFosB蛋白的表达水平检测及功能研究。
REFERENCES
[1] Dobrzanski P, Noguchi T, Kovary K, et al. Both products of the fosB gene, FosB and its short form, FosB/SF, are transcriptional activators in fibroblasts. Mol Cell Biol, 1991, 11(11): 5470−5478.
[2] Inoue D, Kido S, Matsumoto T. Transcriptional induction of FosB/ΔFosB gene by mechanical stress in osteoblasts. J Biol Chem, 2004, 279(48): 49795–49803.
[3] Nestler EJ, Barrot M, Self DW. ΔFosB: A sustained molecular switch for addiction. Proc Natl Acad Sci USA, 2001, 98(20): 11042−11046.
[4] Ulery-Reynolds PG, Castillo MA, Vialou V, et al. Phosphorylation of ΔFosB mediates its stability in vivo. Neuroscience, 2009, 158(2): 369–372.
[5] Kveiborg M, Chiusaroli R, Sims NA, et al. The increased bone mass in deltaFosb transgenic mice is independent of circulating leptin levels. Endocrinology, 2002, 143(11): 4304−4309.
[6] Kveiborg M, Sabatakos G, Chiusaroli R, et al. ΔFosB induces osteosclerosis and decreases adipogenesis by two independent cell-autonomous mechanisms. Mol Cell Biol, 2004, 24(7): 2820−2830.
[7] Sims NA, Sabatakos G, Chen JS, et al. Regulating ΔFosB expression in adult tet-off-ΔFosB transgenic mice alters bone formation and bone mass. Bone, 2002, 30: 32–39.
[8] Sabatakos G, Sims NA, Chen J, et al. Overexpression of ΔFosB transcription factor(s) increases bone formation and inhibits adipogenesis. Nat Med, 2000, 6(9): 985−990.
[9] Ohnishi YN, Sakumi K, Yamazaki K, et al. Antagonistic regulation of Cell-Matrix adhesion by FosB and ΔFosB/Δ2ΔFosB encoded by alternatively spliced forms of fosB transcripts. Mol Biol Cell, 2008, 19(11): 4717−4729.
[10] VanHouten JN. Calcium sensing by the mammary gland. J Mammary Gland Biol Neopla, 2005, 10(2): 129−139.
[11] Zheng HL, Yuan C, Bao LJ. Cloning and bioinformatics analysis of dairy goat Δfosb cDNA. Acta Agric Boreali-Occidentalis Sin, 2009, 18(5): 12−16.郑惠玲, 袁超, 包黎娟. 山羊 Δfosb基因 cDNA的克隆及生物信息学分析. 西北农业学报, 2009, 18(5): 12−16.
[12] Werme M, Messer C, Olson L, et al. ΔFosB regulates wheel running. J Neurosci, 2002, 22(18): 8133–8138.
[13] McClung CA, Nestler EJ. Regulation of gene expression and cocaine reward by CREB and ΔFosB. Nat Neurosci, 2003, 6(11): 1208–1215.
[14] Renthal W, Carle TL, Maze I, et al. ΔFosB mediates epigenetic desensitization of the c-fos gene after chronic amphetamine exposure. J Neurosci, 2008, 28(29): 7344–7349.
[15] Renthal W, Nestler EJ. Epigenetic mechanisms in drug addiction. Trends Mol Med, 2008, 14(8): 341–350.
[16] Wang Z, Ma HQ, Zhang W, et al. The progress of inclusion body isolation and chromatographic refolding, purification methods. China Biotechnol, 2009, 29(7): 102−107.王增, 马会勤, 张文, 等. 包涵体蛋白的分离和色谱法体外复性纯化研究进展. 中国生物工程杂志, 2009, 29(7): 102−107.
Preparation and application of goat ΔfosB gene expression product antibody
Huiling Zheng, Zhenzhen Zhu, Junhui An, Zhenyu Yang, Ruifang Xing, and Linhui Yan
College of Animal Science and Technology, Northwest A&F University, Yangling 712100, China
ΔfosB, a naturally occurring truncated isform of fosB gene, existed in many tissues stably and played an important role in formation and differentiation of adipocyte and osteoblast. ΔFosB may be related to the metabolism of calcium in bone and mammary gland and regulate the signal pathway of calcium transfer from bone to mammary gland. We first sub-cloned ΔfosB gene of goat into the vector pET32a to construct prokaryotic expression vector pET32a-ΔfosB. Then we induced for ΔfosB gene expression efficiently by IPTG. Finally we immunized the adult rabbits with purified recombinant ΔFosB to prepare rabbit anti-goat ΔFosB polyclonal antibody. iELISA analysis showed the antibody with the titer of 1:51 200, and Western blotting result showed that the antibody could specifically detect the ΔFosB protein expressed in prokaryotic cell and HEK-293 cell, respectively. Further Western blotting assay showed that ΔFosB expressed in various tissues of goat in vivo.
goat, ΔFosB, prokaryotic expression, polyclonal antibody, tissue differential expression
小鼠骨肉瘤基因B (Finkel-Biskis-Jinkins murine osteosarcoma B,fosB) 是转录因子AP-1家族成员之一,有3种表达产物:FosB、ΔFosB和Δ2ΔFosB,都是细胞增殖与分化的重要调节因子[1]。fosB基因是一种典型的早期即刻基因,在多种刺激物的作用下瞬时诱导表达[2]。ΔFosB由于磷酸化作用能够作为一种分子开关稳定存在[3-4]。研究表明 ΔFosB在小鼠中可能参与脂肪细胞和成骨细胞的形成与分化[5-8]。钙是骨的重要组成成分,ΔFosB调控骨的形成及骨密度,故ΔFosB可能与钙在骨骼中的积累有关。Yoshinori等[9]建立了表达各种fosB基因转录本的突变的小鼠胚胎干细胞系,发现在只表达 ΔFosB的突变细胞系中有7种钙结合蛋白上调,1种下调,同时有3种在乳腺中高表达的蛋白上调,1种下调。在妊娠期的母体中,大量钙通过一些钙受体蛋白从骨骼向乳腺转运[10]。通过这些结果我们推测,ΔFosB在骨骼和乳腺的钙代谢中起重要作用,它可能参与调节钙从骨向乳腺转运的信号通路。
March 30, 2010; Accepted: May 17, 2010
Supported by:Basic Research Fund of Northwest A&F University (No. Z109021002), Research and Development Special Fund for Public Welfare Industry (Agriculture) (No. 3-45).
Huiling Zheng. Tel/Fax: +86-29-87092164; E-mail: Zheng.huiling@yahoo.com
西北农林科技大学基本科研业务费 (No. Z109021002),农业部公益性行业科研专项 (农业) 经费 (No. 3-45) 资助。
