白细胞介素1β诱导肾小管上皮细胞转分化及其对细胞骨架的影响①
2010-02-06王光兰王心蕊石英爱张丽红刘晓会
王光兰 陈 爽 王心蕊 石英爱 张丽红 刘晓会 吴 珊
(吉林大学白求恩医学院病理生物学教育部重点实验室,长春 130021)
白细胞介素1β诱导肾小管上皮细胞转分化及其对细胞骨架的影响①
王光兰 陈 爽 王心蕊②石英爱 张丽红 刘晓会 吴 珊
(吉林大学白求恩医学院病理生物学教育部重点实验室,长春 130021)
目的:观察白细胞介素1β(IL-1β)诱导肾小管上皮细胞转分化及其对细胞骨架的调节作用。方法:选择永生化的大鼠肾小管上皮细胞株NRK52E,经体外培养后以 IL-1β(30μg/L)分别诱导3天及 6天,观察细胞形态;RT-PCR半定量检测细胞α-平滑肌动蛋白(α-SMA)和细胞骨架成分β-actin、α-tubulin的mRNA表达;免疫荧光染色观察α-SMA蛋白表达及骨架蛋白β-actin、α-tubulin在细胞内的分布及排列。结果:培养的NRK52E细胞经IL-1β体外诱导3天及6天后,细胞中α-SMAmRNA及蛋白表达水平与相应的对照组细胞比较明显增多(P<0.001),提示NRK52E上皮细胞出现了表型转化,此时培养细胞的形态也发生了改变,由典型的多边铺路石样变为成纤维细胞样,并有多个突起,细胞骨架蛋白β-actinmRNA的表达也稍有增多(P<0.05);其蛋白的分布排列也发生了改变,由胞膜转移至核周及胞浆,形成束状纤维样结构。但IL-1β诱导组细胞的另一个骨架蛋白α-tubulinmRNA表达和分布与对照组比较无明显不同。结论:IL-1β能够诱导体外培养的NRK52E细胞转分化,此过程中细胞形态变为成纤维细胞样,多突起;骨架蛋白β-actin也表达增加,并出现了骨架重建;而α-tubu lin在此过程中则没有明显变化。
白介素 1β ;转分化 ;α-SMA;β-actin;α-tubulin
越来越多的研究显示肾小管上皮细胞发生表型 转化(EMT)是参与肾纤维化的重要因素之一[1],无论是在免疫性的还是非免疫性的肾脏疾病模型中,肾间质巨噬细胞的积聚与肾纤维化的发生和发展具有明显相关性[2,3]。白介素1β(IL-1β)作为巨噬细胞产生的一种炎性介质,很可能在肾小管间质纤维化过程中发挥作用,有报道IL-1β可以诱导体外培养的肾小管上皮细胞发生EMT,成为肌成纤维细胞[4]。为进一步明确IL-1β的促肾小管上皮细胞转分化作用,本研究以大鼠永生化肾小管上皮细胞株NRK52E为实验对象,观察IL-1β促进NRK52E细胞转分化作用,同时观察在其转分化过程中是否伴有细胞骨架的改变,为IL-1β促肾小管上皮细胞转分化可能的机制研究提供实验数据。
1 材料与方法
1.1 培养细胞 永生化大鼠肾小管上皮细胞株NRK52E购于中科院上海细胞库,培养在含10%优级胎牛血清的H-DMEM培养液中。
1.2 主要试剂 优级胎牛血清(Hyclone);H-DMEM培养基(Gibco);α-SMA,β-actin,α-tubulin 多克隆抗体(北京博奥森);FITC-IgG,CY3-IgG(北京中衫);RNA抽提试剂,逆转录试剂,PCR试剂盒(TaKaRa);重组白细胞介素1β(Perprotech INC)。
1.3 引物 采用Primer primier 5.0设计并由上海生工合成,具体序列见表1。
1.4 细胞培养 NRK52E细胞培养于37℃、5%、CO2培养箱。培养基为H-DMEM+10%胎牛血清(FBS),取对数生长期细胞,0.05%胰酶消化后以适当浓度重新接种,待细胞贴壁后进行分组:对照组3%FBS+H-DMEM+PBS;诱导组3%FBS+H-DMEM+IL-1(30μg/L),分别作用3天和6天,各组细胞数及培养液体积均相等,隔天换液。
1.5 培养细胞形态观察 培养细胞在倒置显微镜下观察,比较不同时间实验组和对照组细胞的形态并照相记录。
1.6 RT-PCR检测α-SMA 和细胞骨架蛋白β-actin、αtubulinmRNA的表达 根据Tri Reagent说明书提取细胞总 RNA,测A 260/A280在1.8~2.0之间,说明RNA纯度较高,根据OD260值计算RNA浓度。按逆转录试剂说明书逆转录合成第一条cDNA链,以等量cDNA为模板进行PCR反应。以GAPDH为内参,GAPDH、α平滑肌动蛋白(α-SMA)、β-actin 和 α-tubulin的反应条件均为:94℃变性2分钟,然后进入循环,94℃30秒,55℃30秒,72℃40秒,最后72℃延伸5分钟。循环数分别为:26、36、26、28个循环。PCR产物经1.5%琼脂糖凝胶电泳,凝胶成像系统成像后,用GEL-Pro4图像分析软件进行灰度扫描,以IOD代表其表达量,用GAPDH的量进行校正,以目的基因与GAPDH比值的相对量进行分析。实验重复三次。
1.7 培养细胞的免疫荧光染色
1.7.1 细胞爬片制备 预先在24孔板中放置无菌小盖玻片,取对数生长期细胞,细胞收集和分组同上,分别诱导3天和6天后取盖玻片经4%多聚甲醛固定10分钟,-20℃冷甲醇继续固定20分钟,PBS洗3遍,备用。
1.7.2 细胞免疫荧光染色 0.1%TritonX-100打孔,PBS洗5分钟×3次;血清封闭37℃,30分钟;分别加入一抗 ,即抗 α-SMA(1∶100),抗 β-actin(1∶100)及抗α-tubulin(1∶100)抗体,37℃孵育1小时;PBS洗5分钟×3次,滴加相应的二抗(1∶50),常温避光反应30分钟,PBS洗5分钟×3次,激光共聚焦显微镜下观察并采集图像。
2 结果
2.1 IL-1β对细胞形态的影响 对照组细胞培养至第6天始终未发生形态改变,呈典型的多边铺路石样,细胞间衔接紧密(见图1A)。而诱导组细胞于诱导的第2天部分细胞即由原来的多边铺路石样向成纤维细胞样改变,诱导3~6天后大部分细胞呈成纤维细胞样,多突起,分散生长,部分细胞肥大变形,大小不一(见图1B)。
2.2 IL-1β对细胞转分化标志物α-SMA和细胞骨架蛋白β-actin、α-tubulin mRNA表达的影响 内参GAPDH的mRNA表达条带各组相同,经IL-1β诱导的细胞在诱导的第3天和第6天其α-SMAmRNA表达均明显高于相应的对照组细胞。同时诱导组细胞在诱导第3天和第6天,细胞骨架蛋白β-actinmRNA表达与相应的对照组细胞相比也呈轻度增加状态,但另一骨架蛋白α-tubulinmRNA表达无论是诱导第

表1 引物序列及产物的长度Tab.1 The sequences of the PCR amplication primers
3天还是第6天与其相应的对照组相比均未见明显改变(见图2,表2)。诱导组细胞α-SMA mRNA和βactinmRNA表达的增加并未随诱导时间的延长进一步加强,即诱导组细胞诱导的第6天与诱导第3天相比,细胞α-SMA、β-actin mRNA的表达量未见明显差异(数据未显示)。
2.3 IL-1β对α-SMA蛋白表达及对细胞骨架成分βactin、α-tubulin分布排列的影响
2.3.1 α-SMA 培养至第3、6天的对照组细胞 α-SMA表达极其微弱,其阳性部位主要位于细胞核周围,经IL-1β作用3天和6天的诱导组细胞,其细胞内α-SMA表达明显增强,不仅在核周有较强的荧光团存在,在胞浆及细胞的突起中,也可见较强的α-SMA阳性的荧光物质分布(见图3A、B)。
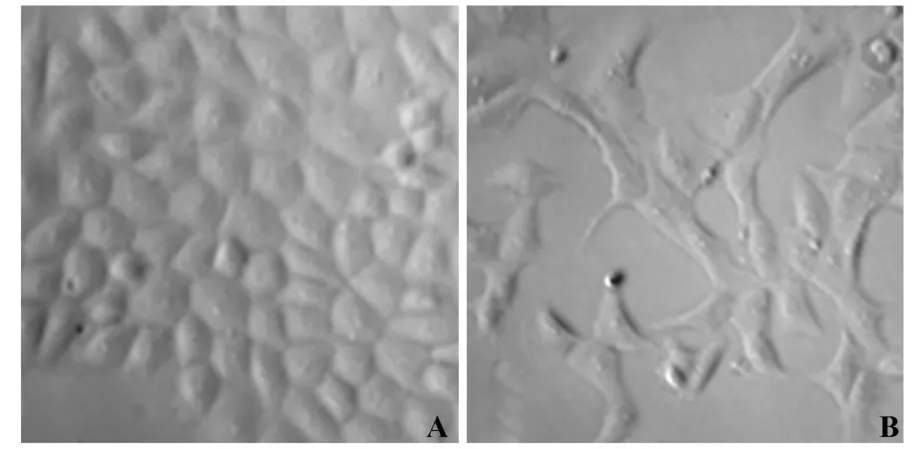
图1 相差显微镜下所见诱导6天的细胞形态(×100)Fig.1 The cellmorphology after stimulated by IL-1βfor 6 days on phase contrastm icroscope(×100)
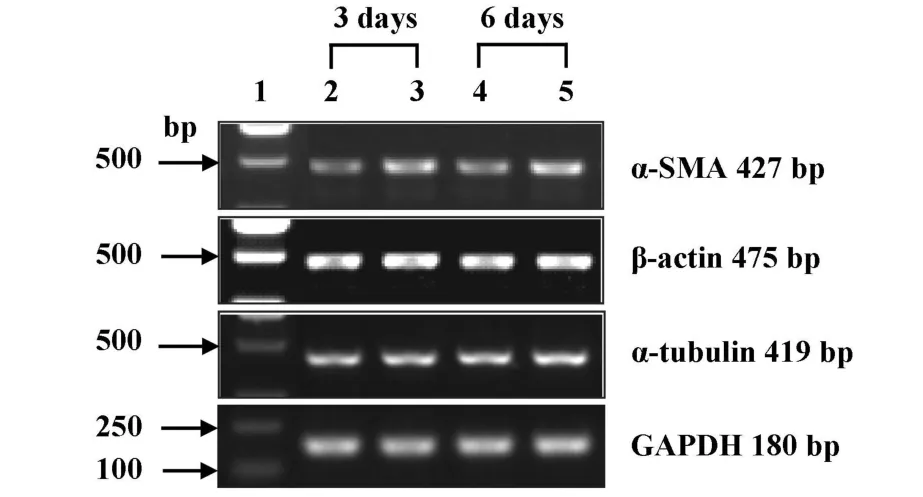
图2 IL-1β 对 NRK52E细胞 α-SMA 和骨架 蛋白 β-actin、αtubulin的mRNA表达的影响Fig.2 The effect of IL-1β on expression ofα-SMA and skeleton protein β-actin,α-tubulin mRNA in NRK52E cells
2.3.2 β-actin 在培养的第3天和第6天,对照组细胞β-actin阳性染色主要积聚在细胞膜下,形成板层样结构,细胞浆内几乎无β-actin阳性染色。经IL-1β分别作用3天和6天后 ,诱导组β-actin的阳性染色发生明显改变,表现为在细胞浆中出现较多βactin阳性的束状纤维样结构,连接细胞膜与细胞核,部分沿细胞长轴纵行排列,细胞突起中也见丝状排列的β-actin阳性染色,细胞膜下的板层样结构变薄甚至消失,在核膜周围出现强阳性的β-actin荧光团(见图 3C、D)。
2.3.3 α-tubu lin IL-1β分别作用3天和 6天的诱导组细胞α-tubulin阳性染色与对照组细胞无明显差异,均表现为细胞内α-tubulin阳性染色在核的一侧分布较为密集,α-tubulin阳性的粗丝状纤维以此为中心向周围细胞浆放射并交叉成网状,相互缠绕,似鸟巢(见图3E、F)。
3 讨论
肾小管间质纤维化和慢性炎细胞浸润是许多慢性肾脏疾病发展到晚期的共同表现,近几年有研究表明在肾小管间质纤维化的过程中,炎细胞产生的多种生物活性介质均有诱导肾间质内成纤维细胞和肾小管上皮细胞转分化形成肌成纤维细胞的能力,而肌成纤维细胞又是慢性肾间质纤维化产生细胞外基质(ECM)的主要来源细胞[5]。本实验我们选择由巨噬细胞产生的炎症介质IL-1β,在相关文献[4,6]的基础上进行了浓度筛选,确定30μg/L作为本实验的作用浓度,作用于体外培养的NRK52E细胞,首先检测IL-1β体外诱导NRK52E细胞向间充质细胞转分化的能力,结果显示,NRK52E细胞经IL-1β诱导3天后其细胞内肌成纤维细胞的特异标志α-SMA在基因及蛋白水平上的表达均明显增加,表明IL-1β能够在体外诱导NRK52E肾小管上皮细胞发生表型转化。与此同时我们还观察到培养的NRK52E细胞在发生表型转化的同时,细胞形态也发生了明显改变,由典型的多边铺路石状变成多突起的成纤维细胞样。

表2 IL-1β诱导 3天后 NRK52E细胞 α-SMA、β-actin 和 αtubulin mRNA的相对表达量Tab.2 IL-1β induced relativemRNA exp ression ofα-SMA,βactin andα-tubulin in NRK52E cells after 3 days

图3 IL-1β诱导6天后对NRK52E细胞内α-SMA蛋白表达,β-actin和α-tubulin分布排列的影响Fig.3 The expression ofα-SMA protein and the distributions and arrangements of β-actin and α-tubulin changes in NRK 52E cells after stimulated by IL-1βfor 6 days
众所周知,细胞形状的维持与细胞骨架的结构和排列密切相关,微丝和微管是细胞骨架的主要组成成分,它们与细胞形态的维持,细胞器的空间定位及位置的改变,细胞的运动,细胞内的物质运输和信号转导等活动密切相关[7]。因此本实验分别以微丝成分β-actin和微管成分α-tubulin作为观察靶点,观察了IL-1β在诱导NRK52E细胞发生转分化的过程中对细胞骨架的调节作用,RT-PCR结果显示IL-1β在促进NRK52E细胞发生转分化的同时其β-actin mRNA的表达也轻度增加。为进一步研究IL-1β在促进NRK52E细胞转分化的过程中对细胞骨架分布排列的影响,我们对β-actin和α-tubulin骨架蛋白进行了免疫荧光染色,发现IL-1β使β-actin骨架蛋白的分布排列发生了明显变化,其在细胞膜下形成的板层样结构变薄甚至消失,在胞核周围积聚形成强阳性的β-actin荧光团,在细胞浆中形成较多的束状纤维样结构,连接细胞膜与细胞核,部分沿细胞长轴纵行排列并伸入细胞突起中,说明在 IL-1β诱导NRK52E细胞发生转分化的过程中,微丝成分β-actin不仅在mRNA水平表达增多,还在分布及排列上发生了骨架重建,至于这些变化仅仅是 IL-1β诱导NRK52E细胞发生转分化过程中的一种现象,还是βactin的骨架重建在转分化过程中参与了信号传导及蛋白调节作用尚需进一步研究。作为细胞骨架的另一重要组成成分,微管蛋白α-tubulin无论在mRNA水平还是在分布排列上都未发现有明显变化,可能是α-tubulin在细胞内的表达及分布相对较为稳定,IL-1β尚不能引起其明显改变。
值得注意的是,目前很多的RT-PCR多是采用βactin、α-tubulin等骨架蛋白作为内参,而本实验结果表明,IL-1β诱导NRK52E细胞转分化过程中细胞内的β-actinmRNA的水平也会发生改变,因此,在涉及该类实验时,应慎重选择RT-PCR内参。
1 Kalluri R,Neilson EG.Epithelial-mesenchymal transition and its implication for fibrosis[J].JClin Invest,2003;112(12):1776-1784.
2 Saito T,Atkins RC.Contribution ofmononuclear leukocytes to the progression of experimental focal glomerular sclerosis[J].Kidney Int,1990;37(4):1076-1083.
3 Lan H Y,Paterson D J,Atkins RCetal.Initiation and evolution of interstitial leukocytic infiltration in experimental glomerulomephritis[J].Kidney Int,1991;40(3):425-433.
4 陈廷芳,陈 明,秦建华etal.白细胞介素1β诱导肾小管上皮细胞的转分化[J].中国组织工程研究与临床康复,2007;11(23):4470-4472.
5 唐 嵘,樊均明.肌成纤维细胞与肾间质纤维化[J].中国中西医结合肾病杂志,2002;3(5):308-310.
6 李 超,吴瑜瑜.白细胞介素1β对人眼小梁细胞基质金属蛋白酶-3表达的影响[J].临床眼科杂志,2008;16(4):298-301.
7 刘继红,蔡学泳,何其华.细胞骨架的激光共聚焦研究技术[J].中国医学装备,2005;2(6):49-51.
[收稿2009-11-20 修回2010-01-11]
(编辑 张晓舟)
Interleukin-1βinduced transdifferentiation of renal tubular epithelial cells and its effect on the cytoskeleton
WANGGuang-Lan,CHENShuang,WANGXin-Rui,SHIYing-Ai,ZHANGLi-Hong,LIUXiao-Hui,WUShan.KeyLaboratoryofPathobiology,MinistryofEducation,JilinUniversity,Changchun130021,China
Objective:To investigate the effectof interleukin-1β (IL-1β)on epithelial-mesenchymal transition(EMT)and cytoskeleton rearrangementof renal tubular epithelial cells.Methods:Immortalized renal tubular epithelial cell line NRK52Ewas cu ltured in vitrowith IL-1β(30 μg/L)for 3 days and 6 days,then the cellmorphology was observed;ThemRNA exp ressions of α-smooth muscle actin(α-SMA),cytoskeleton componentsβ-actin and α-tubulinwere semi-quantitative exam ined by RT-PCR.The proteinexpression ofα-SMA and arrangementsof β-actin and α-tubulin were assessed by immunofluorescent staining.Results:After induced by IL-1β for 3 days and 6 days in vitro,themRNA and protein expressionofα-SMA increased significantly comparedwith corresponding control cells(P<0.001),it prompted that NRK52E cells underwent EMT;At the same time,the cellmorphology also changed,from a typicalmultilateral paving stone to fibroblast-like appearance,with mu ltiple processes;Cytoskeletal proteinβ-actinmRNA exp ression was also slightly increased(P<0.05).The distributions and arrangements ofβ-actin protein were also changed,from cellmembrane transferred to peri-nucleus and cytoplasm,moreover it formed fiberbundle-like structures.However,another cytoskeleton protein α-tubu lin in IL-1β induced cells,neither it'smRNA expression nor it's distribution had significant differences comparedwith the controlgroup.Conclusion:IL-1βcan induce NRK52E cellsundergoing EMT in vitro,cellmorphology changesinto fibroblast-like appearancewithmultiple processes,and also the cytoskeleton proteinβ-actin expression increases and rearrangementoccurrs.However,there was no changes onα-tubu lin.
Interleukin-1β ;Transdifferentiation;α-SMA;β-actin;α-tubulin
R329.2
A
1000-484X(2010)03-0210-04
①本文为教育部高校优秀青年教师奖励计划(201182)和吉林省卫生厅重点实验室基金
②吉林大学人兽共患病研究所,长春130061
王光兰(1981年-),女,在读医学博士,主要从事肾脏病理学研究;
及指导教师:吴 珊(1962年-),女,教授,博士生导师,主要从事肾脏病理研究。
