电刺激小脑顶核对成年大鼠局灶脑缺血再灌注后脑内神经营养因子bFGF mRNA的影响
2010-01-26黄艳君张中念
黄艳君 张中念 罗 勇
1)四川绵阳市第三人民医院神经内科 绵阳 621000 2)重庆医科大学附属第一医院神经内科 重庆 400016 3)重庆市神经病学重点实验室 重庆 400016
脑血管病以其高发病率和高致残率成为当前严重威胁人类健康的一类重要疾病,其中尤以缺血性脑血管病最为常见。研究表明电刺激小脑顶核(fastigial nucleus stimulation,FNS)可产生较为广泛的神经保护作用。神经营养因子与中枢神经系统的恢复密切相关,对神经再生、神经元迁移、轴突的发芽、延长和成束以及神经环路的正确形成起着重要作用。本文观察了局灶脑缺血再灌注大鼠脑内侧脑室和海马碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)mRNA的动态变化以及FNS后的影响,以初步探讨FNS对受损脑组织功能重建的作用。
1 材料和方法
1.1 材料 选取健康雄性的Wistar大鼠180只,清洁级,8周龄,体质量250~300g,由重庆医科大学实验动物中心提供。大鼠术前12h禁食不禁水。主要试剂与仪器:针对大鼠bFGF靶基因的 mRNA序列的寡核甘酸探针:(1)5’-GGCTT CTTCC TGCGC ATCCA CCCCG ACGGC-3’;(2)5’-AGCAG AAGAG AGAGG AGTTG TGTCT ATCAA-3’;(3)5’-TGGAA TCTAA TAACT ACAAT ACTTA CCGGT-3’(探针由武汉博士德生物技术有限公司设计合成并用地高辛标记)。原位杂交试剂盒和原位杂交专用盖玻片(武 汉 博 士 德);DEPC 和 Poly-L-Lysine (Sigma(USA));DAB显色剂(北京中山);立体定位仪,SEN 3301型方波脉冲电子刺激器(日本光电公司);电动恒流泵(上海精科实业有限公司)。
1.2 方法 大鼠大脑中动脉局灶脑缺血再灌注模型制备:根据Longa等[1]报道的方法,参照罗勇等[2]的经验,采用线栓法规范化制备右侧大脑中动脉局灶脑缺血再灌注模型。模型成功标准:左侧肢体疼痛回缩迟钝或消失,提尾倒悬时左上肢向胸前屈曲,行走时向左侧倾倒或向左转圈;右侧出现霍纳(Honer’s)氏征。排除标准:神经学症状评分低于2分者,蛛网膜下腔出血者,HE染色无缺血病理改变者,未到观察时相点便死亡者。凡因上述因素导致各实验组动物数不足预定数量者采用随机抽样原则补齐。
分组及干预:雄性 Wistar大鼠随机分为正常组(NC组)、假手术组(SC组)、模型组(I/R组)、小脑顶核假刺激组(I/RFs组)、小脑顶核刺激组(I/RF组),每组根据再灌注时间的不同又分为1d,3d,7d,14d,21d,28d6个时间点进行观察(n=6)。均于缺血1h后行再灌注,并于再灌注后立即刺激左侧小脑顶核1h。I/RF组大鼠给予电刺激小脑顶核:大鼠用3.5%水合氯醛腹腔注射(1mL/100g)麻醉,固定于立体定向仪上,参照Nakai[3]的方法,根据 Wistar大鼠脑立体定向图谱,结合鼠的大小确定左侧小脑顶核位置,将同心圆电极插入左侧小脑顶核(病灶对侧)进行刺激。I/RFs组操作同I/RF组,电极插入小脑顶核但不通电流刺激,只留针1h。
1.2.1 神经功能评分:参照Zea Longa 5分制评分标准[1],大鼠清醒后评分。所有动物于脑缺血再灌注后1h,6h,12 h,1d,3d,7d进行评定。固定、取材、切片:于脑缺血再灌注后1d,3d,7d,14d,21d,28d,经左心室常规灌注固定,开颅取脑,由前向后作冠状切片,取经侧脑室(包含室管膜下区)及海马中心脑组织块各1块,行固定、脱水、浸蜡、包埋、石蜡切片(片厚4μm)。取材部位:侧脑室(AP前囟-0.30至前囟-1.2mm),海马(AP前囟-3.14至前囟-4.5mm)。
1.2.2 原位杂交检测侧脑室和海马bFGF mRNA表达:按试剂盒说明进行。阴性对照用预杂交液代替杂交液,用正常羊血清代替地高辛抗体,其余步骤相同。1.2.3 图像分析及统计学处理:切片在统一放大倍数(×200)下,随机选择10个非重叠视野,每只动物的每个部位随机取5张非连续切片,应用重庆医科大学电镜室北航CM-2000B型生物医学图像分析系统,检测阳性细胞的平均光密度值。
2 结果
2.1 侧脑室区域 NC组侧脑室室管膜及室管膜下区可见少量bFGF mRNA的阳性表达。局灶脑缺血/再灌注后1d,I/R组缺血侧侧脑室区域bFGF mRNA表达略有增加(P<0.05),3d时达一小高峰(P<0.01),且外侧壁阳性细胞较内侧壁多,在背外侧有一些阳性细胞聚集,沿胼胝体下缘向缺血区方向延伸,由内向外细胞数逐渐减少,7d开始下降(P<0.01),28d时下降到略高于正常水平(P<0.05),I/RFS组与I/R组变化相似,比较差异无统计学意义(P>0.05)。局灶脑缺血/再灌注后再给予FNS,I/RF组1d时bFGF mRNA即明显增加(P<0.01),3d时增加更明显(P<0.01),7 d才达到高峰(P<0.01),且在外侧壁,阳性细胞聚集形成长尾状阳性细胞链,沿胼胝体下缘向缺血区方向延伸,而且由内向外细胞数逐渐减少,14d后缓慢下降,与I/R组和I/RFS组相比,差异有统计学意义(P<0.05)(表1)。
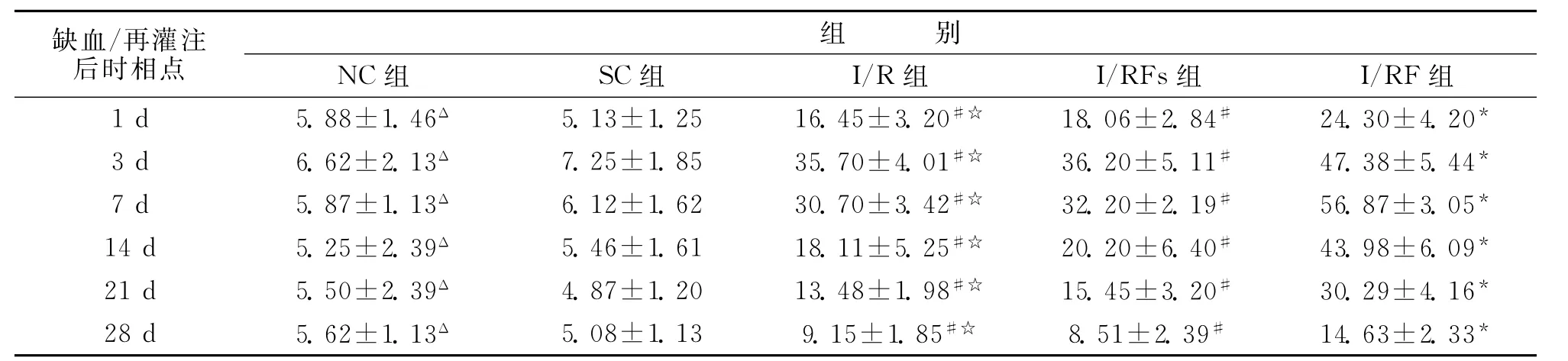
表1 各实验组侧脑室区bFGF mRNA的表达水平(光密度)
2.2 海马区域 正常海马区可见少量bFGF mRNA的阳性表达,主要位于海马锥体细胞层、CA1、CA2区。局灶脑缺血/再灌注后,I/R组缺血侧海马可见bFGF mRNA的强阳性表达,1d时开始增加(P<0.05),3d即达一小高峰(P<0.01),7d开始下降,21d时明显下降,28d时降到正常水平(P<0.05),与NC组和SC组对应时间点比较,差异有显著性(P<0.05),I/RFS组与I/R组变化相似,比较无差异(P>0.05)。局灶脑缺血/再灌注后再给予FNS,缺血侧海马bFGFmRNA的表达更加强烈,1d时明显增加(P<0.01),3 d后bFGFmRNA继续升高(P<0.01),到7d时才达高峰(P<0.01),峰值更高,14d时缓慢下降(P<0.01)。I/RF组与I/R组和I/RFS组相比,bFGF mRNA的表达在各对应时相点都有增加,差异有显著性(P<0.05)(表2)。
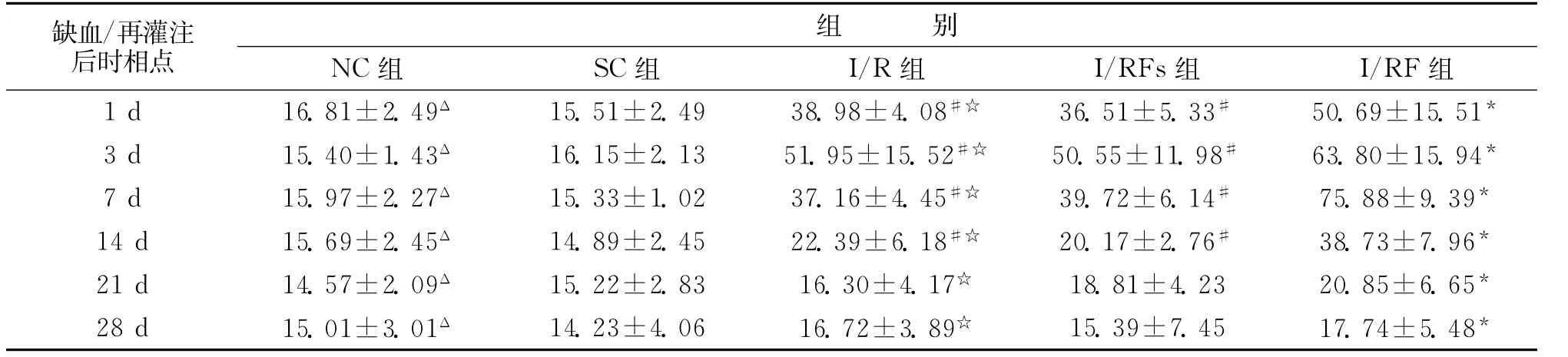
表2 各实验组海马区bFGF mRNA的表达水平(光密度)
3 讨论
神经营养因子是神经系统重要的生物活性因子,对神经系统的正常分化、发育、成熟、维持功能和存活、损伤修复等均具有重要的生物学作用。bFGF是FGF基因家族中主要成员之一。它是一种具有强烈促增殖效应的多肽因子,也是内皮细胞的有丝分裂原和血管再生因子,在神经系统的分化、发育和成熟过程中具有重要作用[4-5]。
正常情况下,脑内仅有少量bFGF表达,当脑受到各种损害时,即可诱导bFGF表达增加。近年来脑缺血再灌注动物模型研究表明,脑缺血再灌注可引起内源性bFGF mRNA表达增加,并对神经细胞具有保护、修复作用和抗细胞凋亡作用。本实验观察到,正常侧脑室室管膜及室管膜下、海马锥体细胞层、CA1、CA2区可见少量bFGF mRNA的阳性表达,局灶脑缺血/再灌注后1d,I/R组缺血侧侧脑室区域bFGF mRNA表达略有增加,3d时达一小高峰,且外侧壁阳性细胞较内侧壁多,在背外侧有一些阳性细胞聚集,沿胼胝体下缘向缺血区方向延伸,由内向外细胞数逐渐减少,7d开始下降;在海马区域,局灶脑缺血/再灌注后,I/R组缺血侧海马可见bFGF mRNA的强阳性表达,1d时开始增加,3d即达一小高峰,7d开始下降。国外研究显示,缺血6h后即出现bFGF基因表达增高,于24h达到最高峰,1周左右降至对照组水平,2周后又呈现逐渐升高趋势。与我们的结果不完全一致,可能与动物种类、动物模型等的不同选择有关[6-7]。Hsu[8]等指出,脑缺血可能通过刺激即早基因,如cfos、c-jun等基因表达,进而从转录水平上诱导包括 NGF、BDNF在内的神经营养因子等晚期效应器基因表达。
近年来研究发现,FNS可产生较为广泛、持久的神经保护作用。FNS后大脑皮质局部脑血流的增加可达对照组的300%,而不伴脑组织糖代谢率的改变[9];预先FNS 1h,可使脑梗死体积缩小约50%,产生的脑保护作用可持续10d以上;其缩小脑梗死体积的效果是特异性的,刺激其他脑区则不能减轻脑缺血损害[10]。本实验观察到局灶脑缺血/再灌注后再给予FNS,I/RF组1d时bFGF mRNA即明显增加,3d时增加更明显,7d才达到高峰,且在外侧壁,阳性细胞聚集形成长尾状阳性细胞链,沿胼胝体下缘向缺血区方向延伸,而且由内向外细胞数逐渐减少;而在缺血侧海马,局灶脑缺血/再灌注后再给予FNS,bFGFmRNA的表达更加强烈,到7d时才达高峰,峰值更高,14d时缓慢下降。I/RF组与I/R组和I/RFS组相比,bFGF mRNA的表达在各对应时相点都有增加,提示FNS后侧脑室和海马bFGFmRNA的反应强烈。研究发现,FNS1h可抑制线粒体释放细胞色素C,减轻Ca2+超载,可促进同侧梗塞皮质表达解偶联蛋白UCP4及 UCP4mRNA,从而维持缺血后线粒体的功能[11-14]。国内基础研究发现,FNS可促进脑缺血后毛细血管新生和神经组织的结构重建;增加脑血供[15-16]。bFGF是一种具有多种生物活性的神经营养因子,其与相关联的受体结合导致广泛的细胞反应,包括细胞增殖和分化、血管形成和抑制凋亡等[17]。研究表明,脑缺血后神经营养因子可在一定时间内表达上调,而神经营养因子又是神经干细胞增殖、迁移、分化、网络化的重要因素。FNS可能通过以上途径抑制了脑缺血过程中神经细胞凋亡,有利于细胞存活,改善了神经功能,但其确切的分子机制有待进一步研究。
[1]Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[2]Luo Yong,Dong Weiwei.An experimental study on focal cerebral ischemia/reperfusion model in Wistar rats with suture method[J].Journal of Chongqing Medical University,2002,27(1):1-4.
[3]Nakai M,Iadecola C,Ruggiero DA,et al.Electrical stimulation of cerebellar fastigial nucleus increases cerebral cortical blood flow without change in local metabolism:evidence for an intrinsic system in brain for primary vasodi-lation[J].Brain Res,1983,260(1):35-49.
[4]Eckenstein FP.Fibroblast growth factors in the nervous sys-tem[J].J Neurobiol,1994,25(11):1 467-1 480.
[5]Powell PP,Finklestein SP,Dionne CA,et al.Temporal,differential and regional expression of mRNA for basic fibroblast growth factor in the developing and adult rat brain[J].Brain Res Mol Brain Res,1991,11(1):71-77.
[6]Speliotes EK,Caday CG,Do T,et al.Increased expression of basic fibroblast growth factor(bFGF)following focal cerebral infarction in the rat[J].Brain Res Mol Brain Res,1996,39(1/2):31-42.
[7]Endoh M,Pulsinelli WA,Wagner JA.Transient global ischemia induces dynamic changes in the expression of bFGF and the FGF receptor[J].Brain Res Mol Brain Res,1994,22(1/4):76-88.
[8]Hsu CY,An G,Liu JS,et al.expression of immediate early gene and growth factor mRNAs in a focal cerebral ischemic modal in the rat[J].Stroke,1993,24(SuppleⅠ):78.
[9]Reis DJ,Berger SB,Underwood MD,et al.Electrical stimulation of cerebellar fastigial nucleus reduces ischemic infarction elicited by middle cerebral artery occlusion in rat[J].J Cereb Blood Flow Metab,1991,11(5):810-818.
[10]Reis DG,Golanov EV,Galea E,et al.Central neurogenic neuroprotection:central neural systems that protect the brain from hypoxia and ischemia[J].Ann NY Acad Sci,1997,835(1):168-186.
[11]Golanov EV,Liu F,Reis DJ.Stimulation of cerebellum protects hippocampal neurons from global ischemia[J].Neuroreport,1998,9(5):819-824.
[12]Zhou P,Qian L,Glickstein SB,et al.Electrical stimulation of cerebellar fastigial nucleus protects rat brain,in vitro,from staurosporine-induced apoptosis[J].J Neurochem,2001,79(2):328-338.
[13]Zhou P,Qian L,Zhou T,et al.Mitochondria are involved in the neurogenic neuroprotection conferred by stimulation of cerebellar fastigial nucleus[J].J Neurochem,2005,95(1):221-229.
[14]Shant J,Shiflett JM,Chen B,et al.Neuroprotective stimulation of the cerebellar fastigial nucleus modifies expression of uncoupling protein 4[J].Stroke,2005,36(2):433-434.
[15]石正洪,董为伟 .电刺激小脑顶核促脑缺血后毛细血管新生的实验研究[J].中风与神经疾病杂志,2003,20(3):250-252.
[16]代瑞廷,曹艳霞,张杏红,等 .电刺激小脑顶核对急性脑梗死患者血浆CGRP的影响[J].中风与神经疾病杂志,2002,19(5):293-293.
[17]Jin-qiao S,Bin S,Wen-hao Z.Basic fibroblast growth factor stimulates the proliferation and differentiation of neural stem cells in neonatal rats after ischemic brain injury[J].Brain Dev,2009,31(5):331-340.
