β-catenin在高温致金黄地鼠神经管畸形神经上皮细胞中的表达变化
2010-01-25管英俊张炳强孙丰刚安淑红
石 娟 管英俊 张炳强 孙丰刚 安淑红
(1.泰山医学院人体解剖学教研室,山东 泰安 271000;2.潍坊医学院组织胚胎学教研室,山东 潍坊 261042)
神经管畸形(neural tube defects,NTDs)是一类发生率最高、危害最大的先天畸形,可由遗传因素和各种环境因素引起,表现为无脑、露脑、脑膨出、脊柱裂等[1]。高温在自然环境、劳动环境和多种疾病中经常出现且难以避免,但其分子机制尚不明确。探讨高温致畸分子机制,寻找防治NTD的有效措施己成为当前该领域研究的热点之一。
Wnt信号通路是一条控制神经元迁移、细胞黏附和细胞增殖等调控神经元发育的重要信号通路[2]。β-catenin作为把核外信号传递到核内的信号蛋白,在Wnt信号通路中发挥重要作用,该蛋白的表达水平直接影响着Wnt信号通路所起到的生物学效应。Zhang等[3]报道,孕鼠摄入过量维甲酸致胚胎神经管β-catenin表达下调而诱发NTD。β-catenin在高温致NTD中的作用机制目前尚不清楚。本实验在高温致NTDs模型上,通过免疫组织化学染色技术和Western blot观察β-catenin在NTDs发生过程中胎鼠神经上皮细胞中的表达变化,探讨β-catenin与神经管发育及高温致畸发生之间的关系,以进一步探讨NTDs发生的分子机制,为预防人类NTDs的发生提供理论依据。
1 材料与方法
1.1动物模型的建立 成年未经产雌性金黄地鼠72只,由卫生部生物制品研究所提供,体重(100±10) g。鼠颗粒饲料喂养,常规饮水,于晚7~9时与雄鼠按1︰1合笼,观察有交配动作者次日定为孕l d(E1 d)。孕鼠随机分为对照组和实验组,各36只,均健康成活至实验结束。实验组孕鼠于孕8 d下午3~4时置42℃水浴20 min,对照组置37℃水浴20 min。分别于水浴后16、40、64 h(相当于胚龄第8.5、9.5、10.5 d)将孕鼠处死,剖腹取鼠胚。
1.2免疫组织化学染色 胚胎4%多聚甲醛固定后常规石蜡包埋,连续切片,厚5 μm。E8.5 d的鼠胚切片每间隔50~100 μm裱片,E9.5和10.5 d的鼠胚切片每间隔100~200 μm裱片保留,备染。切片常规脱蜡入水,0. 01 mol/L枸橼酸盐缓冲液(pH 6. 0)微波抗原修复,冷却后用0. 01 mol/L PBS冲洗;滴加正常山羊血清,37℃孵育30 min;滴加小鼠抗β-catenin(1︰200,cell signaling),4℃冰箱过夜,次日用0.01M PBS冲洗后, 滴加生物素标记的二抗(试剂B),37℃孵育1 h,0.01M PBS冲洗;滴加辣根过氧化物酶标记的链酶卵白素,37℃孵育30 min,0.01 M PBS冲洗;DAB显色、二甲苯透明、中性树脂封片、显微镜(Leicad-IMIRB)下观察拍照。用PBS代替一抗作为阴性对照。
1.3Western blot 孕鼠胚胎解剖镜下剥离鼠胚神经管后置于冻存管,并储存于液氮中备用。胚胎神经管组织分别按100 mg/ml加入200 μl RIPA裂解液(南京凯基生物科技发展有限公司)中,并在加入蛋白酶抑制剂(PMSF、aprotinin各1 μl)后匀浆。冰上静置1 h,于4℃13000 r/min离心30 min。提取上清液,Bradford法测蛋白含量,加入2×SDS上样缓冲液,沸水煮5 min,每孔加等量蛋白样品,SDS-聚丙烯酰胺凝胶(12% )电泳。电泳后湿转至硝酸纤维素膜上。5%脱脂奶粉TBST液室温震荡封闭4 h后TBST洗膜,15 min/次×3,加入TBST稀释的小鼠抗β-catenin (1︰2000),4℃过夜,次日TBST洗膜,15 min/次×3,加入TBST稀释的羊抗小鼠IgG-HRP (1︰5000),室温孵育2 h,TBST洗膜,15 min /次×3,加入ECL发光剂室温反应2 min,暗室用X感光胶片曝光显影后冲洗胶片。以上步骤完成后,按同样步骤检测膜上的β-actin(1︰2000)蛋白量。胶片上的蛋白条带经扫描后用Quantimet570IW(Leica)计算机图像分析和处理系统对条带进行半定量光密度分析。
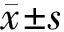
2 结 果
2.1免疫组织化学染色结果 β-catenin在各个时间点实验组和对照组神经上皮细胞及周围间充质均有不同程度的阳性着色,靠近管腔面的多定位于胞浆,其它部位的阳性着色多定位于胞核,其中E10.5 d靠近管腔面胞浆无明显表达。随胚龄增加对照组表达水平呈现下降的趋势,实验组在高温处理后E8.5和9.5 d,β-catenin表达水平低于对照组,差异具有统计学意义(P<0.05,表1,图1)。
2.2Western blot实验结果 β-catenin在对照组各个时间点神经管持续表达,随着胚龄的增长呈现下降趋势,表达峰值出现在E8.5 d。β-catenin在高温处理后E8.5和9.5 d的表达水平明显低于正常对照组,差异具有统计学意义(P<0.05),E10.5 d其表达水平与对照组相比差异无统计学意义(表2,图2)。

表1 高温对金黄地鼠胚胎神经上皮细胞β-catenin表达的影响
注:*与对照组相比,P<0.05。

表2 高温对金黄地鼠胚胎神经管β-catenin蛋白表达的影响
注:*与对照组相比,P<0.05。
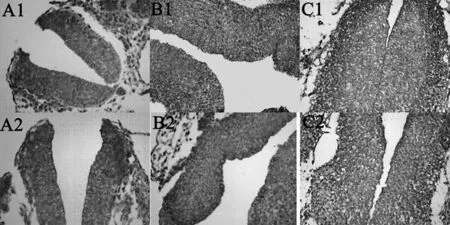
图1 神经管组织β-catenin的表达(×400)实验组(A1,B1,C1),对照组(A2,B2,C2),E8.5(A),E9.5(B),E10.5(C)

图2 β-catenin在胚胎神经管组织中的表达对照组(c),实验组(e)
3 讨 论
神经管形成是胚胎发生过程中的重要环节,是诸多细胞行为按一定顺序发生的结果,包括细胞增殖、分化、迁移、粘着、凋亡等,涉及到一系列基因的开放和表达。在神经管形成和分化过程中,某一或某些相关基因的不表达、过表达或低表达都会引发神经管发育异常,造成NTD。
β-连环蛋白(β-catenin)是一种重要的细胞黏附分子和信号转导蛋白,在Wnt信号转导途径中发挥重要的作用。Wnt基因作为进化上高度保守的一个家族,它们在正常胚胎发育过程中参与了体轴与胚层形成、器官发生发育、干细胞分化和细胞命运决定,Wnt基因异常的时空表达或异常激活与神经的异常发育分化有关。Wnt在细胞内的通路发现至少有4条,其中经典的Wnt/β-catenin信号通路(canonical wnt/β-catenin pathway)的传导机制最为明确,在NSC的增殖和分化中主要涉及经典Wnt途径的传导。在未受刺激的细胞中没有Wnt信号时,新合成的β-catenin与胞浆中APC、AXIN、CK1和GSK3β相互作用、结合,形成“降解复合物”降解β-catenin[4]。在Wnt信号或其它细胞外信号刺激下,Wnt与细胞表面受体Friz-zled家族结合,通过Dishevelled蛋白拮抗β-catenin降解复合物(GSK3β-Axin-APC)的形成,进而阻断β-catenin磷酸化、泛素化(ubiquitination),β-catenin分子在细胞内集聚,并与转录因子Tcf-4/Lef结合形成转录复合物转运入核,启动下游靶基因如c-myc、cyclinD1的转录和表达,调控细胞生长[5]。
Wnt信号通路参与调节生物体发育过程中多种干细胞的增殖与分化[6]。Willert等[7]首次发现Wnt/β-catenin途径的调控,将维持干细胞增殖状态,阻止其分化。然而另有报道[8],Wnt信号通过Tcf/β-catenin和Crebbp的相互作用介导神经分化而不是增殖。在中枢神经系统的发育中,Wnt/β-catenin途径引导脊髓背侧联合神经元(Commissural neurons)的轴突在穿过脊髓中线后由D-V(背-腹)方向改为A-P(头-尾)方向[9];控制中枢神经系统神经前体细胞的生长以及细胞增殖与分化的平衡[10]。
在哺乳类神经系统发育过程中,作为Wnt信号通路的关键组成成分,β-catenin蛋白表达水平变化会导致中脑、海马、脊髓等神经组织的缺失或异常。Yusuke等[11]研究了Wnt/β-catenin对E11.5鼠的皮层神经元发育的作用,发现稳定表达的β-catenin不能诱导早期发育阶段的皮层NSC向神经元分化,但Wnt能促进早期发育阶段中的NSC自我更新。β-catenin的失活可导致大脑和颅面发育的明显障碍以及背腹侧形成的异常[12]。Chen和Walsh[13]通过转基因的方法使胚胎发育时期(E15,E17.5d)小鼠的神经干细胞稳定表达β-catenin,结果发现皮层面积较对照组明显增大,脑的表面出现类似高级哺乳动物的脑沟和脑回,且侧脑室周围区域有神经干细胞的聚集。也有研究者利用两个条件性的β-catenin突变型等位基因来改变CNS组织中的β-catenin信号,一个剔除β-catenin,另一个过表达有活性的β-catenin,结果发现在剔除β-catenin以后,小鼠大脑和脊髓发育延缓,神经前体细胞群也不能维持,而过表达β-catenin小鼠的大脑和脊髓组织成分则增加,神经前体细胞群体增大[10]。Junghans等[14]研究发现,从皮质发育早期的神经前体细胞敲除β-catenin可导致神经上皮分层脱离,失去完整性,并出现大量的细胞凋亡。
本实验结果显示,神经管发育过程中Wnt信号分子β-catenin的时空分布呈现规律性变化。β-catenin在E8.5~10.5 d的正常金黄地鼠神经管组织中持续表达,同时在神经管组织周围间充质中也有不同程度的表达,与文献报道[15]一致,并且在靠近神经管腔侧β-catenin主要在胞浆表达,E8.5~9.5 d神经管组织中β-catenin表达水平较高,此时正值神经管闭合的时期,提示β-catenin在神经管发育中发挥重要作用。本实验结果还显示,实验组和对照组相比,E8.5和9.5 d的β-catenin表达明显下调(P<0.05),提示高温可能诱发β-catenin表达下调,从而抑制了神经干细胞的增殖分化,导致神经管闭合障碍。高温使神经管β-catenin的表达下降,这可能是高温致畸中的重要机制之一。
[1] Kibar Z, Capra V, Gros P.Toward understanding the genetic basis of neural tube defects[J].Clin Genet,2007,71(4):295-310.
[2] Yeo SY,Chitnis AB.Jagged-mediated Notch signaling maintains proliferating neural progenitors and regulates cell diversity in the ventral spinal cord[J].Proc Natl Acad Sci USA,2007,104(14)5913-5918.
[3] ZHANG Yan-ping. Modulation of retinoic receptor alpha and beta and Its Links with beta-catenin and caspase-3 after maternal exposure to all-trans-retionic acid in KM mouse fetuses[J].Progress in Biochemistry and Biophysics,2007,34(11):1182-1189.
[4] Liu X, Rubin JS, Kimmel AR. Rapid, wnt-induced changes in GSK 3 beta associations that regulate beta-catenin stabilization are mediated by Galpha proteins[J].Curr Biol,2005,15 (22 ):1989-1997.
[5] Seto ES, Bellen HJ. The ins and outs of wingless signaling[J].Trends Cell Biol,2004,14 (1):45-53.
[6] Reya T,Clevers H.Wnt signalling in stem cells and cancer[J].Nature, 2005,434(7035):843-850.
[7] Willert K, Brown JD, Danenberg E, et a1.Wnt proteins are lipidmodified and can act as stem cell growth actors[J].Nature,2003,423(6938):448-452.
[8] Teo JL,Ma H,Nguyen C, et al. Specific inhibition of CBP/beta-catenin interaction rescues defects in neuronal differentiation caused by a presenilin-1 mutation[J]. Proc Natl Acad Sci USA.2005,102(34):12171-12176.
[9] Lyuksyutova AI, Lu CC, Milanesio N, et al.Anterior-posterior guidance of commissural axons by Wnt-frizzled signaling[J].Science,2003,302 (5652):1984-1988.
[10] Zecher D,Fujita Y,Hulsken T, et al.Beta-Catenin signals regulate cell growth and the balance between progenitor cell expansion and differentiation in the nervous system[J].Dev Biol,2003,258(2):406-418.
[11] Hirabayashi Y, Itoh Y, Tabata H, et al. The Wnt/beta-catetin pathway directs neuronal differentiation of cortical neural precursor cells[J]. Development, 2004,131(12):2791-2801.
[12] Backman M, Machon O, Mygland L, et al. Effects of canonical Wnt signaling on dorso-ventral specification of the mouse telencephalon[J].Dev Biol, 2005,79(1):155-168.
[13] Chen A, Walsh C A. Regulation of cerebral cortical size by control of cell cycle exit in neural precorcurs[J].Science,2002,297(2):365-369.
[14] Junghans D, Hack I, Frotscher M, et al. Beta-catenin-mediated cell-adhesion is vital for embryonic forebrain development[J]. Dev Dyn, 2005,233 (2):528-539.
[15] Torban E, Wang HJ, Patenaude AM, et al. Tissue, cellular and sub-cellular localization of the Vang12 protein during embryonic development: effect of the Lp mutation[J]. Gene Expr Patterns,2007,7(3): 346-354.
