骨髓间充质干细胞向视网膜光感受器样细胞诱导分化探讨
2010-01-07陈金国徐国兴
陈金国 徐国兴 白 月 徐 巍 郭 健
骨髓间充质干细胞向视网膜光感受器样细胞诱导分化探讨
陈金国 徐国兴 白 月 徐 巍 郭 健
福建医科大学附属第一医院,福建省眼科研究所
目的:探讨体外培养的大鼠骨髓间充质干细胞(rat mesenchymal stem cells,rMSCs)诱导分化成视网膜光感受器样细胞的能力。方法:用贴壁筛选法分离、培养SD大鼠骨髓MSC细胞,经流式细胞仪鉴定后,利用光感受器细胞培养上清液诱导MSC细胞14 d。用免疫细胞化学染色和Rt-PCR观察诱导后的细胞是否表达视紫红质(Rhodopsin)、神经元特异性烯醇化酶(NSE),胶质纤维酸性蛋白(GFAP)。结果:诱导细胞14d后即可见有神经元样细胞出现,实验组MSC的Rhodopsin表达率为35.1%±6.2 %,而对照组中无Rhodopsin阳性的细胞, 实验组MSC的NSE表达率为33.6%±4.0 %,对照组为10.6%±5.0%, 实验组MSC的GFAP表达率为9.6%±1.5 %,对照组为13.7%±3.0 %。RT-PCR鉴定结果分析示实验组MSC的GFAP、NSE、Rhodopsin mRNA均有表达,而对照组的只表达GFAP和NSE,未见Rhodopsin条带。结论:体外培养的rMSC,经过视网膜光感受器细胞培养上清液导,可以分化为视网膜光感受器样细胞。
骨髓间充质干细胞 光感受器细胞 诱导分化
骨髓间充质干细胞(mesenchymal stem cell,MSC),是一群具有多向分化潜能的均质性成体干细胞,它具有两项干细胞最显著的生物学特性:自我更新 (self-renewa1)能力及多向分化潜能。1968年, Friedenstein[1]等学者首先报告骨髓中存在一种细胞具有高度的自我更新能力和多向分化潜能,他们认为这种细胞可能是间充质细胞的前体。随着研究的发现,MSC具有向中内外胚层组织细胞分化的能力 ,可以在体外被诱导分化为肌肉细胞、成骨细胞、软骨细胞、脂肪细胞、成纤维细胞、肝细胞、上皮细胞、神经细胞等[2, 3]。近年来,BMSCs向神经元细胞的分化的研究成为了研究的热点。可利用抗氧化剂、生长因子、维甲酸、共培养等将骨髓间充质干细胞诱导成神经样细胞[4-6]。本文探索了利用视网膜光感受器培养上清液体外诱导BMSCs分化为视网膜光感受器样细胞的可行性。
1 材料和方法
1.1 材料
清洁级健康Sprague-Dawley(SD)大鼠20只40眼,重量100~125g,购于上海斯莱克实验动物有限责任公司; DMEM培养基(美国Hyclone公司) ,Neurobasal培养基(美国Invitrogen公司),B27(美国Invitrogen公司) ,胎牛血清(美国Hyclone公司),0.25%胰蛋白酶(美国Hyclone公司),木瓜蛋白酶(美国sigma公司),多聚赖酸(美国sigma公司),小鼠抗大鼠单CD34-FITC、CD44-PE和CD90-PE,以及相应同型对照单抗小鼠IgG1-FITC, IgG1-PE和IgG2a –PE(Beckman-Coulter公司),神经元特异性标志小鼠抗大鼠醇化酶(美国 Fisher Scientific公司),光感受器特异性标志小鼠抗大鼠单克隆抗体视紫质(Rhodopsin)(RET-P1,美国Millipore公司),星形胶质细胞特异性标志小鼠抗大鼠单克隆抗体神经胶质酸性蛋白(GFAP)(美国 Fisher Scientific公司),DAB显色试剂盒(北京中杉金桥公司),总抽提试剂盒(上海生工生物工程技术服务有限公司),THERMO FORMA 3111 CO2培养箱(美国),OLYMPUS 1×70荧光倒置式相差显微镜(日本),OLYMPUS BH-2型光学显微镜(日本),Beckman-Coulter Epics XL 流式细胞仪(美国),台式高速冷冻离心机(上海),Gene Amp 9700型PCR 扩增仪(美国),Bio-Rad凝胶成像分析系统(Gel DOC2000)(美国),AIR-TECH BCM-1000A型生物洁净工作台(苏州)。
1.2 方法
1.2.1骨髓间充质干细胞的分离培养和鉴定
取清洁级SD大鼠,4mL/kg水合氯醛 (100g/L)进行腹腔麻醉。碘伏消毒,无菌条件下取出大鼠的双侧胫骨和股骨,分别剪断股骨干和胫骨中间及两端的干骺剪断,用含有肝素的培养液10mL进行反复冲洗骨髓腔,冲洗液经200目不锈钢标准筛网过滤组织块以及已凝血块后,进行离心后用20%FBS的DMEM培养基制成单细胞悬液接种于25cm2培养瓶中,24h后首次换液去除未贴壁细胞,以后每2d换液一次,换液前PBS洗去部分未贴壁细胞,当70%~80%细胞达到融合时用0.25%胰蛋自酶消化传代,进行扩增培养。用流式细胞仪检测细胞表面抗原CD34、CD44和CD90的表达[7]。
1.2.2视网膜光感受器细胞的分离培养和鉴定
在暗环境下无菌取下清洁级SD大鼠的眼球,游离出完整的视网膜神经上皮层。利用木瓜蛋白酶进行消化分离出光感受器细胞,用Neurobasal培养基A 1mL(加入1:50的B27和0.5mM L-glutamine)进行避光培养,两天换液一次,将视网膜光感受器细胞培养换液的上清液收集于干净玻璃瓶中,通过0.22um过滤筛过滤后按2:3比例与DMEM培养液混合后备用。分别把消化前和消化后的视网膜片进行HE染色,在显微镜下观察,同时对分离的光感受器细胞进行免疫细胞化学鉴定。
1.2.3对大鼠骨髓间充质干细胞进行诱导以及鉴定
将3代的rMSCs接种在6孔板中。分为2个对照组,4个实验组。实验组加入光感受器细胞上清液与10%FBS的DMEM培养基(2:3)进行诱导,对照组用Neurobasal培养基A与10%FBS的DMEM培养基(2:3)进行培养,在倒置相差显微镜下观察细胞的生长及分化情况,诱导后14天,行免疫细胞化学和Rt-PCR鉴定,免疫细胞化学:PBS洗涤3次,多聚甲醛固定,0.2%Triton-X作用10 min,过氧化酶阻断,非免疫动物血清孵育 10 min,加Rhodopsin(1:100), NSE(1:200) ,GFAP(1:100)抗体,4℃过夜,加入生物素标记的第二抗体,链霉菌抗生物素蛋白-过氧化物酶溶液,DAB溶液显色,苏木素复染,中性树胶封固,在显微镜下观察。RT—PCR法检测实验组和对照当中的GFAP,NSE, Rhodopsin的表达。Rhodopsin引物上游引物ATGTTCGTGGTCCACTTCA3’,下游引物5’ CGTTGTCCTCAGCCGATG 3’,扩增长度为107bp;NSE引物上游引物:5’ CTGTGGTGGAGCAGGAGA 3’,下游引物5’ GGGAGATAGCGGTGTAAC 3’,扩增长度为156bp;GFAP引物上游引物:5’TAGGAGTGGTAGGGCAGACTTG3’,下游引物5’GCAACCAGGAATAGACCTTCACAA 3’,扩增长度为482bp;内参Rat GAPDH 为5’CAGTGCCAGCCTCGTCTC 3’,BC050110为5’ AGGGGCCATCCACAGTCTTC 3’,扩增长度为595bp。参照TRIZOL试剂说明书对诱导的MSC分别提取总RNA,进行反转录、PCR扩增,将 PCR产物电泳后进行图像分析仪采集图像。
统计学处理:采用SPSS13.0统计软件包(statistical package for the social science)分析,采用t检验。
2 结果
2.1 骨髓间充质干细胞的鉴定
培养的大鼠的BMSCs接种后24小时开始贴壁,前3天细胞增殖慢,数量比较少,第3开始细胞的增长速度明显增加,7天后就达到融合状态,呈现漩涡状、菊花状。第三代时,细胞仍呈梭形,生长旺盛。BMSCs标志鉴定结果表明,培养的第三代BMSCs干细胞表面标志CD90阳性(CD90+/CD34-:92%),基质细胞表面标志CD44阳性(CD44+/CD34-:93%)(见图1)。
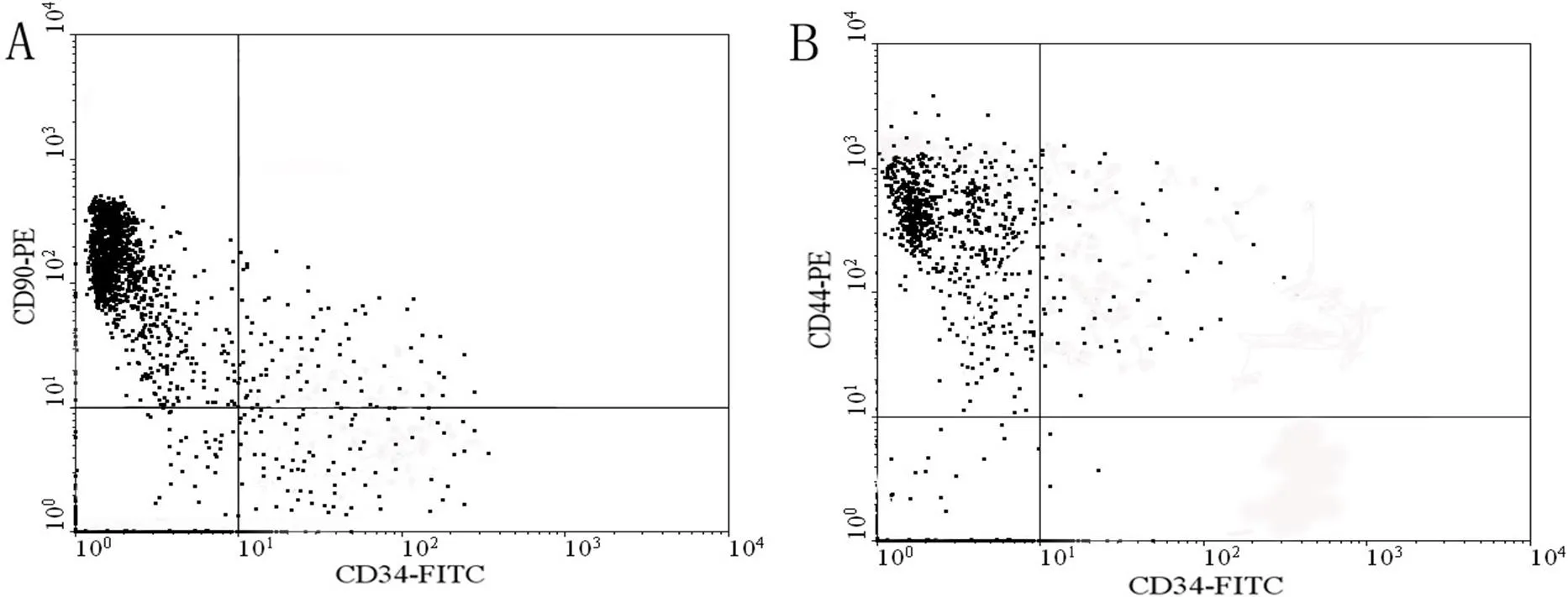
图1 大鼠MSC流式细胞仪检测结果(A: CD90+/CD34-:92%;B: CD44+/CD34-:93%)
2.2 视网膜光感受器细胞的鉴定
取下来的视网膜在消化前后分别进行HE染色,消化前可以很清楚地观察到九层细胞,说明取下来的是完整的视网膜神经上皮层,不含有色素上皮,消化后的视网膜片,光感受器层的细胞变少,其它层细胞完整,光感受器细胞的免疫细胞化学示,光感受器细胞的特异标志物视紫红质的表达率达95%以上。
2.3 大鼠骨髓间充质干细胞的诱导
实验组BMSCs诱导后的第4天细胞形态开始变化,可见小的突起。随后细胞便圆,突起增长,出现少量神经样细胞的形态,到14天最为明显,出现一、二级分支,相互之间连接呈网状。对照组也有少量的细胞呈神经样的形态。诱导后的神经元样细胞GFAP,NSE,Rhodopsin呈强阳性。非神经元样细胞呈多边形或梭形,上述抗体染色呈弱阳性。阴性对照未见染色。
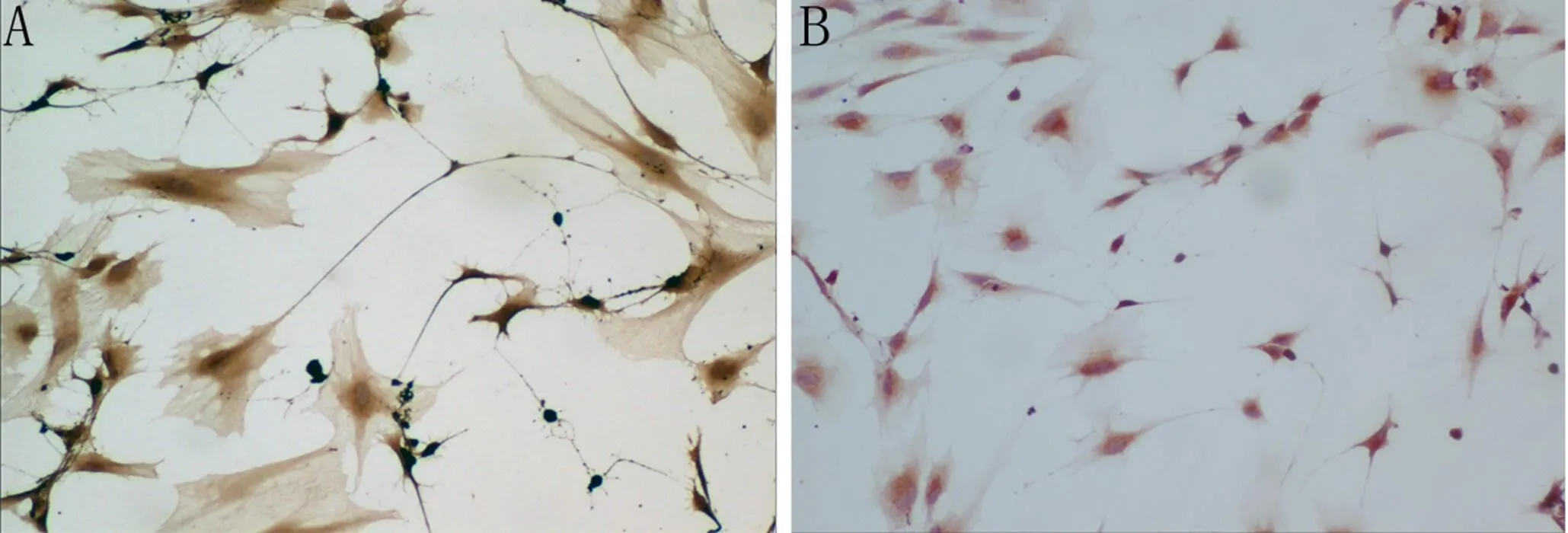
免疫细胞化学鉴定,共培养2周后,阳性细胞计数结果显示: rMSC的Rhodopsin表达率实验组为35.1%±6.2 %(图2A),而对照组中无Rhodopsin阳性的细胞(图2B), rMSC的NSE表达率实验组为33.6%±4.0 %(图3A),对照组为10.6%±5.0%(图3B), rMSC的GFAP实验组的表达率为9.6%±1.5 %(图4A),对照组为:13.7%±3.0 %(图4B);对照组与实验组进行两样本的t检验NSE:F =0.09,方差齐,P < 0.001,有统计学意义,GFAP:F =1.726,方差齐,P >0.05,无统计学意义。

A:实验组大量表达Rhodopsin(×100);B:对照组未表达Rhodopsin(×100)
A:实验组大量表达NSE(×100);B:对照组少量表达NSE(×100)
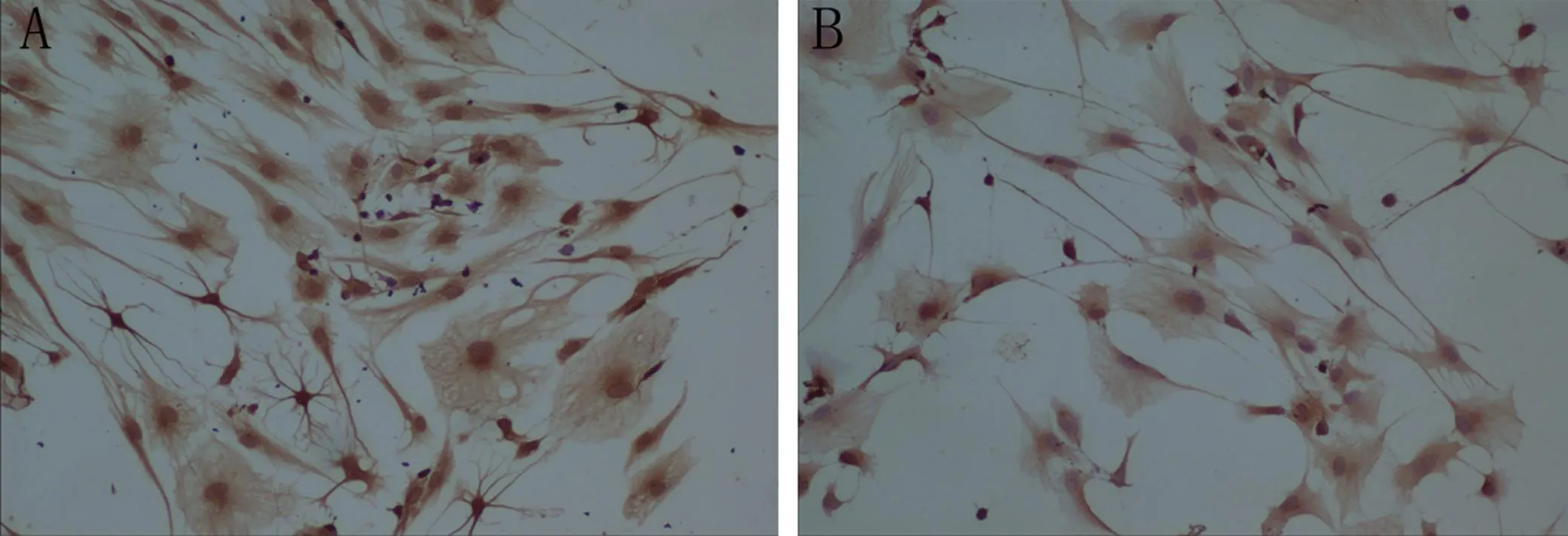
A:实验组表达有GFAP(×100);B:对照组表达有GFAP(×100)
RT-PCR鉴定结果分析显示,实验组MSC的GFAP、NSE、Rhodopsin均有表达,其中GFAP表达比较弱;而对照组的只表达GFAP和NSE,且均较弱,未见Rhodopsin条带(图5)。
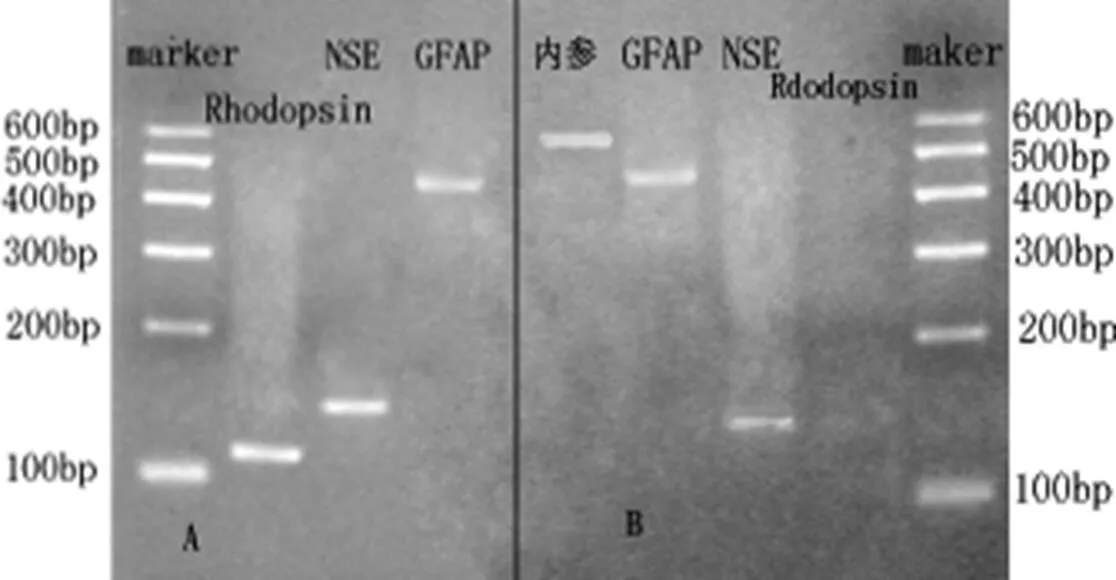
A:为实验组,GFAP、NSE、Rhodopsin均有表达;B:为对照组,只表达GFAP和NSE。
3 讨论
本实验模拟视网膜体内发育的微环境诱导骨髓间充质干细胞成为视网膜细胞,利视网膜光感受器细胞培养上清液对骨髓间充质干细胞进行向视网膜样细胞诱导。本实验关于视紫红质的检测,实验组表达率高达35.1 %±6.2 %,对照组没有表达,说明其光感受器条件培养基能使MSC向光感受器细胞方向转化。从而验证了大鼠MSC确实可以在体外被诱导为表达视紫红质的光感受器样细胞,Tomita M[8]研究表明不管是利用BDNF, NGF, and bFGF或与视网膜片共培养,均未发现表达Rhodopsin的证据。Anthony等[5]对BMSCs向视网膜光感受器细胞诱导分化进行了体内外实验。利用维甲酸、牛磺酸和EGF体外将小鼠 BMSCs成功诱导为视网膜光感受器样细胞,诱导后的细胞可以表达视网膜光感受器细胞特异性标志物:视紫红质、视蛋白和恢复蛋白,最近国内学者单纯用EGF也可以诱导rMSC表达Rhodopsin[9]。本实验当中NSE表达率也明显高于对照组,而GFAP,两组表达并无差异,说明,光感受器条件培养基促进rMSC向神经元细胞方向分化,而对于胶质细胞方向分化并无诱导作用。本实验的对照并未加诱剂的rMSC也能表达神经元特异性标志,Tomita M[8]研究说明没有生长因子诱导的MSC没有向神经方向分的证据,强调生长因子在神经分化中的重要地位,但是也有许多学者提出了在未诱的条件下仍发现神经特异性标志物的表达,Tondreau T等[10]发现未诱的的MSC也可以表达神经特异标记物,如Nestin和β微管蛋白Ⅲ,酪氨酸羟化酶等。Deng J[11]研究中也证实,体外培养大鼠的MSC具有自发表达早期的神经标记物(如Nestin和β微管蛋白Ⅲ),也有细胞表达成熟神经细胞的标记物,如神经微丝M(FNM),这些跟本实验对照组仍能诱导的MSC能表达NSE相一致。
我们的实验利用光感受器细胞上清液模拟视网膜体内发育的微环境诱导骨髓间充质干细胞成为视网膜光感受器样细胞,视网膜神经细胞培养上清液可能在骨髓间充质干细胞的存活与分化方面起重要作用。尽管BMSC向神经细胞分化的研究已获得了一些令人鼓舞的结果,但是还面对了许多待进一步解决的问题:(1)对于BMSC的鉴定一直都没有一个统一的说法,对BMSC的细胞学特点和分化各阶段细胞标志物的进一步研究;(2)光感受器细胞在体外的外节容易脱落变性,如何进一步保持其完整性以及存活时间;(3)体外BMSC向视网膜样细胞诱导分化模式和分子调控机制还不甚清楚,其诱导的微环境还比较复杂,有的学者直接采用鸡尾酒式的加入好几种生长因子进行诱导,对于其中各生长因子具体作用以及相互间的作用仍不清楚;(4)对于本实验诱导出来表达视紫红质的MSC细胞的与真正的光感受器细胞之间不管是从形态上还是都有很大的差距,缩短这一差别,将MSC真正应用于眼科临床,还需进一步深入的研究探索。
[1] Friedenstein AJ, Petrakova KV, Kurolesova AI, et al. Heterotopic of bone marrow. Analysis of precursor cells for osteogenic and hematopoietic tissues[J]. Transplantation, 1968,6(2):230-247.
[2] Pittenger MF, Mackay AM, Beck SC, et al. Multilineage potential of adult human mesenchymal stem cells[J]. Science, 1999,284(5411):143-147.
[3] Bianco P, Riminucci M, Gronthos S, et al. Bone marrow stromal stem cells: nature, biology, and potential applications[J]. Stem Cells, 2001,19(3):180-192.
[4] Woodbury D, Schwarz EJ, Prockop DJ, et al. Adult rat and human bone marrow stromal cells differentiate into neurons[J]. J Neurosci Res, 2000,61(4):364-370.
[5] Kicic A, Shen WY, Wilson AS, et al. Differentiation of marrow stromal cells into photoreceptors in the rat eye[J]. J Neurosci, 2003,23(21):7742-7749.
[6] Ullian EM, Sapperstein SK, Christopherson KS, et al. Control of synapse number by glia[J]. Science, 2001,291(5504):657-661.
[7] 谢茂松,徐国兴,李琼,等.大鼠骨髓间充质干细胞分离培养方法的比较[J]. 国际眼科杂志, 2007,7(5):1285-1287.
[8] Tomita M, Mori T, Maruyama K, et al. A comparison of neural differentiation and retinal transplantation with bone marrow-derived cells and retinal progenitor cells[J]. Stem Cells, 2006,24(10):2270-2278.
[9] 张枝桥, 董方田, 等. 大鼠骨髓间充质干细胞体外诱导为光感受器样细胞的研究[J]. 中华眼科杂志, 2008,44(6):540-544.
[10] Tondreau T, Lagneaux L, Dejeneffe M, et al. Bone marrow-derived mesenchymal stem cells already express specific neural proteins before any differentiation[J]. Differentiation, 2004,72(7):319-326.
[11] Deng J, Petersen BE, Steindler DA, et al. Mesenchymal stem cells spontaneously express neural proteins in culture and are neurogenic after transplantation[J]. Stem Cells, 2006,24(4):1054-1064.
中国卫生部联合攻关课题基金(No.WKJ2005-2-013);人事部留学回国人员优秀课题基金(No.GR-2006-FJ-1)
徐国兴,zjfmuxgx@pub5.fz.fj.cn。
