Cd胁迫对大豆各发育阶段生长及生理指标的影响
2010-01-07廖柏寒黄运湘周细红曾清如中南林业科技大学生物技术开放性中心实验室湖南长沙40004南华大学药学与生命科学院湖南衡阳400湖南农业大学资源环境学院湖南长沙408
廖柏寒,刘 俊,周 航,曾 敏,黄运湘 ,周细红,曾清如 (.中南林业科技大学生物技术开放性中心实验室,湖南 长沙 40004;.南华大学药学与生命科学院,湖南 衡阳 400;.湖南农业大学资源环境学院,湖南 长沙 408)
重金属在土壤中的累积与污染问题越来越受到人们的关注[1-2].随着城市的发展、矿山的开采、农资的使用,土壤环境和食物链中镉(Cd)的总量正日益增加[3-4].Cd对植物具有重金属毒害
性,影响植物的生理生化过程[5-6].研究表明,Cd胁迫能影响大豆幼苗POD活性、根系的生长,并导致膜脂过氧化伤害[7].Cd胁迫导致花荚期大豆生长受到抑制、植株生物量降低、保护性酶功能失调[8].植物在受到重金属胁迫的生长过程中,其生长及生理应随植物生长发育阶段的不同而呈现特异性变化.本研究通过土壤盆栽试验,研究不同浓度Cd持续胁迫对大豆不同发育阶段(幼苗期、花荚期、成熟期)生长及生理指标的影响,旨在探讨植物遭受 Cd胁迫的生理生态效应,以期为我国土壤-植物系统的Cd污染的治理以及农作物的安全生产提供科学依据.
1 材料与方法
1.1 供试材料
CdCl2·2.5H2O,分析纯,购于长沙市国营延风化学试剂厂;尿素与氯化钾,分析纯,购于国药集团化学试剂有限公司;磷酸二氢钾,分析纯,购于广东省台山市化工厂.
供试大豆(Glycine max)品种为“五月王”,由黑龙江省尚志市银河种苗有限公司提供.供试土壤采自湖南农业大学教学实验场,类型为第四纪红土发育的红壤.土壤基本性质为:pH 4.57、CEC 10.3cmol/kg、有机质15.6g/kg、全氮1.41g/kg、有效态镉 0.050mg/kg.
1.2 盆栽试验
土壤样品采回后经自然风干、锤碎、过5mm筛,按每kg土加0.10g N,0.15g P2O5,0.10g K2O计算,以尿素、磷酸二氢钾、氯化钾为肥源,溶于水后与含Cd溶液一起喷洒在土壤中拌匀后装盆(聚乙烯盆,直径40cm,深20cm),每盆装风干土15.0kg.外源 Cd添加量为0,0.25,0.50,1.00,2.50, 5.00,10.00mg/kg,以Cd添加量0mg/kg为对照.每处理重复3次.选取籽粒饱满的大豆种子以0.5%次氯酸钠溶液浸泡消毒30min,用去离子水冲洗干净后于2008年4月10日播于土壤中,每盆播种30粒,待大豆植株第2片真叶全部展开时,每盆保留27株苗(发芽最少的为27株/盆).根据土壤水分蒸发情况,不定期浇灌蒸馏水,以保持土壤持水量70%.
1.3 测定方法
分别在大豆幼苗期(播种后第27d)、花荚期(播种后第48d)、成熟期(播种后第76d)取大豆植株顶端第3和4片完全展开的叶片测定生理生化指标.测定大豆整株生物量(鲜重,g/株)和植株高度(大豆植株茎的基部至顶芽的高度,cm).大豆植株SOD活性用南京建成生物工程研究所的SOD试剂盒测定,以每mL反应液 SOD抑制率达到50%时所对应的SOD量为一个 SOD活力单位(U),单位用 U/g 表示;POD活性用愈创木酚法测定,酶活性以每min内吸光度A470变化 0.01为一个酶活性单位,单位用 U/(min·g)表示;MDA含量用TBA(硫代巴比妥酸)法测定,单位为μmol/g;叶绿素含量用 95%酒精浸提研磨,于分光光度计比色测定,计算总叶绿素含量,单位为mg/g[9].
1.4 数据处理
实验数据用统计学方法处理.结果用“平均值±标准差”表示;统计及回归分析用Excel2003、DPS v6.55和SPSS 13.0进行.
2 结果与分析
2.1 Cd胁迫下大豆不同生长期生长特征
Cd胁迫下,大豆植株不同发育阶段的生物量和株高的生长状况如图1所示.在低浓度Cd(≤0.50mg/kg)条件下,Cd胁迫对大豆植株不同生长期的生物量和植株高度均具有一定的“刺激效应”(即与对照相比,相应的生长生理指标有所增加),且刺激效应呈现幼苗期<花荚期<成熟期的规律.显然,大豆对低浓度 Cd具有一定的耐受性.但随着Cd浓度的增加,大豆植株生物量和高度受到明显抑制,Cd浓度越高其抑制效应(即与对照相比,相应的生长生理指标有所下降)越明显,并且有着成熟期>花荚期>幼苗期的规律.即,随着大豆的生长发育,高浓度Cd(≥1.00mg/kg)胁迫对大豆植株生物量和株高增长的抑制效应逐渐增强.对外源Cd浓度与大豆植株生物量、株高进行回归分析发现(图1),虽然在Cd低浓度区间内大豆植株生物量和株高出现先增加后降低的变化,但是在整个Cd胁迫浓度区间内大豆植株生物量和株高呈现随着Cd浓度增加而显著线性下降的趋势,表明大豆不同生长期植株高度和生物量的变化对土壤Cd污染水平具有一定的指示作用.大豆株高与Cd浓度回归方程的斜率绝对值大于大豆生物量与Cd浓度回归方程的斜率绝对值,表明大豆株高变化对 Cd胁迫的敏感性明显高于生物量的敏感性.

图1 Cd胁迫下大豆不同发育阶段植株生物量与高度Fig.1 Biomass and height of soybean plants at different growth stages under Cd stress
2.2 Cd胁迫下大豆不同生长期SOD活性特征
超氧化物歧化酶(SOD)是生物机体防御过氧化损伤系统的关键酶之一,是一类敏感的分子生态毒理学指标[10].从图2可知,在 Cd浓度≤0.50mg/kg时,大豆植株各生长期的SOD活性虽有所增加,但增加幅度不大;当Cd浓度>0.50mg/kg时,大豆不同生长期SOD活性随Cd浓度的增加变化呈现不同的变化趋势.在幼苗期,大豆SOD活性随Cd浓度的增加呈现显著的指数型关系平缓下降.当大豆生长至花荚期,SOD活性随Cd浓度的增加呈明显的S型逻辑斯蒂增长.在成熟期,大豆SOD活性又随Cd浓度的增加呈显著的指数函数下降.

图2 Cd胁迫下大豆不同发育阶段SOD活性特征Fig.2 SOD activities of soybean plants at different growth stages under Cd stress
2.3 Cd胁迫下大豆不同生长期POD活性特征
过氧化物酶(POD)是植物体内重要的保护酶,在逆境胁迫中被激活的程度最大,持续时间长,在有效地清除代谢过程中产生的活性氧的过程中起着关键作用[11].由图3可见,外源Cd浓度一定时,大豆POD的活性呈现幼苗期<花荚期<成熟期的规律.在幼苗期,大豆POD活性随外源Cd浓度的增加而呈现典型的S型逻辑斯谛增长趋势;在花荚期,大豆POD活性虽然在低浓度外源Cd胁迫时低于对照值,但整体上随外源Cd浓度的增加呈显著的线性增长趋势;在成熟期,大豆POD活性随外源Cd浓度的增加而先增加后降低,二者表现为较明显的双曲线函数关系.从回归方程可知(图3),幼苗期和成熟期大豆POD活性随着外源Cd浓度的增加存在一个极值,且成熟期的极值大于幼苗期的极值.这表明幼苗期和成熟期大豆通过POD活性的增加来减缓Cd胁迫的毒性是有限的,且大豆成熟期对Cd的耐受力大于幼苗期的耐受力.大豆花荚期正处于生长发育的旺期,可以通过POD活性的急剧增加(Cd浓度每增加一个单位,POD活性增加约29倍)来缓解Cd的植物毒性.

图3 Cd 胁迫下大豆不同发育阶段POD活性特征Fig.3 POD activities of soybean plants at different growth stages under Cd stress
2.4 Cd胁迫下大豆不同生长期叶绿素含量特征
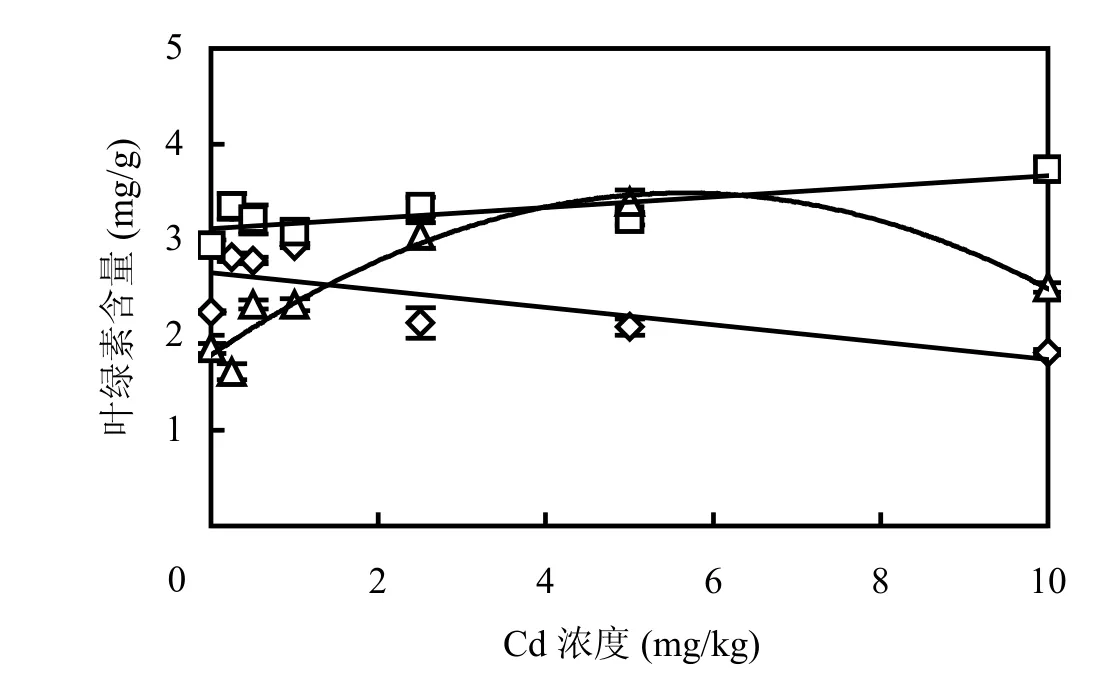
图4 Cd 胁迫下大豆不同发育阶段叶绿素含量变化特征Fig.4 Chlorophyll contents of soybean plants at different growth stages under Cd stress
叶绿素是光合作用的重要物质,其含量的高低在很大程度上反映了植物的生长状况和叶片的光合能力[12].从图4可以看出,在大豆不同生长期Cd胁迫对叶绿素含量的影响明显不同.在幼苗期,大豆植株脆弱,生长缓慢,容易受到Cd胁迫伤害,叶绿素含量随着Cd胁迫浓度的增加而成直线型降低.在花荚期,大豆叶绿素含量随Cd胁迫浓度的增加而呈现线性缓慢升高趋势,并且整体上高于幼苗期和成熟期叶绿素含量.其原因很可能是,花荚期大豆正处于生长旺盛期,植株整体生理功能增强,叶绿素含量随着大豆植株的强劲生长而增加,掩饰了Cd胁迫对叶绿素的影响.在大豆成熟期,叶绿素含量随Cd处理浓度的增加先增加后降低,二者呈显著的二项式函数关系,这是因为成熟期大豆植株生长缓慢,又受 Cd胁迫时间过长,最终由于Cd的毒害导致叶绿素含量下降.
2.5 Cd胁迫下大豆不同生长期MDA含量特征

图5 Cd 胁迫下大豆不同发育阶段MDA含量变化特征Fig.5 MDA contents of soybean plants at different growth stages under Cd stress
丙二醛(MDA)是植物膜脂过氧化的主要产物,其含量直接反映膜脂过氧化程度[13].图5表明,在外源Cd胁迫下,大豆植株MDA含量随Cd浓度的增加在幼苗期和花荚期呈现先增加后降低趋势,在成熟期呈现缓慢下降趋势.当外源Cd浓度一定时,大豆MDA的含量在整体上呈现幼苗期<成熟期<花荚期的规律,表明Cd胁迫对大豆植株不同生长期造成的膜脂过氧化强度为:幼苗期<成熟期<花荚期.对于大豆植株的幼苗期、花荚期、成熟期,MDA含量最大值对应的外源Cd胁迫浓度分别为5.00,2.50,1.00mg/kg,这表明引起植株的膜脂过氧化伤害最严重的Cd浓度随着大豆的生长发育而显著降低,大豆植株耐受Cd毒性的能力随着大豆的生长发育而显著降低.
3 讨论
通常情况下,随着重金属浓度的增加,植物生理指标的变化表现为叶片叶绿素含量逐渐降低,叶片和根系中SOD、POD活性先升高后降低,而MDA含量则逐渐升高,与重金属添加浓度具有很好的正的相关性,植物叶片和根系中MAD含量的变化可以在一定程度上反映土壤重金属的污染水平[14-18].
植物在重金属污染环境中生长,随着重金属浓度的增加可能出现中毒直至死亡,植物的叶绿素含量、SOD和POD活性、MDA含量等生理指标的协调性变化应该反映这个过程.本研究发现,Cd胁迫对大豆植株的生理生态效应随着大豆生长发育的不同呈现不同的特点.在幼苗期,在Cd胁迫下,大豆植株生物量和株高生长性状上表现出低浓度(≤0.50mg/kg)的刺激效应和高浓度(≥1.00mg/kg)的抑制效应;随着Cd胁迫浓度的增加,大豆POD活性迅速增加并维持在较高水平,叶绿素含量和SOD活性呈下降趋势,植株MDA含量先增加后降低.在花荚期,大豆植株的生长性状(株高和生物量)对Cd胁迫也表现为低浓度的刺激效应和高浓度的抑制效应,且这2种效应的强度均明显高于幼苗期大豆.随着Cd胁迫浓度的增加,大豆植株部分叶片出现黄化现象,SOD、POD活性及叶绿素含量呈上升趋势,MDA含量呈抛物线状先上升后下降.在成熟期,部分大豆植株叶片出现黄化现象,高浓度Cd胁迫下,大豆植株叶片严重皱缩,且整个植株的脆性增大容易折断,株高增长极为缓慢.在这期间,大豆植株的叶绿素含量、SOD活性、POD活性、MDA含量随着Cd胁迫浓度的增加均呈现先上升后下降趋势.这表明,在长时间、高浓度的Cd胁迫下,大豆植株的生理机能显著降低,自身保护性酶防御系统受损,最终在植株的生物量和株高等表观性状上表现出来.上述试验现象和分析表明,在中低浓度的Cd胁迫下,大豆植株通过SOD和POD活性的调节以共同防御Cd胁迫对大豆的毒性,大豆植株基本上能够正常发育直至成熟;但随Cd胁迫浓度的增加,大豆植株体内保护性酶对自由基的产生和消除的平衡作用失调,MDA含量增加,导致大豆细胞膜脂过氧化伤害,Cd毒性对大豆植株生物量和高度等表观性状的抑制效应越来越强烈,最终出现大豆叶片严重皱缩、脆性增大、生长几乎停滞并濒临死亡.

表1 Cd胁迫下大豆生长指标与生理指标的相关性Table 1 Correlations between growth indexes and physiological indexes of soybean plants at different growth stages under Cd stress
对Cd胁迫下大豆的生长指标(株高、生物量)与生理指标进行相关性分析发现(表1),幼苗期生长指标与植株的叶绿素含量、POD活性表现为显著相关,与SOD活性表现为极显著相关,这表明在 Cd胁迫初期大豆的生长指标与生理指标之间存在着相当好的协调性,生理指标能够较好的反映大豆的生长状况.但是在花荚期和成熟期,大豆的株高和生物量与植株的叶绿素含量和POD活性之间不存在相关性,仅仅与
SOD活性存在显著的相关性.这表明,Cd胁迫对大豆植株的生理生态效应是一个综合效应,而且与大豆的生长期和Cd胁迫时间有关.在本研究中,监测了大豆的叶绿素含量、POD活性、SOD活性和MDA含量等4个生理指标,其中MDA含量与大豆生长指标之间无论在哪个生长期都没有相关性,而SOD活性在大豆的整个生长期都与生长指标显著或极显著相关,但是在幼苗期和成熟期是正相关,而在花荚期是负相关.Cd胁迫下大豆生长指标与生理指标之间的关系还需要进一步探讨.
4 结论
4.1 Cd胁迫对大豆植株的生长在幼苗期、花荚期、成熟期均表现为低浓度下的刺激效应和高浓度下的抑制效应;但是随着Cd胁迫浓度的增加,大豆的生长整体上受到抑制.
4.2 Cd胁迫对大豆植株的生理生态效应随着大豆的生长发育呈现各自不同的特征.在幼苗期,大豆植株的叶绿素含量下降,SOD活性受到抑制,POD活性则迅速激活,共同缓解Cd毒性;在花荚期,大豆植株的防御系统得到有效激发,保护性酶POD、SOD的活性急剧升高,叶绿素含量呈上升趋势;在成熟期,由于长时间的Cd毒害,尤其是Cd浓度较高的情况下,大豆植株的SOD、POD活性和叶绿素含量急剧下降.
4.3 大豆植株幼苗期、花荚期、成熟期的生理指标(叶绿素含量、POD活性、SOD活性和MDA 含量)随着Cd胁迫浓度的增加有着完全不同的变化模式.
[1]徐明岗,纳明亮,张建新,等.红壤中Cu、Zn、Pb污染多蔬菜根伸长的抑制效应 [J]. 中国环境科学, 2008,28(2):153-157.
[2]刘广深,许中坚,周根娣,等.模拟酸雨作用下红壤镉释放的研究[J]. 中国环境科学, 2004,24(4):419-423.
[3]崔玉静,赵中秋,刘文菊,等.镉在土壤-植物-人体系统中迁移积累及其影响因子 [J]. 生态学报, 2003,23(10):2133-2143.
[4]李静,俞天明,周洁,等.铅锌矿区及周边土壤铅、锌、镉、铜的污染健康风险评价 [J]. 环境科学, 2008,29(8):2327-2330.
[5]Robert S, Katarzyna R, Renata R, et al. Cadmium-induced changes in antioxidant enzymes in suspension culture of soybean cells [J]. Acta Biochimica Polonica, 2004, 51 (1): 219-222.
[6]Agrawal S B, Mishra S. Effects of supplemental ultraviolet-B and cadmium on growth, antioxidants and yield of Pisum sativum L[J]. Ecotoxicology and Environmental Safety, 2009,72(2):610-618.
[7]黄运湘,廖柏寒,肖浪涛,等.镉处理对大豆幼苗生长及激素含量的影响 [J]. 环境科学, 2006,27(7):1398-1401.
[8]刘 俊,廖柏寒,周 航,等.镉胁迫对大豆花荚期生理生态的影响 [J]. 生态环境学报, 2009,18(1):176-182.
[9]中国科学院上海植物生理研究所.现代植物生理学实验指南[M]. 北京:科学出版社, 1999.
[10]华 涛,周启星.Cd-Zn 对草鱼(Ctenopharyngodon idellus)的联合毒性及对肝脏超氧化歧化酶(SOD)活性的影响 [J]. 环境科学学报, 2009,29(3):600-606.
[11]马文丽,金小弟,王转花.镉处理对乌麦种子萌发幼苗生长及抗氧化酶的影响 [J]. 农业环境科学学报, 2004,23(1):55-59.
[12]陈健妙,郑青松,刘兆普,等.麻枫树(Jatropha curcas L)幼苗生长和光合作用对盐胁迫的响应 [J]. 生态学报, 2009,29(3):1356-1365.
[13]刘周莉,何兴元,陈 玮.镉胁迫对金银花生理生态特征的影响[J]. 应用生态学报, 2009,20(1):40-44.
[14]姚 广,高辉远,王未未,等.铅胁迫对玉米幼苗叶片光系统功能及光合作用的影响 [J]. 生态学报, 2009,29(3):1162-1169.
[15]Vievek D, Vivek P, Radhey S. Differential antioxidative responses to cadmium in roots and leaves of pea (Pisum sativum L.) [J].Journal of Experimental Botany, 2001,52(358):1101-1109.
[16]Claudia C, Laura D, Beat F, et al. Distribution of cadmium in leaves of Thlaspi caerulescens [J]. Journal of Experimental Botany, 2005, 56(412):765-775.
[17]王长友,王修林,孙百晔,等.Cu、Pb、Zn和Cd对东海原甲藻的生长毒性效应 [J]. 中国环境科学, 2008,28(3):264-268.
[18]段九菊,郭世荣,康云艳,等.外源亚精胺对盐胁迫下黄瓜(Cucumis sativus L.)叶绿体活性氧清除系统和结合态多胺含量的影响 [J]. 生态学报, 2009,29(2):653-659.
