富贵菜离体培养体系的建立
2009-11-29湖南农业大学东方科技学院湖南长沙410128
李 娈 (湖南农业大学东方科技学院,湖南 长沙 410128)
蒋道松,周朴华 (湖南农业大学生物科学技术学院,湖南 长沙 410128)
富贵菜离体培养体系的建立
李 娈 (湖南农业大学东方科技学院,湖南 长沙 410128)
蒋道松,周朴华 (湖南农业大学生物科学技术学院,湖南 长沙 410128)
富贵菜(Gynuradivaricata)离体培养研究结果表明,以幼叶为外植体,最适致密愈伤组织诱导培养基为改良MS + 6-BA 2.0 mg·L-1+ NAA 0.2 mg·L-1+ KT 0.4 mg·L-1+ 蔗糖3%,诱导率为95.9%;最适诱导增殖培养基为改良MS + 6-BA 3.0 mg·L-1+NAA 0.1 mg·L-1+ 蔗糖3.0%,分化率为88%,增殖系数12.60;最适生根培养基为1/2改良MS + NAA 0.3 mg·L-1+ 蔗糖3%,生根率为100%;经该途径诱导得到的植株,经炼苗后移栽成活率≥93%。
富贵菜(Gynuradivaricata);离体培养;植株再生
富贵菜(Gynuradivaricata)含有丰富的黄酮类化合物,作为一种保健蔬菜开发,市场前景广阔[1]。但目前富贵菜在国内的种植及推广有限,即南方种植比较多,北方极为少见,主要原因有2个方面,一是与富贵菜的生长环境要求有关,有资料记载富贵菜的生长适温为20~30 ℃,低于15 ℃茎叶生长缓慢,最低的耐受温度为3 ℃,-2 ℃以下时地上部分及地下茎冻死[2],二是由于富贵菜经常采收的植株不见开花,很少结籽;另有报道在广东南部珠江三角洲地区只开花不结籽[3,4]。这给富贵菜的种质资源保存和运输带来了一定的困难。随着人民生活水平的提高,对富贵菜的需求越来越大,但传统的人工扦插繁殖制约着富贵菜的大规模种植。
本研究旨在通过富贵菜再生体系的建立,探究在富贵菜组织培养过程中植物材料、培养基成分、植物生长调节剂以及培养条件诸因素之间的相互作用,最终寻找到一条繁殖系数高、周期短、不受季节限制的快繁途径,以适应工厂化生产的要求。
1 材料与方法
1.1 材料处理
供试材料引种自湖南株洲,9月上旬,取富贵菜叶片为外植体,先将材料用70%的酒精浸泡15 s,后置于0.1% HgCl2溶液中6 min,无菌水冲洗3~5次,切去叶片边缘,大小1 cm × 1 cm。分别接种于添加不同浓度2,4-D、NAA、6-BA,KT的改良MS中(浓度的蔗糖3%,琼脂0.7%,pH 5.8~6.0)。置于(25±2) ℃的恒温培养室中培养。光照强度:诱导愈伤时250~350 lx,后转入2 000~2 500 lx,光照时间14 h·d-1,培养室湿度保持在75~85%。
1.2 富贵菜愈伤组织的诱导
在以上提供的基本培养基上,进行4因素4水平L16(44)的正交试验设计,其因素和水平详见表1。每种处理5瓶,每瓶6个,重复3次,20 d后统计诱导率结果。
1.3 富贵菜愈伤组织的分化与增殖
将诱导的愈伤组织块接种于附加不同浓度配比的6-BA、NAA和蔗糖的改良MS培养基上进行培养,培养条件同上。选用3因素4水平L16(43)的正交试验设计,其中因素和水平详见表2。每种处理5瓶,每瓶6个,重复3次,20 d后调查分化率、增殖率以及生长情况。

表1 愈伤组织诱导供试因素及水平Table 1 Factors and levels for callus induction

表2 诱导供试因素及水平Table 2 Factors and levels for induction
1.4 不同激素浓度对富贵菜生根的影响
当芽高约1~2 cm时,单株切下,转接到附加不同浓度的NAA、IAA的1/2MS培养基中,12 d后观察生长情况,并统计生根率(生根率=生根的富贵菜数/接种富贵菜数)。每种处理5瓶,共重复2次。
1.5 富贵菜的炼苗与移栽
富贵菜在生根培养基上培养两周后,苗高5 cm左右。打开培养瓶盖,将培养瓶移至自然光下炼苗2~3 d。选取50株健壮植株,去根部培养基及褐化的老根,分株移栽至装有细砂的混合培养基质中,待苗生长健壮后,定植于大田,统计成活率。重复2次。
2 结果与分析
2.1 不同激素浓度组合对富贵菜愈伤组织诱导的影响
正交试验结果见表3。K值结果显示,最佳搭配为改良A3B2C3D3,即MS + 6-BA 2.0 mg·L-1+ 2,4-D 0.5 mg·L-1+ NAA 0.2 mg·L-1+ KT 0.4 mg·L-1,然而该组合并未出现在16组试验方案中。在16组实验方案中第9号方案MS + 6-BA 2.0 mg·L-1+ NAA 0.2 mg·L-1+ KT 0.4 mg·L-1愈伤组织诱导率为最高值95.9%(图1-1)。将第9号方案与最优水平进行比较,不论从愈伤诱导效果,还是激素浓度配比来看都比较接近。故选择改良MS + 6-BA 2.0 mg·L-1+ NAA 0.2 mg·L-1+ KT 0.4 mg·L-1为最佳培养基。
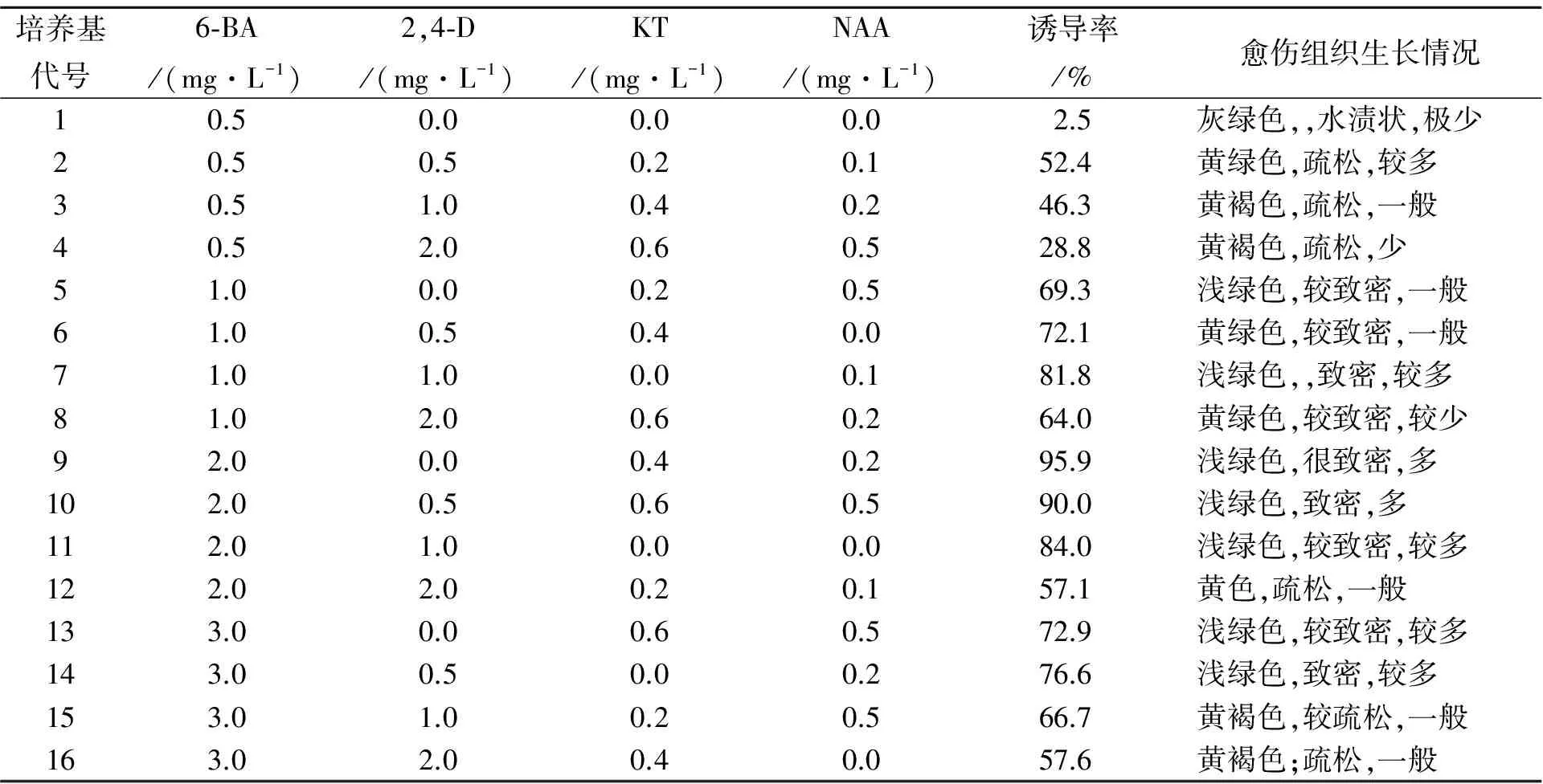
表3 愈伤组织诱导的试验L16(44)结果Table 3 The orthogonal test L16(44) results of callus induction

1.增殖后的致密愈伤组织;2.愈伤组织分化为不定芽;3、4.生根的试管苗;5.炼苗;6.移栽一个月后的试管苗图1 富贵菜离体培养结果Figure Resuts of in vitro culture of Gynura divaricata
2.2 不同激素浓度组合对富贵菜愈伤组织分化的影响
挑选出质地均一的愈伤组织,切成1.0 cm见方大小转接到含不同浓度激素的培养基中,1周后愈伤组织上开始出现绿色的小芽点,20 d后的统计结果见表4。

表4 愈伤组织分化的正交试验L16(43)结果Table 4 The orthogonal test L16(43) results of callus differentiation
由表4可知,K值显示的最佳诱导分化培养基组合为A3B2C3,即改良MS + 6-BA 3.0 mg·L-1+ NAA 0.2 mg·L-1+ 蔗糖3.0%。从表4还可知,在富贵菜愈伤组织的分化中,6-BA仍起着关键性的作用。单独使用6-BA很难分化出苗,仅使愈伤组织变绿、变硬 。高浓度(gt;4.0 mg·L-1)的6-BA抑制芽的生长,形成的芽矮小且颜色暗绿发黄;低浓度(lt;1.0 mg·L-1)的6-BA尽管在NAA、KT不同浓度的配合下也能使愈伤组织分化,但诱导低;适宜浓度(3.0 mg·L-1)的6-BA既可以保持较高的多芽数,又使芽健壮,叶片平展,叶色浓绿。
从因素NAA来看,浓度在0.1~1.0 mg·L-1的范围内,其诱导率变化不明显,但由于考虑到生长素对芽的生长有一定的抑制作用,故建议采用低浓度为宜。蔗糖浓度的大小对芽的分化也有较大的影响,太高或太低都不利于芽的分化,原因可能是由于渗透压的改变而造成的。在16组试验数据中,9号配方改良MS + 6-BA 3.0 mg·L-1+ NAA 0.1mg·L-1+蔗糖3.0%,诱导率和增殖系数都是最高的,且植株生长旺盛,很少出现褐化现象(图1-2),与正交实验结果的最佳分化组合基本吻合,因此,9号培养基可以视为富贵菜诱导分化、增殖最适培养基。
2.3 不同激素浓度对富贵菜生根的影响
不同培养基对富贵菜试管苗生根的影响试验结果见表5。由表5可见,激素IAA与NAA都能使富贵菜的试管苗生根。在只含有IAA的培养基中,随着IAA浓度的增大,生根率升高,生根条数增多,根相对较细,容易生成气生根。而在只含有NAA的培养基中,浓度为0.1~0.3 mg·L-1时,生根率均可以达到100%,植株长势旺盛;NAA浓度较高时,生根率降低,根系生长慢,且易对植物造成毒害。本试验中还发现,IAA、NAA配合使用,其生根率并不高,多气生根,植株矮小。因此最佳生根培养基为1/2 MS+NAA 0.3 mg·L-1+蔗糖3%(图1-3、图1-4)。

表5 不定根诱导试验结果Table 5 The experiment result of root induction
2.4 富贵菜的炼苗与移栽
当试管苗根长到3~5 cm时,炼苗2~3 d,将根系上的培养基洗净,植入腐殖土∶细沙=3∶1中,栽后用微喷法浇透水,使用塑料薄膜盖好,相对湿度保持在75%以上,开始时每天喷水1~2次,7 d后逐渐转入正常管理,成活率≥93%(图1-5、图1-6)。
3 小结与讨论
通过对富贵菜离体培养再生体系的建立,得到了最佳培养条件及最佳植物生长调节剂的配比,解决了该种种质资源的保存与繁殖问题,为富贵菜试管苗工厂化生产奠定了坚实可靠的基础。
本试验发现,在完全黑暗的条件下,愈伤组织很难分化成不定芽,而是直接生根。说明光对愈伤组织诱导起着直接的作用,影响器官的形成。光照越强,愈伤褐化程度越高,这可能与组培初代培养过程中植物内源激素水平、培养物多酚氧化酶(PPO)活性及总酚含量有着密切的关系[5]。
愈伤诱导试验中发现:(1)以叶片为外植体,添加6-BA有利于形成致密的愈伤组织,且在一定范围内随浓度的加大而诱导率升高(因为6-BA解除了腋芽由生长素所引起的顶端优势,促进其产生新的芽点或愈伤组织);而添加2,4-D虽能诱导疏松愈伤组织,却对致密愈伤组织的形成有较强的抑制作用。(2)6-BA与较低浓度的KT、NAA配合使用,可得到质量好、诱导率高、适宜分化的致密愈伤组织。
不定芽诱导试验中发现:(1)6-BA的浓度变化对富贵菜致密愈伤组织诱导分化形成不定芽的影响最为显著。一定范围内,浓度越高,诱导率越大,但高浓度的6-BA则明显抑制芽的分化;比较而言,分化培养基中细胞分裂素的浓度高于诱导培养基的,有利于芽的产生。(2)3%蔗糖浓度有利于富贵菜诱导、分化;浓度过低,愈伤组织相对疏松,不易形成芽点;浓度过高,易使愈伤组织褐化,出现衰老。
生根试验中发现,将无菌苗插入土壤基质比无激素的培养基中高,这可能与栽培物质的透气性有关,并且说明该植株体内,内源激素特别是生长素水平较高。因此在离体培养生根中,需借助于一些外源激素生长素类物质如NAA、IAA等。其中NAA更利于富贵菜无菌苗菜的生根。适宜浓度NAA诱导,根粗而长,植株生长旺盛;虽然IAA同样能诱导生根,但根细而短,多气生根;同时使用两种激素诱导生根效果不佳,原因还需进一步探讨。
[1]陈德春,刘红昌,杨文钰.四川地区富贵菜栽培技术[J].长江蔬菜,2005,(1):19~20.
[2]郑 华,叶定池,许方程.富贵菜人工栽培技术[J].中国蔬菜,2004,(4):54~55.
[3]贺东方.富贵菜高产优质栽培技术[J].长江蔬菜,2003,(11):29~33.
[4]赵世乐,童小荣.富贵菜及其栽培[J].特种经济动植物,2002,(6):36~39.
[5]杨 博,韩振海,张 永,等.不同光照强度对玫瑰组织培养中初代培养物褐化的影响[J].中国农学通报,2003,19(6):194~196.
Q813.1
A
1673-1409(2009)02-S056-05
10.3969/j.issn.1673-1409(S).2009.02.016
2009-06-08
李 娈 (1981-),女(苗族), 湖南沅陵人,理学硕士,助教, 研究方向为细胞工程与资源植物学.
蒋道松,E-mail:roadpine@163.com.
