帕金森病病人血清25-羟维生素D、Hcy水平与运动、非运动症状的相关性分析
2024-04-30黄琦沈慧李文俞娟
黄琦 沈慧 李文 俞娟
摘要 目的:分析帕金森病(PD)病人血清25-羟维生素D[25-(OH)D]、同型半胱氨酸(Hcy)水平与运动及非运动症状的相关性。方法:选取2020年4月—2023年3月我院收治的110例PD病人作为病例组,选取同期健康对照者50名作为对照组。采集两组外周血样本,检测血清25-(OH)D、Hcy水平,采用PD评定量表(UPDRS)第Ⅲ部分及Hoehn-Yahr分期评估病人运动症状;分别采用汉密尔顿焦虑量表(HAMA-14)、汉密尔顿抑郁量表(HAMD-17)、简易智能精神状态检查量表(MMSE)、匹兹堡睡眠质量指数(PSQI)、PD非运动症状量表(NMSS)22~24项及NMSS总分评估PD病人焦虑、抑郁、认知功能障碍、失眠、泌尿功能障碍及非运动症状严重程度;根据Hoehn-Yahr分期将病人分为轻度组、中度组、重度组,根据HAMA-14、HAMD-17、MMSE、PSQI、NMSS 22~24项评分将PD病人分为焦虑组与非焦虑组、抑郁组与非抑郁组、认知功能障碍组与非认知功能障碍组、失眠组与非失眠组、泌尿功能障碍组与非泌尿功能障碍组,分别比较病例组与对照组、病例组不同亚组病人血清25-(OH)D、Hcy水平,采用Pearson法分析血清25-(OH)D、Hcy水平与各量表评分之间的相关性。结果:病例组血清25-(OH)D水平低于对照组(P<0.05),Hcy水平高于对照组(P<0.05);PD轻度组、中度组、重度组血清25-(OH)D水平依次下降,Hcy水平依次升高(P<0.05);焦虑组、抑郁组、认知功能障碍组、失眠组、泌尿功能障碍组血清25-(OH)D水平分别低于相对应的非焦虑组、非抑郁组、非认知功能障碍组、非失眠组、非泌尿功能障碍组(P<0.05);焦虑组、认知功能障碍组血清Hcy水平分别高于相对应的非焦虑组、非认知功能障碍组(P<0.05)。Pearson相关性分析结果显示,PD病人血清25-(OH)D水平与UPDRS第Ⅲ部分、HAMA-14、HAMD-17、MMSE、PSQI、NMSS 22~24项评分及NMSS总分均呈负相关(P<0.05),与MMSE评分呈正相关(P<0.05);Hcy水平与UPDRS第Ⅲ部分、HAMA-14呈正相关(P<0.05),与MMSE评分呈负相关(P<0.05)。结论:PD病人血清25-(OH)D水平与运动症状及焦虑、抑郁、认知功能障碍、失眠、泌尿功能障碍等非运动症状均有关,Hcy与病人运动症状及焦虑、认知功能障碍症状相关。
关键词 帕金森病;25-羟维生素D;同型半胱氨酸;运动症状;非运动症状
doi:10.12102/j.issn.1672-1349.2024.05.033
基金项目 2018年度上海交通大学医学院苏州九龙医院培育科研项目(No.JL201811)
作者单位 上海交通大学医学院苏州九龙医院(江苏苏州 215028)
通讯作者 俞娟,E-mail:28241921@qq.com
引用信息 黄琦,沈慧,李文,等.帕金森病病人血清25-羟维生素D、Hcy水平与运动、非运动症状的相关性分析[J].中西医结合心脑血管病杂志,2024,22(5):938-941.
帕金森病(PD)是一种以震颤、刚直、运动迟缓和平衡障碍等运动症状为主的神经退行性疾病[1]。有研究显示,PD病人存在大量非运动症状,包括心理、神经行为、自主神经、感觉和睡眠障碍等,对生活质量的影响甚至超过运动症状[2]。相关研究显示,PD病人血清某些生化指标异常,如25-羟维生素D[25-(OH)D]和同型半胱氨酸(Hcy),25-(OH)D是反映体内维生素D水平的最佳血清标志物,PD病人血清25-(OH)D水平普遍偏低[3-4]。另有研究发现,低血清25-(OH)D水平与PD运动症状,非运动症状,如焦虑、抑郁、睡眠障碍等严重程度有关[5]。现有研究结果尚未明确,仍需进一步探讨。Hcy是一种含硫氨基酸,人体血浆Hcy水平受到营养和遗传因素的影响,相关研究显示,高水平Hcy与神经退行性疾病,包括阿尔茨海默病、PD等发病风险增加有关[6]。然而Hcy与PD的非运动症状,如焦虑、抑郁、认知功能障碍等关联、相关机制尚未明确。本研究旨在探讨PD病人血清25-(OH)D、Hcy水平与运动、非运动症状的相关性,以期为PD的防治提供新的理论依据和临床指导。
1 资料与方法
1.1 研究对象
选取2020年4月—2023年3月我院110例PD病人作为病例组。纳入标准:年龄>40岁;符合原发性PD诊断标准[7],PD症状持续时间>2年;病人知情同意且自愿配合相关检查。排除标准:合并其他神经系统疾病或严重心脑血管疾病;合并震颤性疾病、肌阵挛等其他运动障碍疾病;患有阿尔茨海默病、精神分裂症等其他精神疾病;孕期或哺乳期女性。另选取同时期健康体检者50名作为对照组,纳入标准:年龄>40岁;无神经系统疾病或严重心脑血管疾病;所有研究对象均知情同意且自愿配合相关检查。病例组,男62例,女48例;年龄42~78(64.51±10.94)岁;受教育年限7~15(10.17±3.02)年;Hoehn-Yahr分期1~2期(轻度)38例,2.5~3期(中度)34例,4~5期(重度)36例。对照组,男27名,女23名;年龄41~79(61.78±8.42)岁;受教育年限8~14(11.02±3.73)年。两组性别、年龄、受教育年限比较,差异均无统计学意义(P>0.05)。本研究经过医院伦理委员会批准。
1.2 评估工具
1)运动症状:采用PD评定量表(UPDRS)[8]第Ⅲ部分,由专业医师根据病人面部表情、颤抖、僵硬、姿势稳定性等身体表现进行评估,根据症状严重程度评分,0~4分,0分表示无症状,4分表示症状最严重。2)焦虑:采用汉密尔顿焦虑量表(HAMA-14)[9]对焦虑症状进行评估,量表包括14个项目,每个项目0~4分,总分56分,分值越高提示焦虑症状越严重,评分≥14分判定为焦虑,纳入焦虑组,其余纳入非焦虑组。3)抑郁:采用汉密尔顿抑郁量表(HAMA-17)[10]进行评估,量表包含17个项目,总分为52分,分值越高提示抑郁症状越严重,评分≥17分判定为抑郁,纳入抑郁组,其余纳入非抑郁组。4)认知功能障碍:采用简易智能精神状态检查量表(MMSE)[11]評估,从注意力、记忆、定向力、计算能力等方面评价认知功能,总分30分,分值越低提示认知功能障碍越严重。受教育年限1~6年且MMSE评分≤20分,受教育年限7~9年且MMSE评分≤24分,或受教育年限≥10年且MMSE评分<26岁判定为认知功能障碍,纳入认知功能障碍组,其余纳入非认知功能障碍组。5)失眠:采用匹兹堡睡眠质量指数(PSQI)[12]评估睡眠质量,包括3个项目,总分21分,分值越高提示睡眠质量越差,评分>7分判定为失眠,纳入失眠组,其余纳入非失眠组。6)泌尿功能障碍:采用PD非运动症状量表(NMSS)[13]评估病人的非运动症状,其中项目22~24评估泌尿功能障碍,评分>0分判定为存在泌尿功能障碍,纳入泌尿功能障碍组,其余纳入非泌尿功能障碍组。主观评分由两名研究者独立进行,取平均值。
1.3 指标检测方法
采集两组研究对象空腹外周静脉血,离心、分离血清,采用酶联免疫吸附法测定血清25-(OH)D、Hcy水平。
1.4 观察指标
分别比较病例组与对照组、病例组不同亚组病人血清25-(OH)D、Hcy水平,分析血清25-(OH)D、Hcy水平与各量表评分之间的相关性。
1.5 统计学处理
采用SPSS 22.0统计软件进行数据分析。符合正态分布的定量资料以均数±标准差(x±s)表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析;定性资料以例数、百分比(%)表示,采用χ2检验。采用Pearson相关系数进行相关性分析。以P<0.05为差异有统计学意义。
2 结 果
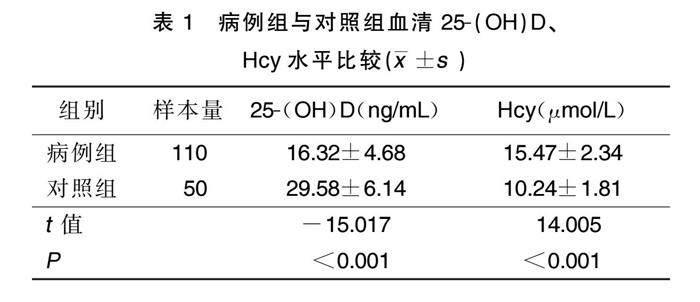
2.1 病例组与对照组血清25-(OH)D、Hcy水平比较
病例组血清25-(OH)D水平低于对照组(P<0.05),Hcy水平高于对照组(P<0.001)。详见表1。
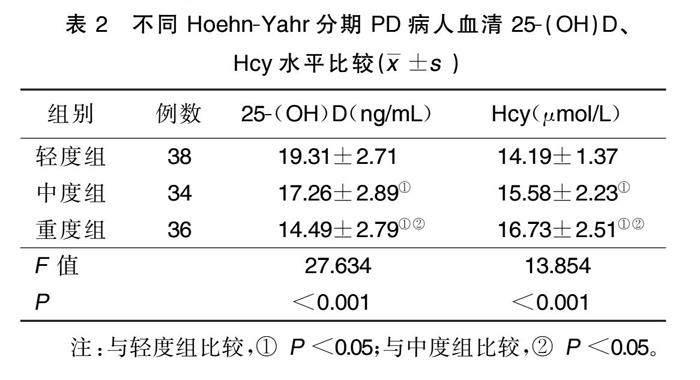
2.2 不同Hoehn-Yahr分期PD病人血清25-(OH)D、Hcy水平比较
PD轻度组、中度组、重度组血清25-(OH)D水平依次下降,Hcy水平依次升高(P<0.05)。详见表2。
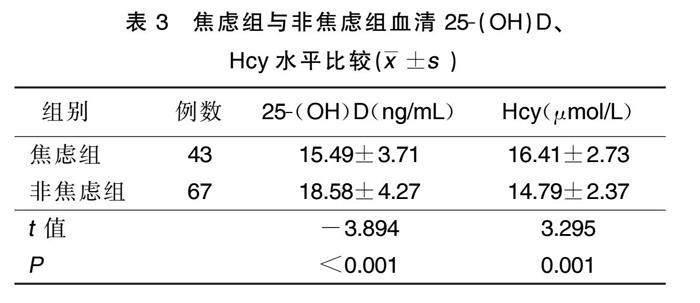
2.3 焦虑组与非焦虑组血清25-(OH)D、Hcy水平比较
焦虑组血清25-(OH)D水平低于非焦虑组(P<0.05),Hcy水平高于非焦虑组(P<0.05)。详见表3。
2.4 抑郁组与非抑郁组血清25-(OH)D、Hcy水平比较
抑郁组血清25-(OH)D水平低于非抑郁组(P<0.001);两组Hcy水平比较,差异无统计学意义(P>0.05)。详见表4。
2.5 认知功能障碍组与非认知功能障碍组血清25-(OH)D、Hcy水平比较
认知功能障碍组血清25-(OH)D水平低于非认知功能障碍组(P<0.001),Hcy水平高于非认知功能障碍组(P<0.001)。详见表5。
2.6 失眠组与非失眠组血清25-(OH)D、Hcy水平比较
失眠组血清25-(OH)D水平低于非失眠组(P<0.001);两组Hcy水平比较,差异无统计学意义(P>0.05)。详见表6。
2.7 泌尿功能障碍组与非泌尿功能障碍组血清25-(OH)D、Hcy水平比较
泌尿功能障碍组血清25-(OH)D水平低于非泌尿功能障碍组(P<0.001);两组Hcy水平比较,差异无统计学意义(P>0.05)。详见表7。
2.8 PD病人血清25-(OH)D、Hcy水平与各量表评分的相关性
Pearson相关性分析显示,PD病人血清25-(OH)D水平与UPDRS第Ⅲ部分、HAMA-14、HAMD-17、MMSE、PSQI、NMSS 22~24项评分及NMSS总分均呈负相关(P<0.05),与MMSE评分呈正相关(P<0.05);Hcy水平与UPDRS第Ⅲ部分、HAMA-14评分呈正相关(P<0.05),与MMSE评分呈负相关(P<0.05)。详见表8。
3 討 论
PD是一种以运动症状为主的神经退行性疾病,但非运动症状,如心理、神经行为、自主神经、感觉和睡眠障碍等给病人生活质量造成严重影响。近年来,PD的病因研究已由单纯的神经损伤逐渐扩展到全身多系统改变,包括神经内分泌和代谢紊乱[14]。有研究显示,PD病人体内25-(OH)D、Hcy水平异常变化[15],但二者与PD病人运动及非运动症状之间的关系目前尚未明确。
本研究结果显示,血清25-(OH)D水平与PD运动和非运动症状呈负相关,Hcy水平与运动症状、焦虑、认知功能障碍呈正相关。提示随着血清25-(OH)D水平下降和Hcy水平上升,PD病人病情可能严重,具有复杂的临床表现。25-(OH)D与PD的关系引起了广泛关注,本研究发现病例组血清25-(OH)D水平低于对照组,与既往研究结果[16]一致。25-(OH)D不仅是钙磷代谢的重要调控因子,同时在神经系统中发挥着重要的生理功能,如神经细胞的生长、分化、突触塑性、神经递质的合成和释放等。本研究结果显示,PD病人血清25-(OH)D水平与运动症状(UPDRS第Ⅲ部分评分)、焦虑、抑郁、认知功能障碍、失眠和泌尿功能障碍等非运动症状呈负相关,提示25-(OH)D水平下降可能与PD病情加重有关,分析可能机制是25-(OH)D具有神经保护效应,可抑制神经炎症,保护神经元,维持神经递质平衡,从而改善神经功能。25-(OH)D可穿过血脑屏障,直接作用于脑内维生素D受体,影响神经功能和行为。维生素D受体在人体各种组织中广泛分布,尤其在大脑多个区域,如前额叶、海马、杏仁核等,这些区域在情绪调控、记忆、学习、睡眠等神经行为功能中发挥重要作用[17]。因此,25-(OH)D水平下降可能导致PD病人非运动症状,如焦虑、抑郁、认知功能障碍、失眠、泌尿功能障碍等症状加重。
关于Hcy与PD的关系,本研究结果显示,PD病人血清Hcy水平与运动症状呈正相关,可能原因是Hcy是神经毒性物质,过量的Hcy可能引发氧化应激、炎症反应,破坏神经髓鞘,损伤神经元,从而导致神经功能障碍,表现为运动症状加重。Hcy升高可能与多巴胺等神经递质的合成和代谢异常有关,PD是由于黑质多巴胺能神经元损失引起的,若Hcy影响了多巴胺代谢,可能加剧PD运动症状。本研究结果显示,PD病人焦虑症状与血清Hcy水平呈正相关。Hcy通过影响神经递质代谢和神经炎症反应,影响大脑情绪调控中心,如杏仁核和前额叶,从而影响情绪和行为的表现,Hcy还可能影响神经递质(如5-羟色胺)分布,5-羟色胺在调控情绪,特别是焦虑中发挥着关键作用[18]。PD病人血清Hcy水平与认知功能存在一定相关性,可能机制是高水平Hcy通过破坏神经髓鞘、引发神经炎症和氧化应激,损伤海马和前额叶等认知功能相关的脑区,导致记忆和认知能力下降,其通过影响多巴胺和5-羟色胺等神经递质合成和代谢,影响病人认知功能,尤其是工作记忆和注意力的调控。
综上所述,PD病人血清25-(OH)D、Hcy水平与运动症状和非运动症状有关,这两项生化指标可一定程度反映病人运动症状和非运动症状的病情严重程度和症状复杂性,且临床检测简单、快捷,可为PD诊断、治疗选择和预后评估提供新思路。
参考文献:
[1] 刘春风,毛成洁.帕金森病非运动症状的识别与处理[J].中华神经科杂志,2021,54(10):1071-1082.
[2] 宋晓贇,杨改清,徐志强,等.血清25-羟维生素D3水平与帕金森病患者脑小血管病的相关性[J].新乡医学院学报,2023,40(1):29-34.
[3] 黄艳玲,廖渝,郑永玲,等.25-羟维生素D缺乏与帕金森病患者睡眠质量、认知功能及ACTH水平的关系[J].临床和实验医学杂志,2023,22(4):357-360.
[4] 张永志,刘义晗,王文婷,等.帕金森病患者自主神经功能障碍的影响因素分析[J].临床内科杂志,2022,39(6):386-390.
[5] 骆图南,余小骊.老年帕金森病患者血浆Hcy、25-(OH)-D、叶酸水平检测及其与认知功能的关系[J].南昌大学学报(医学版),2021,61(6):36-39;45.
[6] 张家和,柯开富,施建生,等.血尿酸、CysC及Hcy与老年帕金森病患者病程及疾病严重程度相关性分析[J].中国医药导报,2022,19(5):82-85.
[7] 陈永平,商慧芳.2016中国帕金森病诊断标准解读[J].中国实用内科杂志,2017,37(2):124-126.
[8] GOETZ C G,STEBBINS G T,CHMURA T A,et al.Teaching program for the Movement Disorder Society-sponsored revision of the Unified Parkinson′s Disease Rating Scale(MDS-UPDRS)[J].Movement Disorders,2010,25(9):1190-1194.
[9] THOMPSON E.Hamilton rating scale for anxiety(HAM-a)[J].Occupational Medicine,2015,65(7):601.
[10] TILLER J W G.Depression and anxiety[J].The Medical Journal of Australia,2013,199(S6):S28-S31.
[11] 周小炫,謝敏,陶静,等.简易智能精神状态检查量表的研究和应用[J].中国康复医学杂志,2016,31(6):694-696;706.
[12] FARAH N M,SAW YEE T,MOHD RASDI H F.Self-reported sleep quality using the Malay version of the Pittsburgh sleep quality index(PSQI-M) in Malaysian adults[J].International Journal of Environmental Research and Public Health,2019,16(23):4750.
[13] CHAUDHURI K R,MARTINEZ-MARTIN P,BROWN R G,et al.The metric properties of a novel non-motor symptoms scale for Parkinson′s disease:results from an international pilot study[J].Movement Disorders,2007,22(13):1901-1911.
[14] 刘慧磷,谭洁琼,王芳.脂质代谢紊乱与神经退行性疾病关系的研究进展[J].中南医学科学杂志,2022,50(1):149-152.
[15] 李变芳,韩奕勃,曲婧,等.原发性帕金森病患者血浆同型半胱氨酸水平分析[J].中国医科大学学报,2021,50(8):690-693;698.
[16] 袁冬娟,姜虹,王梁,等.帕金森病轻度认知功能障碍相关危险因素探讨[J].脑与神经疾病杂志,2022,30(12):747-752.
[17] 苏楠,郭雅聪,胡耀凯,等.帕金森病患者血清CysC、Hcy水平及其对伴发脑白质病变的评估作用[J].国际神经病学神经外科学杂志,2021,48(6):511-515.
[18] 张煜,董金霞,李青,等.老年帕金森病患者血清Aβ1-42、EGF和Hcy水平与认知功能障碍及疾病严重程度的关系及其预测价值分析[J].现代生物医学进展,2022,22(11):2186-2190.
(收稿日期:2023-07-05)
(本文编辑薛妮)
