长期施加钾肥对小麦产量、氮磷钾吸收量及根际土壤微生物多样性的影响
2024-04-08张翔黄媛媛宋聪贾振华贾良良宋水山
张翔 黄媛媛 宋聪 贾振华 贾良良 宋水山

摘要:为了研究长期施加钾肥对小麦产量、氮磷钾吸收量以及小麦根际土壤微生物多样性的影响,利用高通量测序技术,对河北省农林科学院辛集市马兰农场钾肥定位试验田的8个小麦根际土壤样品进行测序,得到2组样品的微生物群落组成信息,结合河北省农林科学院资源环境研究所提供的小麦产量和品质数据,进行相关性分析。结果表明,在NP组(不施加钾肥)优势细菌菌群集中在疣微菌门(Verrucomicrobia),优势真菌菌群集中在毛壳菌科(Chaetomiaceae)、锥盖伞属(Conocybe)以及被孢霉目 (Mortierellales)。而NPK组(施加钾肥)的优势细菌菌群集中在假诺卡氏菌科(Pseudonocardiaceae)、Terrimonas,优势真菌菌群集中在光柄菇科(Pluteaceae)、花褶伞属(Panaeolus)。在细菌属水平上,2组间差异较大的细菌菌属有15种,其中NP组显著增多的是Terrabacter、长绳菌属(Longilinea)、硝化螺旋菌属(Nitrospira)、狭义梭菌属(Clostridium sensu stricto)、Mangroviflexus、Rhizorhabdus、Tahibacter,而NPK组显著增多的是Methyloceanibacter、Terrimonas、德克斯氏菌属(Derxia)、伦茨氏菌属(Lentzea)、Chryseolinea、间孢囊菌属(Intrasporangium)、Maricaulis、纤维微杆菌属(Cellulosimicrobium)。在真菌属水平上,差异显著的只有NP组中较多的毛壳菌属(Chaetomium)和球腔菌属(Phaeosphaeria)。结合小麦产量和养分数据可以得出,钾肥可以提高小麦的产量和氮磷钾吸收量,而参与小麦吸收钾元素的菌群应该有Ohtaekwangia、Gp3、其他菌属和一些未知细菌菌属,以及毛球壳科的一个未知菌属(unclassified_Lasiosphaeriaceae)、未知真菌菌属(unclassified_Fungi)和地星科的一个未知菌属(unclassified_Geastraceae)等真菌菌属。
关键词:钾肥;小麦根际土壤;微生物多样性;高通量测序;冗余分析
中图分类号:S512.106 文獻标志码:A
文章编号:1002-1302(2024)03-0254-07
土壤是农业的根基,是农业生产重要的组成部分。土壤中的微生物更是参与了农作物生长发育的各个阶段[1]。土壤微生物主要包括真菌、细菌、古菌、病毒、原生动物以及藻类[2]。它们在土壤的碳循环、氮循环、硫循环以及有机质的分解和转化过程中扮演着重要的角色[3]。土壤微生物种类繁多、功能多样,是衡量土壤健康质量的重要指标[4]。在农业研究上,耕地土壤微生物已经受到了很多的关注,其中利用高通量二代测序技术了解土壤微生物多样性已经得到了广泛的应用[5]。该技术可以检测出土壤中的所有微生物的相对丰度,通过对土壤中所有微生物的相对丰度可以分析出耕地土壤中的微生物群落的组成情况,对耕地土壤的改良修复和肥料的施加提供科学的数据指导[6-7]。
小麦是重要的粮食作物,在我国有着广泛的种植[8-9]。在小麦生长发育过程中钾是必不可少的营养元素之一,参与了小麦体内各种生理生化过程[10]。在农业生产中施用钾肥是解决土壤中钾元素不足以及提高农作物产量和品质的重要途径[11]。研究表明,在氮磷肥的基础上施加不同量的钾肥均可以提高小麦的产量[12]。随着我国经济水平的提高、人口的增长,对粮食的需求也日趋提高[13]。我国已经成为世界主要的钾肥消费国[14]。所以,合理地利用钾肥既可以降低农业生产成本,又可以节省钾矿资源[15],对我国农业可持续发展有着重要的意义[16]。本研究利用高通量二代测序技术对河北省农林科学院马兰农场试验站的钾肥长期定位试验田的土壤微生物进行测序,分析研究土壤微生物与钾肥施加量和产量之间的关系,以期为小麦的科学施肥和耕地土壤修复改良提供科学依据。
1 材料与方法
1.1 试验概况
试验于2018年在河北省辛集市马兰村马兰农场进行,地处115.201°~115.206°E、37.995°~37.997°N,属暖温带半湿润季风大陆气候,海拔在25.0~37.8 m之间,年平均气温10~20 ℃,年平均降水量525.7 mm,年平均日照时数2 554.9 h。
马兰农场试验站钾肥定位试验由河北省农林科学院资源环境研究所设计,试验田从1992年开始小麦—玉米轮作,共5个处理,本次试验取其中2个处理作为试验对象,每个处理4次重复,小区面积为50 m2(0.075亩),秸秆全部清除。各处理同量施用氮磷肥,每季施N 225 kg/hm2、P2O 5 90 kg/hm2。施加钾肥的处理底肥施150 kghm2 K2O 。田间施肥情况见表1。
1.2 样品的采集
本次试验所用土壤样品及小麦样品均在2018年6月采集完成。
本研究所用土壤样品采用“5点采样法”采集,在每块地的4个角以及中间位置进行土壤样品的采集,然后进行混样。本研究所用土壤样品为小麦的根际土壤,根际土壤距离小麦根部最近,土壤菌群与小麦根部交流更频繁。采集时先将小麦根部的大块土壤抖掉,然后用软毛刷将附着在小麦根系表面的土壤刷到取样袋中。将所取土壤样品放入冰盒中带回实验室,存入-80 ℃冰箱中待测。
1.3 土壤微生物总DNA提取及PCR扩增
取500 mg土壤样品放入灭过菌的2 mL离心管中,然后用OMEGA公司的E.Z.N.ATM Mag-Bind Soil DNA Kit提取试剂盒对土壤样品进行DNA提取。土壤DNA提取后,利用引物341F(5′-CCTACGGGNGGCWGCAG-3′)和805R(5′-GACTACHVGGGTATCTAATCC-3′)对土壤中细菌16S rDNA的V3~V4区域进行扩增。同时,利用引物ITS1F(5′-CTTGGTCATTTAGAGGAAGTAA-3′)和ITS2R(5′-GCTGCGTTCTTCATCGATGC-3′)对土壤中真菌ITS区域的ITS1~ITS2区域进行扩增。
1.4 上机测序
将PCR产物送到生工生物工程(上海)股份有限公司高通量测序部,利用Illumina MiSeq高通量测序平台对样品进行测序。
1.5 数据处理
MiSeq测序序列中含有样本标签序列,以及测序时加入的引物和接头序列。首先需要去除引物接头序列,再根据测序序列之间的重叠关系,将成对的序列拼接成一条序列,然后按照样品标签序列识别并区分样品得到各样本数据,最后对各样本数据的质量进行质控过滤,得到各样本的有效数据[17]。
使用USEARCH去除预处理后序列中非扩增区域序列,而后对序列进行测序错误校正,并调用UCHIME进行鉴定嵌合体。随后再将去除嵌合体的序列与数据库代表性序列进行BLASTn比对,低于阈值的比对结果通常被认为是靶标区域外的序列,剔除掉该部分序列。
接下来,利用QIIME、UCLUST、USEARCH软件按照97%相似性将全部优质序列进行聚类,得到代表序列和操作分类单元(OTU)表。利用Mothur等软件进行稀释性曲线的绘制,利用QIIME等软件计算Chao1指数、observed species指数、goods coverage指数和Shannon指数。为了得到每个OTU的物种信息,采用RDP Classifier算法对每个OTU代表序列进行比对分析,并在各个水平注释群落物种信息。利用R语言绘制物种组成分析和主成分分析(PCA)的图表[18]。并根据各个样品的物种组成信息进行LEfSe分析。
1.6 关联性分析
利用冗余分析(RDA)法分析河北省农林科学院资源环境研究所提供的小麦相关数据与高通量数据的关联性,筛选出与钾肥关系密切的菌株。
2 结果与分析
2.1 测序结果分析
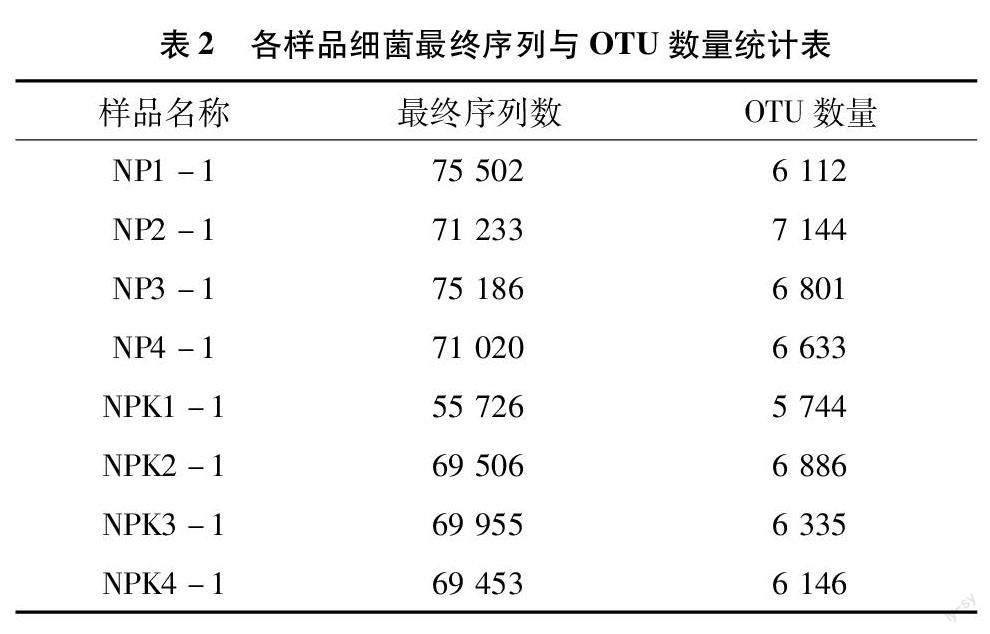
将8个样品的下机数据经过预处理、去除嵌合体后,剩下的优质序列为分析所用的最终序列[19]。如表2所示,8个样品中细菌的16S rDNA V3~V4区域的最终序列一共有557 581条,平均每个样品有7万条左右。OTU总数为51 801个,平均每个样品有6 475個。如表3所示,8个样品中真菌的 ITS1~ITS2区域的最终序列一共有514 125条,平均每个样品有64 265条。OTU总数为6 387个,平均每个样品有798个。从这2个表中可以看出,在测序深度相当的情况下,土壤中的细菌数量和种类远远大于真菌的数量和种类。
2.2 测序深度分析
Shannon指数是反映土壤微生物多样性的指数。由图1和图2可以看出,随着测序深度的增加各个样品的曲线趋于平缓,说明随着测序深度的增加,新增微生物种类明显减少,所以当前的测序深度已经可以足够反映土壤中所有细菌和真菌的真实情况。
2.3 2组间PCA结果
PCA是利用降维方法分析各个土壤样品中菌群的相似性。PCA中距离越近说明样品间的相似性越高。图3和图4分别展示了这8个样品中细菌和真菌的PCA三维图。从图中可以看出,NP组和NPK组2组样品间的距离要远远大于组内的距离,说明它们的组间的菌群差异要大于组内差异,也就说明了这样的分组方式有意义,可以进一步进行组间菌群差异的分析。
2.4 2组间LEfSe结果
LEfSe是对2组间差异菌群进行分析的方法。如5和图6所示,分别是2组间细菌和真菌差异菌群的LEfSe分支图,其中红色是NP组的优势菌群,绿色是NPK组的优势菌群。可以看出,NP组的优势细菌菌群集中在了疣微菌门(Verrucomicrobia),优势真菌菌群集中在了毛壳菌科(Chaetomiaceae)、锥盖伞属(Conocybe)以及被孢霉目(Mortierellales)。
而NPK组的优势细菌菌群集中在了假诺卡氏菌科(Pseudonocardiaceae)、Terrimonas,优势真菌菌群集中在了光柄菇科(Pluteaceae)、花褶伞属(Panaeolus)。
2.5 2组间属水平差异微生物菌群分析
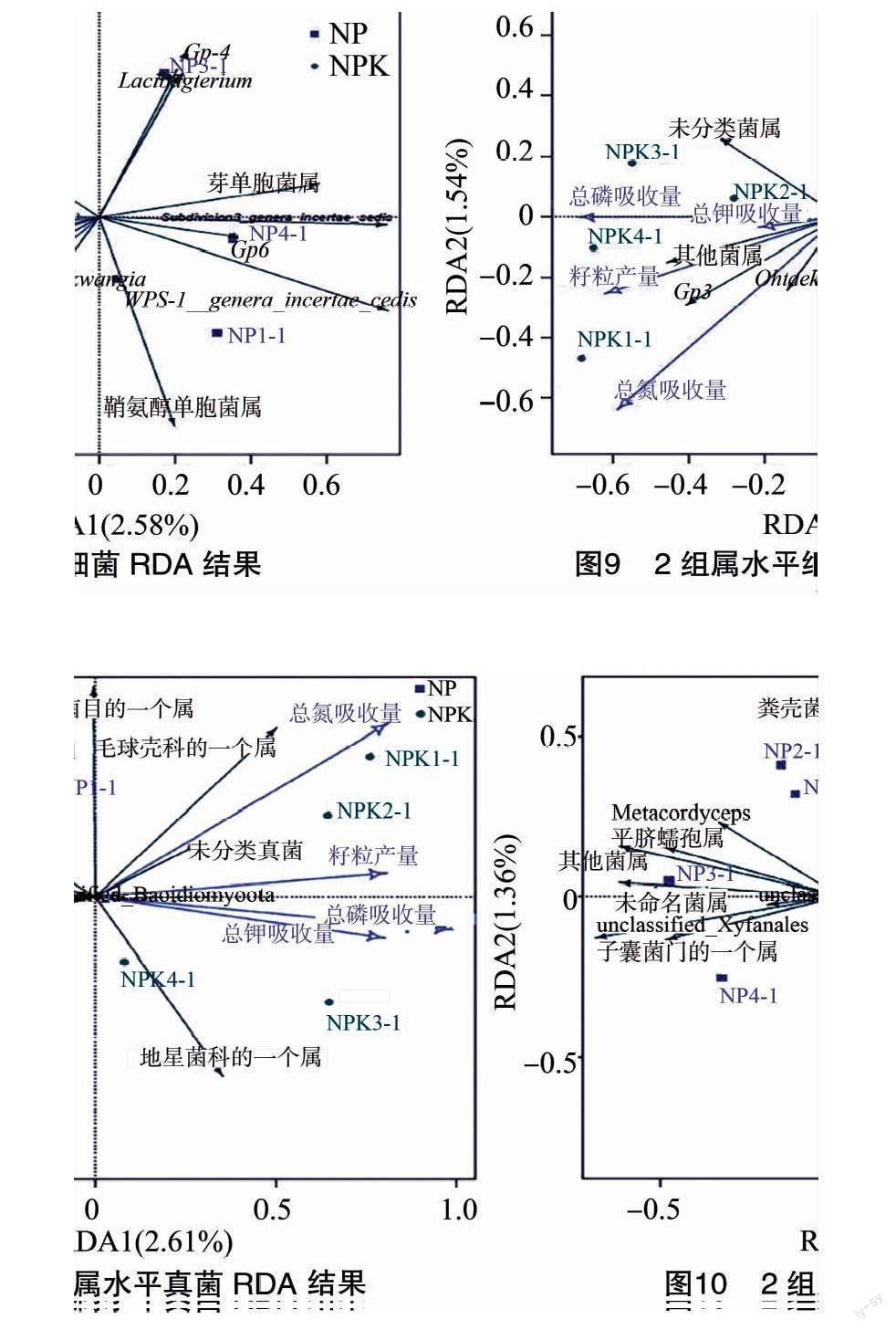
属水平是高通量测序技术能达到的测量较准确的一个分类水平。图7和图8展示的是2组样品中土壤微生物在属水平上细菌和真菌相对丰度差异较大的菌属,其中红色部分是相对丰度有显著差异的菌属。从图7中可以看出,2组间差异较大的细菌菌属有15种,其中NP组显著增多的是地杆菌属(Terrabacter)、长绳菌属(Longilinea)、硝化螺旋菌属(Nitrospira)、狭义梭菌属(Clostridium sensu stricto)、Mangroviflexus、Rhizorhabdus、Tahibacter,而NPK组显著增多的是Methyloceanibacter、Terrimonas、德克斯氏菌属(Derxia)、伦茨氏菌属(Lentzea)、Chryseolinea、间孢囊菌属(Intrasporangium)、Maricaulis、纤维微杆菌属(Cellulosimicrobium)。图8展示了2组间属水平上差异较大的真菌菌群,其中差异显著的只有NP组中较多的毛壳菌属(Chaetomium)和球腔菌属(Phaeosphaeria)。
产生这些差异菌属的原因,可能是由于长期的钾肥施加使土壤中微生物群落的结构发生了改变。因为微生物群落之间存在着联系,所以钾肥施加后,一些能够利用、分解钾肥的微生物以及其他相关微生物就会聚集。
2.6 小麦产量、氮磷钾吸收量与土壤微生物关联性分析
表4中展示的是2组处理小麦籽粒产量和小麦氮磷钾吸收量,该数据由河北省农林科学院资源环境研究所提供。从表4中可以看出,施加钾肥后,小麦的籽粒产量和小麦中氮磷钾的成分都有了明显的提高,说明钾肥对小麦的生长发育和小麦的产量和品质都有一定的影响。
图9和图10展示了属水平上细菌和真菌相对丰度与小麦产量和氮磷钾吸收量的相关性。从图9可以看出,钾肥的施加与小麦籽粒产量和氮磷钾的吸收量成呈正相关趋势,同时也与Ohtaekwangia、Gp3、其他菌属以及一些未知细菌菌属相对丰度呈正相关的趋势。未知菌属中是一些目前没有命名的菌属,这些菌属中应该有与钾肥有密切联系的菌属。由图10可知,钾肥的施加与毛球壳科的一个未知菌属(unclassified_Lasiosphaeriaceae)、未分类真菌菌属(unclassified_Fungi)以及地星科的一个未知菌属(unclassified_Geastraceae)等真菌菌属相对丰度呈正相关的趋势。与钾肥施加呈正相关的这一系列细菌和真菌有可能参与了钾肥的分解以及小麦对钾的吸收过程。
3 讨论与结论
本试验对河北省农林科学院辛集市马兰农场试验站的钾肥定位试验田的土壤进行采集和高通量测序分析。本次试验的土壤样品采集了来自钾肥定位试验的2个处理,分别是NP组和NPK组。NP组在整个小麦生长发育过程中不施加钾肥,NPK组小麦生长发育过程中施加适量的钾肥。本试验一共采集了8个小麦根际土壤样品,并利用Illumina MiSeq高通量測序平台对这8个样品中的细菌16S rDNA的V3~V4区域以及真菌ITS1~ITS2区域进行测序。其中细菌得到557 581条最终序列,真菌得到514 125条最终序列。通过聚类细菌得到 51 801 个OTU,真菌得到6 387个OTU。通过稀释曲线分析得出所有土壤样品的测序深度已经能够反映土壤微生物的真实情况。通过PCA,说明NP与NPK组间差异大于组内差异,具有分组意义,可以进行组间菌群的差异性分析。
LEfSe是对组间差异菌群的分析,通过分析可以得出,NP组的优势细菌菌群集中在了疣微菌门(Verrucomicrobia),优势真菌菌群集中在了毛壳菌科(Chaetomiaceae)、锥盖伞属(Conocybe)以及被孢霉目(Mortierellales)。而NPK组的优势细菌菌群集中在了假诺卡氏菌科(Pseudonocardiaceae)、Terrimonas,优势真菌菌群集中在了光柄菇科(Pluteaceae)、花褶伞属(Panaeolus)。进一步分析属水平的差异菌群可以得出,NP组显著增多的细菌菌属是Terrabacter、Longilinea、Nitrospira、Clostridium sensu stricto、Mangroviflexus、Rhizorhabdus、Tahibacter,而NPK组显著增多的细菌菌属是Methyloceanibacter、Terrimonas、Derxia、Lentzea、Chryseolinea、Intrasporangium、Maricaulis、Cellulosimicrobium。在真菌属水平上的差异菌群只有NP组中较多的毛壳菌属(Chaetomium)和球腔菌属(Phaeosphaeria)。这些差异菌群产生的原因可能是小麦田长期施加钾肥造成的,这些差异菌群应该与土壤中钾元素的转化分解有关。
结合河北省农林科学院资源环境研究所提供的小麦产量和氮磷钾吸收量的相关数据,可以看出钾肥的施加可以提高小麦的产量和氮磷钾吸收量。钾肥对小麦的一系列影响,应该也与土壤微生物有着一定的联系。通过RDA图可以看出,小麦的产量和品质与Ohtaekwangia、Gp3、其他菌属以及一些未知细菌菌属的相关丰度呈正相关的趋势,也与unclassified_Lasiosphaeriaceae、unclassified_Fungi、unclassified_Geastraceae等真菌菌属的相关丰度呈正相关的趋势。这些菌属应该是直接或间接地参与了小麦在整个生长发育过程中对钾元素的吸收。
通过以上分析可以看出,钾肥的施加量与小麦的生长发育有着重要的联系,这与路欣春等的研究结果[20-21]相符。结合高通量测序的分析结果可以看出,土壤微生物参与了小麦吸收钾肥的过程,并可以有效促进小麦吸收钾元素,这与Yadav等的研究结果[22-24]相符。
综上所述,通过对河北省农林科学院辛集市马兰农场钾肥定位试验田小麦根际土壤的采集与土壤微生物进行分析,得出的结论是钾肥的合理施加可以提高小麦的产量和氮磷钾吸收量,土壤中的一系列细菌和真菌直接或间接地参与了小麦对土壤中钾元素的吸收过程。另外,还有哪些微生物参与了钾元素的吸收过程,以及参与的具体方式还需要进一步的试验来进行探讨。
参考文献:
[1]查美琴,徐海东,成向荣,等. 不同林龄杉木+闽楠复层林土壤磷形态及微生物功能多样性变化[J]. 生态学报,2020,40(19):6938-6947.
[2]王宏杰,刘绍东,刘瑞华,等. 轮作对棉花根际土壤细菌群落的影响[J]. 生物技术通报,2020,36(9):117-124.
[3]张 翔,宋水山,黄亚丽,等. 基于高通量测序分析河北省中南部地区耕地土壤细菌多样性[J]. 华北农学报,2018,33(4):196-203.
[4]陈建国,张杨珠,曾希柏,等. 不同配方施肥对长期缺施钾肥的红壤性水稻土微生物特性的影响[J]. 植物营养与肥料学报,2008,14(6):1200-1205.
[5]薛宇昂,郭 壮,赵慧君,等. 基于MiSeq测序技术石花酒大曲中微生物多样性解析[J]. 中国酿造,2020,39(7):163-168.
[6]秦 涛,刘新社. 氮钾肥配施对土壤微生物与西瓜形态建成、品质、产量的影响[J]. 江苏农业科学,2022,50(16):154-161.
[7]汤明尧,沈重阳,陈署晃,等. 新疆小麦、玉米的产量和氮磷钾肥利用效率[J]. 中国农业科学,2022,55(14):2762-2774.
[8]李 博,常旭虹,王德梅,等. 不同土壤条件下追钾肥对小麦产量和品质的影响[J]. 农业科技通讯,2019(11):75-79.
[9]秦永林,石晓华,贾立国,等. 有机肥替代化肥对马铃薯—小麦轮作体系产量及钾肥利用率的影响[J]. 北方农业学报,2019,47(4):47-51.
[10]李淑靖,吴金芝,黄 明,等. 旱地条件下不同地理来源小麦品种的产量与氮磷钾积累利用差异[J]. 华北农学报,2023,38(4):129-140.
[11]黄雪娇,王 菲,谷守宽,等. 钾肥及与秸秆配施对紫色土作物产量和微生物群落结构的影响[J]. 生态学报,2018,38(16):5792-5799.
[12]钱晨诚,陈 立,马 泉,等. 磷钾肥施用量和方法对弱筋小麦籽粒产量和蛋白质含量及养分吸收利用的影响[J]. 植物营养与肥料学报,2023,29(2): 287-299.
[13]唐 旭,计小江,李超英,等. 水稻—大麦长期轮作体系钾肥效率及土壤钾素平衡[J]. 中国农业科学,2014,47(1):90-99.
[14]陈 娜. 钾肥对烟草青枯病的防控效果及其根际微生物群落的影响[J]. 安徽农业科学,2018,46(22):125-127,134.
[15]王春宁,余俊清,陈 良,等. 钾盐资源全球分布和我国找钾实践及方法探究[J]. 盐湖研究,2007,15(3):56-72.
[16]李丙智,王桂芳,秦晓飞,等. 沼液配施钾肥对果园土壤理化特性和微生物及果实品质影响[J]. 中国农业科学,2010,43(22):4671-4677.
[17]杨 敏,殷 绒,张国涛,等. 基于高通量测序技术的香格里拉葡萄酒产区根际微生物多样性研究[J]. 云南农业大学学报(自然科学),2020,35(3):392-400.
[18]彭玉娇,崔学宇,谭梦超,等. 不同立地条件沙田柚果园土壤微生物多樣性分析[J]. 南方农业学报,2020,51(5):1136-1144.
[19]杨 慧,路风银,韩俊豪,等. 高通量测序技术分析鲜食花生贮藏过程中真菌群落的的组成和变化[J]. 河南农业科学,2023,52(2):171-180.
[20]陆欣春,韩晓增,邹文秀. 作物高效利用土壤磷素的研究进展[J]. 土壤与作物,2013,2(4):164-172.
[21]张 磊,张维乐,鲁剑巍,等. 秸秆还田条件下不同供钾能力土壤水稻、油菜、小麦钾肥减量研究[J]. 中国农业科学,2017,50(19):3745-3756.
[22]Yadav R L,Dwivedi B S,Prasad K,et al. Yield trends,and changes in soil organic-C and available NPK in a long-term rice-wheat system under integrated use of manures and fertilisers[J]. Field Crops Research,2000,68(3):219-246.
[23]刘 雪. 腐殖酸复合微生物肥料对土壤微生物及蔬菜生长的影响[J]. 新农业,2020(13):41-42.
[24]王素萍,杜 雷,陈 钢,等. 有机无机钾肥配施对甜玉米产量、品质及土壤微生物的影响[J]. 湖北农业科学,2018,57(23):55-60.
