丹参SmWRKY33基因的克隆与表达分析
2024-04-08龚婷刘灵娣温春秀武玉翠王升万修福孙亚倩姜涛
龚婷 刘灵娣 温春秀 武玉翠 王升 万修福 孙亚倩 姜涛


摘要:为了研究WRKY33基因在丹参非生物胁迫中的作用机制,以白花丹参为试验材料,对丹参转录组数据进行分析,挖掘出丹参WRKY33基因参考序列并设计特异性引物,利用基因克隆技术从丹参中克隆出WRKY33基因的全长cDNA,命名为SmWRKY33。对SmWRKY33基因进行生物信息学分析,同时利用荧光定量方法探究SmWRKY33基因在逆境胁迫下的表达模式。结果表明,SmWRKY33基因核苷酸长度为1 635 bp,编码544个氨基酸。生物信息学分析显示,SmWRKY33基因的理论相对分子量为60 835.66,等电点为7.00,定位于细胞核,不存在跨膜区及信号肽,SmWRKY33蛋白为不稳定亲水蛋白。亲缘关系显示,SmWRKY33与紫苏、芝麻、白花泡桐的WRKY33亲缘关系较近。密码子偏好性分析得出拟南芥真核表达最适应丹参SmWRKY33基因的外源表达。qRT-PCR结果表明,SmWRKY33基因在低温、高温、PEG、NaCl等逆境胁迫诱导下具有不同的表达模式,其中低温、NaCl能显著诱导SmWRKY33基因的高表达,说明该基因对温度调节、盐胁迫较为敏感,猜测其参与温度、盐胁迫调控反应机制。本试验首次从丹参中克隆出SmWRKY33基因,探讨了该基因在丹参逆境胁迫下的作用机制,旨在为培育丹参的抗逆新品种提供参考基因。
关键词:丹参;SmWRKY33基因;生物信息学;qRT-PCR;基因克隆
中图分类号:S567.5+30.1 文献标志码:A
文章编号:1002-1302(2024)03-0053-08
丹参(Salvia miltiorrhiza Bunge)是唇形科、鼠尾草属多年生直立草本植物,是我国的大宗药材之一[1]。2020版《中华人民共和国药典》中记载:丹参以干燥根茎入药,具有活血、止痛、生新等功效,用于治疗胸痹心痛、月经不调、衰弱失眠等病症,临床上常用于心血管疾病的治疗[2]。丹参发挥药效的成分主要有2类,其中包括丹酚酸类、丹参酮类化合物[3]。此外,丹参基因组完善,生育期短,成为研究中药材在环境胁迫下的模型植物[4]。近些年来,丹参市场不断扩大,野生丹参远不能满足市场的需求;而在人工种植过程中,干旱会极大影响丹参的生长和品质。刘大会等通过研究不同土壤和水分对丹参植株的影响,发现严重干旱和过多水分会导致丹参酮、丹酚酸B的含量与累积量明显下降,进而影响丹参的产量和品质[5]。如何提高丹参的抗旱性和耐盐性,培育丹参抗逆品种,成为一个热门研究话题。
WRKY转录因子作为植物转录因子(transcription factors,TF)的一个大家庭,参与了植物的生长发育、防御调控、逆境反应等多种生物学过程,并在其中起着积极或消极的调节作用[6]。WRKYs通常由2个结构组成,包括高度保守的WRKYGQK七肽结构域(位于其N端的WRKY结构域)和C端的锌指基序[7]。WRKY结构域能和顺式作用元件W-box(C/T)TGAC(C/T)以及RAV1A、WLS元件特异性结合,说明它们具有不同的结合方式,并参与下游目的基因调控[8]。Yu等从小麦克隆出TaWRKY1-2D基因,研究表明TaWRKY1-2D蛋白可能参与小麦中植物激素生物合成、转录后基因调控、代谢途径、蛋白激酶信号传导,调节下游基因的表达以影响小麦生长机制,表明TaWRKY1-2D基因可以提高小麦的耐旱性[9]。Cai等从玉米中克隆出ZmWRKY17基因,结果发现,ZmWRKY17在拟南芥中通过抑制一些ABA和逆境反应基因的表达,提高对盐胁迫的敏感性,降低对ABA的敏感性,以此来提高植物的耐盐性[10]。Xiang等以拟南芥为模式植物,从中克隆出MFWRKY70基因,研究发现MFWRKY70基因定位于细胞核,通过该基因促进根系生长和保水,极大提高根系对干旱、渗透、盐胁迫的耐受性,以及在应激条件下增强抗氧化酶系统和维持活性氧(ROS)稳态和膜脂稳定性[11]。目前丹参的WRKY33基因还未被研究发现,本研究首次从丹参中克隆出WRKY33基因并进行生物信息学分析,同时利用qRT-PCR对特异性表达模式进行分析,旨在为进一步研究丹参调控次生代谢产物生物合成及逆境响应的分子机制提供参考。
1 材料和方法
1.1 材料与试剂
试验材料为丹参幼苗,品种为白花丹参,来自河北省农林科学院(114.45°E,38.06°N),于2022年12月采样进行后续试验。取丹参叶片,清水洗净后液氮速冻,用于丹参RNA的提取。
RNA提取试剂盒TransZol Up Plus RNA Kit、cDNA反转录试剂盒TransScript One-Step gDNA Removal、高保真酶试剂盒2×TranStart FastPfu、琼脂糖凝胶回收试剂盒、质粒提取试剂盒、荧光定量试剂盒等,购自天北京全式金生物技术有限公司;pMD19-T载体、2×Taq Plus Master Mix,购自北京白鲨生物科技有限公司。
1.2 试验方法
1.2.1 总RNA的提取及cDNA的合成
依照全式金高纯度RNA植物提取试剂盒(目录号:ER501-01)说明书,提取丹参叶片的总RNA;以丹参总RNA为模板,依照全式金TransScript One-Step Removal and cDNA Synthesis SuperMix试剂盒(目录号:AT311-03)说明书反转录体系,对丹参进行cDNA的合成。
1.2.2 丹參引物合成
根据丹参转录组数据库,利用Primer 5.0软件设计SmWRKY33基因特异性引物。上游引物:SmWRKY33-F 5′-ATGGCTTCTTCTAGCGGAAGC-3′;下游引物:SmWRKY33-R 5′-TCAGCTGAGGAAAGAGTCGAA-3′,送至生工生物工程(上海)股份有限公司进行引物合成。
1.2.3 丹参SmWRKY33基因克隆
以丹参cDNA为模板,参照全式金生物有限公司高保真DNA聚合酶2×TranStart FastPfu试剂盒方法扩增SmWRKY33基因全长。25 μL扩增体系如下:12.5 μL 2×Taq Plus MasterMix,1.0 μL SmWRKY33-F,1.0 μL SmWRKY33-R,1.0 μL Template cDNA,9.5 μL ddH2O。PCR扩增程序如下:95 ℃ 2 min;95 ℃ 20 s,54 ℃ 20 s,72 ℃ 1 min,共35个循环;72 ℃ 5 min;16 ℃保存。PCR产物用琼脂糖凝胶进行电泳监测,用紫外成像仪进行观察,全式金胶回收试剂盒回收目的片段。将目的片段与表达载体pMD19-T和大肠杆菌DH5α进行转化连接,挑取单克隆菌液送生工生物工程(上海)股份有限公司测序。
1.2.4 丹参SmWRKY33基因生物信息学分析
利用在线软件ExPASy-ProtParam(https://web.expasy.org/protparam/),ExPASy-ProScale(https://web.expasy.org/protscale/)对分子量、等电点等理化性质和亲疏水性进行分析,利用Conserved Domains(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)在线分析保守结构域,利用SignalP 4.1 Server(http://www.cbs.dtu.dk/services/SignalP-4.1/)、TMHMM 2.0(https://services.healthtech.dtu.dk/services/TMHMM/)对序列信号肽、跨膜结构进行分析,利用NetNGlyc 1.0 Server(http://www.cbs.dtu.dk/services/NetNGlyc/)、NetPhos 3.1 Server(http://www.cbs.dtu.dk/services/NetPhos/)在线分析磷酸化、糖基化位点,利用PSORT Prediction(http://psortl .hgc.jp/form.html)对基因SmDREB2A的cDNA编码氨基酸序列亚细胞进行定位,利用SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.plpage=npsa_sopma.html)、SWISS-MODEL(https://swissmodel.expasy.org)对SmWRKY33蛋白进行二、三级结构等预测;利用CodonW、EMBOSS软件分析丹参SmWRKY33基因密码子的偏好性。
1.2.5 丹参SmWRKY33基因表达分析
对丹参根进行低温、高温、PEG、NaCl处理,使用荧光定量分析SmWRKY33相对表达量,以丹参肌动蛋白基因Actin为内参基因,利用软件Primer 5.0进行引物设计(表1)。
参照全式金PerfectStart Green qPCR SuperMix试剂盒中说明书进行操作,20 μL反应体系如下:10 μL PerfectStart Green qPCR SuperMix,0.4 μL引物-F(正向引物),0.4 μL 引物-R(反向引物),2.0 μL cDNA (1 ng),7.2 μL ddH2O。扩增条件:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 30 s,共40个循环;4 ℃ 保存。每个反应重复3次,使用2-ΔΔCT 法分析丹参SmWRKY33基因表达量。
2 结果与分析
2.1 丹参SmWRKY33基因cDNA克隆与序列分析
根据丹参转录组数据得到的基因信息,发现1个丹参WRKY33抗逆基因,以此序列设计特异性引物,对丹参WRKY33进行基因克隆。经PCR扩增得到1条特异性片段,其大小约为1 600 bp,与预期大小长度一致(图1-A)。对PCR产物进行回收后,连接至pMD19-T测序载体,使用大肠杆菌DH5α进行转化,挑取单克隆菌液送公司测序。对测序结果进行分析,发现该序列含有1 635 bp的完整开放阅读框(ORF),编码544个氨基酸(图1-B),命名为SmWRKY33。在SmWRKY33基因的氨基酸组成中,丝氨酸(Ser)含量最高,占14.2%;其次为脯氨酸(Pro)含量,占9.5%;色氨酸(Trp)、半胱氨酸(Cys)含量最低,各占0.7%。
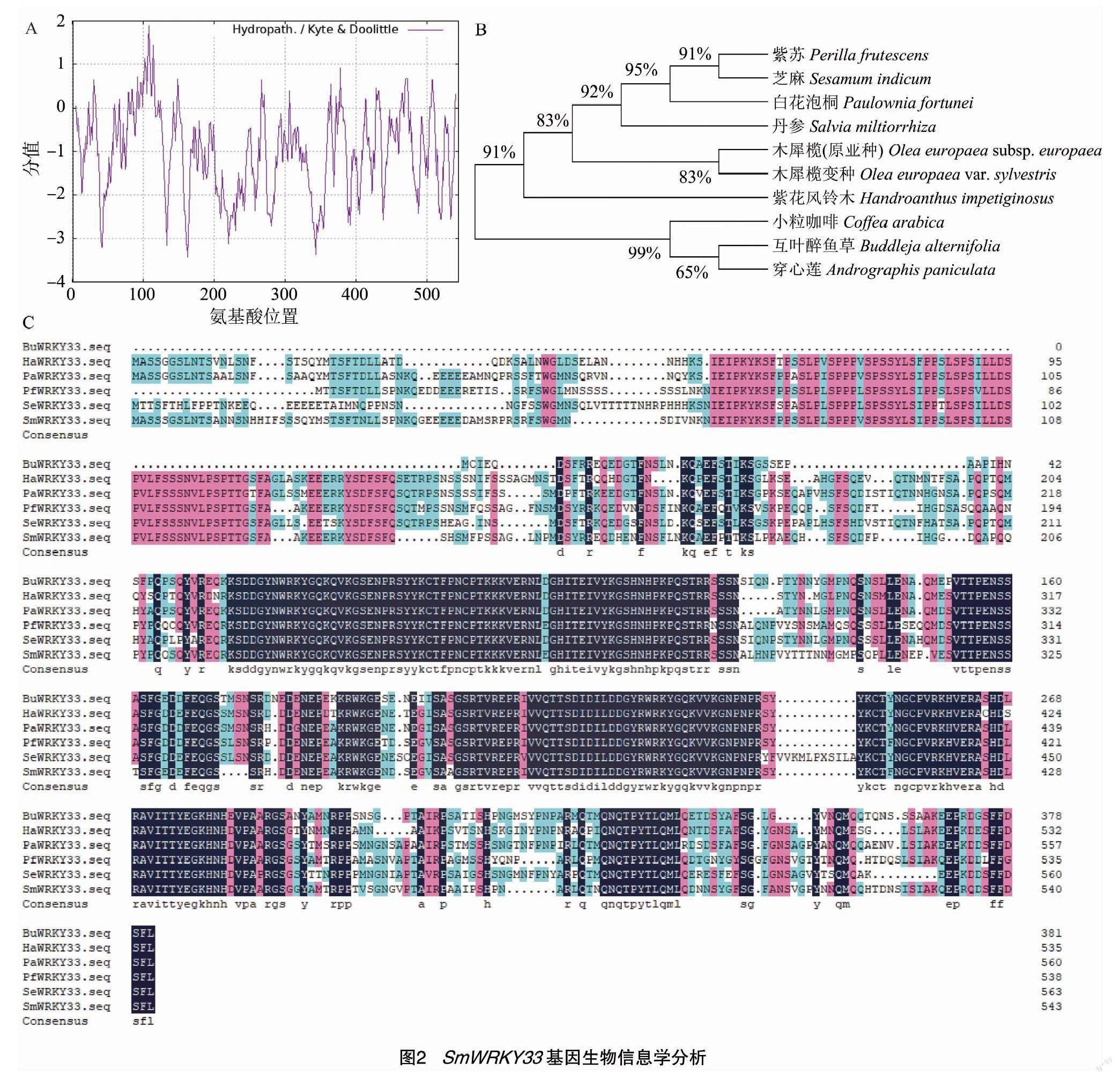
利用ProtParam在线软件分析SmWRKY33蛋白的理化性质,SmWRKY33蛋白的相对分子量为60 835.66,等电点为7.00,分子式为C2 641H4 039N769O862S15,不稳定指数为69.58,脂肪族指數为46.60,总平均亲水性为-1.007,归类为不稳定亲水蛋白。ExPasy-ProtSCale在线软件分析SmWRKY33蛋白亲/疏水性,结果显示,SmWRKY33蛋白疏水性最强的位点是第108个氨基酸,疏水最高值为1.889;亲水性最强的位点是第133个氨基酸,亲水性最低值为 -3.156(图2-A)。但从整条肽链的预测值结果分析来看,该蛋白整体趋于亲水性,为亲水蛋白。
2.2 丹参SmWRKY33基因生物信息学分析
利用NCBI数据库对丹参SmWRKY33基因进行Blast分析,结果表明,SmWRKY33基因的氨基酸序列与PfWRKY33(紫苏,Perilla frutescens,KAH6798330.1)、PaWRKY33(白花泡桐,Paulownia fortunei,KAI3447833.1)、BuWRKY33(互叶醉鱼草,Buddleja alternifolia,KAG8374463.1)、SeWRKY33(芝麻,Sesamum indicum,XP-011077504.1)的同源性较高,同源性分别为78.27%、73.39%、73.13%、66.78%(图2-C)。在线软件NCBI分析得出SmWRKY33基因有2个WRKY基因保守结构域。利用MEGA 11软件分析SmWRKY33基因氨基酸序列亲缘关系,结果显示SmWRKY33基因与紫苏、芝麻、白花泡桐WRKY33亲缘关系较近(图2-B)。
在线软件WoLF-PSORT预测SmWRKY33蛋白的亚细胞定位,该蛋白可能定位于细胞核。利用TMHMM Sever 2.0预测SmWRKY33蛋白的跨膜结构域,结果显示该蛋白没有存在跨膜结构域,可能不属于跨膜蛋白(图3-A)。使用NetNGlyc 1.0 Server对SmWRKY33蛋白糖基化位点进行预测,结果表明该蛋白共有6个糖基化位点(图3-B)。利用NetPhos 3.1 Server对SmWRKY33蛋白的磷酸化位点、蛋白激酶结合位点进行分析(图3-C),预测值大于0.5共发现149个磷酸化位点,分别含有丝氨酸(S)108个、苏氨酸(T)27个、酪氨酸(Y)14个。SmWRKY33蛋白的信号肽使用在线软件SignalP 4.1 Server进行分析,C值、S值、Y值都小于阈值0.5,说明该蛋白没有信号肽位点,属于非分泌蛋白(图3-D)。
2.3 丹参SmWRKY33蛋白二级三级结构预测
利用SOPMA分析SmWRKY33蛋白的二级结构,结果显示该蛋白二级结构以无规则卷曲为主,占77.39%,其次是延伸链、α-螺旋、β-转角,各占10.48%、10.29%、1.84%(图4-A)。结合在线软件SWISS-Model建立SmWRKY33蛋白的三级结构模型,空间结构以随机卷曲为主,这与二级结构的预测结果相符(图4-B)。
2.4 丹参SmWRKY33基因密码子偏好性分析
利用CodonW、EMBOSS软件分析丹参SmWRKY33基因的密码子适应指数(codon adaptation index,CAI)、有效密码子数(effective number of codons,ENC)、GC1s含量、GC2s含量、GC3s含量、总GC含量、同义密码子相对适应度(relative synonymous codon usage,RSCU)。结果表明,CAI为0.222、ENC为54.16,说明密码子偏性较弱;总GC含量值0.4 979,其中GC1s、GC2s、GC3s含量值分别为0.4 752、0.4 569、0.5 615,说明该基因的A/U含量高于G/C含量。当RSCU=1时,密码子没有偏好性;RSCU>1时,密码子具有偏好性。表2中,RSCU>1的密码子共有28个,其中A/U结尾有9个 G/C结尾有19个 说明丹参基因偏好于从数据库CodcmUsage Database查找烟草(Nicotiana tabacum L.)、拟南芥[Arabidopsis thaliana(L.) Heynh.]、大肠杆菌(Escherichia coli)、酵母(Sacchammyces cerevisiae)基因组的密码子偏好性,利用在线软件EMBOSS-CHIP分析丹参SmWRKY33基因密码子的使用频率,表3列举了丹参与其4个基因密码子的使用频率,分别用Sm/Nt、Sm/At、Sm/Ec、Sm/Sc来表达丹参SmWRKY33基因与烟草、拟南芥、大肠杆菌、酒酿酵母的密码子使用频率比值。若2个物种间密码子使用频率比值为0.5~2.0,则表明密码子使用偏向比较接近,超过此范围则差异较大。差异较大的密码子个数越少,越有利于基因的异源表达。结果显示,SmWRKY33与烟草、拟南芥、大肠杆菌、酒酿酵母分别有23、22、28、24个差异较大的密码子,由此得出拟南芥真核表达最适应丹参SmWRKY33基因的外源表达。
2.5 丹参SmWRKY33基因表达分析
利用荧光定量PCR分析丹参SmWRKY33基因在逆境胁迫下的相对表达量 结果表明SmWRKY33基因在低温、高温、PEG、NaCl等逆境胁迫下有不同程度的表达差异性。在低温逆境胁迫下SmWRKY33基因的相对表达量显著提高,在6 h时达到最高(图5-A);在高温逆境处理下相对表达量较低(图5-B),说明该基因参与丹参的低温响应机制。同时,为探究SmWRKY33基因在干旱、盐胁迫下的表达模式,使用PEG、NaCl进行逆境胁迫试验。结果表明,在PEG处理下,SmWRKY33基因在不同时间点的表达量不同,在24 h表达量达到最高(图5-C)。在NaCl处理下,SmWRKY33基因的相对表达量随时间增加总体逐渐升高,但在24 h时出现下降的趋势,随后又逐渐上升,表明NaCl显著诱导SmWRKY33基因的高表达(图5-D)。SmWRKY33基因表达谱分析结果显示,该基因易受低温和盐等非生物胁迫的诱导表达。
3 结论与讨论
丹参是我国传统中药材,据《神农本草经》所述,其皆为上品,因药用部位根部呈紫红色,被人们称为“丹心”[12]。《本草纲目》原文记载丹参“小花成穗如蛾形,中有细子,其根皮丹而肉紫”,具有活血、治疝痛、通心包络等作用[13]。Mei等阐述了不同温度下丹参在干燥过程中产生的代谢变化,发现 100 ℃ 是丹参代谢物谱变化的关键转折点,主要表現为酶促催化生物合成(≤100 ℃) 和化学诱导转化(≥100 ℃)[14]。Tong等将代谢组学与质谱成像方法相结合,对丹参空间代谢组进行生物合成,发现丹参素是丹参生产多种酚酸的重要前体[15]。意大利学者对丹参进行研究,首次证明丹参中的丹参酮可以改善以奥沙利铂为主进行化疗所带来的神经病理性疼痛,同时可以降低胶质母细胞瘤中癌细胞的发展速度[16]。
近年来,越来越多的研究证明转录因子在生物和非生物胁迫信号传递中起着关键作用,一些WRKY转录因子在干旱/冷胁迫或干旱/热激胁迫下可以同时被诱导,从而提高植物的抗逆性[17]。Chen等详细阐述了WRKY转录因子在植物非生物胁迫中的作用,表明WRKY转录因子在植物生长过程中具有重要作用[18]。WRKY33作为WRKY家族的转录因子之一,其转录活性依赖于MPK3/6介导的磷酸化。Wang等使用反向遗传方法和酵母表达系统,明确了拟南芥转录因子WRKY33是通过与CesA8远端启动子区域的W-box元件结合,直接调节CesA8的表达,参与植物的干旱生长机制[19]。Zhou等通过AtWRKY33基因对同源植物番茄WRKY33胁迫响应中的功能分析,发现在植物生长过程中,WRKY33转录因子在植物结构、功能、调控网络上高度保守,可以有效保护植物免受生物和非生物的胁迫[20]。目前已经从苹果[21]、向日葵[22]、毛果杨[23]成功克隆出WRKY33,研究表明WRKY33转录因子可以提高植物的耐盐性和抗旱性。
随着基因克隆技术的发展,越来越多WRKY基因家族的转录因子被相继挖掘出来并进行深入研究。Li等从玉米中克隆出ZmWRKY33,对其进行干旱、高盐、冷处理及ABA外源诱导试验,结果表明转基因拟南芥具有更高的抗逆性[24]。本研究根据丹参转录组数据,挖掘出丹参具有耐盐性和抗旱性转录因子WRKY33,利用基因克隆技术首次从丹参中克隆了SmWRKY33基因,该基因全长为1 635 bp,编码544个氨基酸。利用在线软件进行生物信息学分析,SmWRKY33蛋白的相对分子量为60 835.66,等电点为7.00,分子式为C2 641H4 039N769O862S15,为不稳定亲水蛋白。亲缘关系分析显示SmWRKY33与紫苏、芝麻、白花泡桐的WRKY33親缘关系较近。利用在线软件WOLF PSORT 进行亚细胞定位预测,结果显示丹参SmWRKY33蛋白可能定位于细胞核中。荧光定量PCR分析SmWRKY33基因在低温、高温、PEG、NaCl处理下的相对表达量情况,结果显示SmWRKY33基因易受低温、NaCl诱导表达,说明SmWRKY33基因参与了丹参在生长过程中耐低温和耐盐机制。本研究利用基因克隆技术,初步探讨了SmWRKY33的生物学功能,以期为培育丹参抗逆新品种提供理论支撑。
参考文献:
[1]张夏楠,关红雨,高 伟,等. 中药丹参资源开发现代研究进展[J]. 转化医学研究(电子版),2014,4(4):26-36.
[2]国家药典委员会.中华人民共和国药典[M]. 北京:中国医药科技出版社,2020.
[3]马晓晶,杨 健,马桂荣,等. 中药丹参的现代化研究进展[J]. 中国中药杂志,2022,47(19):5131-5139.
[4]宋经元,罗红梅,李春芳,等. 丹参药用模式植物研究探讨[J]. 药学学报,2013,48(7):1099-1106.
[5]刘大会,郭兰萍,黄璐琦,等. 土壤水分含量对丹参幼苗生长及有效成分的影响[J]. 中国中药杂志,2011,36(3):321-325.
[6]Wang Z R,Liu L,Su H,et al. Jasmonate and aluminum crosstalk in tomato:identification and expression analysis of WRKYs and ALMTs during JA/Al-regulated root growth[J]. Plant Physiology and Biochemistry,2020,154:409-418.
[7]Chen X J,Li C,Wang H,et al. WRKY transcription factors:evolution,binding,and action[J]. Phytopathology Research,2019,1(1):1-15.
[8]Zhang Y L,Du P,Xiong F Q,et al. WRKY genes improve drought tolerance in Arachis duranensis[J]. Frontiers in Plant Science,2022,13:910408.
[9]Yu Y,Song T Q,Wang Y K,et al. The wheat WRKY transcription factor TaWRKY1-2D confers drought resistance in transgenic Arabidopsis and wheat (Triticum aestivum L.)[J]. International Journal of Biological Macromolecules,2023,226:1203-1217.
[10]Cai R H,Dai W,Zhang C S,et al. The maize WRKY transcription factor ZmWRKY17 negatively regulates salt stress tolerance in transgenic Arabidopsis plants[J]. Planta,2017,246(6):1215-1231.
[12]吴 普,孙星衍,孙冯翼. 神农本草经[M]. 太原:山西科学技术出版社,2010.
[13]高学敏. 本草纲目[M]. 北京:印刷工业出版社,2011:73.
[14]Mei X G,Wang S Q,Zhang L,et al. Widely targeted metabolomics analysis revealed components change regularity of Salvia miltiorrhiza Bunge after post-harvest drying under different temperature[J]. Industrial Crops and Products,2022,188:115638.
[15]Tong Q,Zhang C,Tu Y,et al. Biosynthesis-based spatial metabolome of Salvia miltiorrhiza Bunge by combining metabolomics approaches with mass spectrometry-imaging[J]. Talanta,2022,238:123045.
[16]di Cesare Mannelli L,Piccolo M,Maione F,et al. Tanshinones from Salvia miltiorrhiza Bunge revert chemotherapy-induced neuropathic pain and reduce glioblastoma cells malignancy[J]. Biomedicine & Pharmacotherapy,2018,105:1042-1049.
[17]Wang H P,Chen W Q,Xu Z Y,et al. Functions of WRKYs in plant growth and development[J]. Trends in Plant Science,2023,28(6):630-645.
[18]Chen L G,Song Y,Li S J,et al. The role of WRKY transcription factors in plant abiotic stresses[J]. Biochimica et Biophysica Acta-Gene Regulatory Mechanisms,2012,1819(2):120-128.
[19]Wang X J,Du B J,Liu M,et al. Arabidopsis transcription factor WRKY33 is involved in drought by directly regulating the expression of CesA8[J]. American Journal of Plant Sciences,2013,4(6):21-27.
[20]Zhou J,Wang J,Zheng Z Y,et al. Characterization of the promoter and extended C-terminal domain of Arabidopsis WRKY33 and functional analysis of tomato WRKY33 homologues in plant stress responses[J]. Journal of Experimental Botany,2015,66(15):4567-4583.
[21]張远嬿. 苹果MdWRKY33基因的克隆与功能分析[D]. 沈阳:沈阳农业大学,2018:13-17.
[22]范荣伟. 大白菜BrWRKY33基因及其上游调控序列的克隆与功能研究[D]. 北京:首都师范大学,2009:11-21.
[23]张 蕾. 毛果杨WRKY33基因的克隆及抗旱耐盐碱性研究[D]. 哈尔滨:东北林业大学,2022:6-14.
[24]Li H,Gao Y,Xu H,et al. ZmWRKY33,a WRKY maize transcription factor conferring enhanced salt stress tolerances in Arabidopsis[J]. Plant Growth Regulation,2013,70(3):207-216.
