苏紫猪血清细胞因子含量对育肥性状的影响
2024-04-08付言峰程金花廖超戴超辉涂枫王学敏
付言峰 程金花 廖超 戴超辉 涂枫 王学敏

摘要:为研究育肥期苏紫猪血清中细胞因子含量对育肥性状的影响,本研究选取18头苏紫猪进行生长育肥测定,然后屠宰采集血样,进行CCL4、IL-6和FGF-2这3 种细胞因子的检测,同时统计其日龄、体质量、瘦肉率和皮下脂肪,分析两者之间的关系。结果发现,CCL4、IL-6和FGF-2的标准曲线拟合度分别为0.996 3、0.995 8、0.995 3,均非常接近于1,说明后面检测的结果可信度高。育肥期苏紫猪血清中,IL-6含量最高,其次为CCL4含量,FGF-2 含量最低(P<0.05)。IL-6含量与日增质量、瘦肉率呈负相关(相关系数分别为-0.41、-0.21),与皮下脂肪率呈正相关(相关系数为0.08);CCL4含量与瘦肉率呈负相关(相关系数为-0.44);FGF-2含量最高的猪日增质量最快。研究提示,优质猪血清细胞因子含量对育肥性状有较大的影响,其中,育肥期IL-6和CCL4含量可反映出猪瘦肉率的高低,有利于猪高瘦肉率性状的高效选育。
关键词:苏紫猪;趋化因子C-C配体4;成纤维细胞生长因子2;成纤维细胞生长因子2;生长育肥
中图分类号:S828.6 文献标志码:A
文章编号:1002-1302(2024)03-0201-06
我国是一个生猪养殖和消费大国,《中国畜禽种业发展报告2022》数据显示,2021年12月,全国能繁母猪存栏量为4 329万头,全国生猪存栏量为44 922万头,出栏量67 128万头,猪肉产量为 5 296万t (肉类占比59.6%),人均猪肉占有量37.49 kg[1]。
苏紫猪是江苏省农业科学院畜牧研究所猪育种与生产创新团队正在培育的快长节粮型优质猪新品种[2],含苏钟猪[3-4]、淮猪[5]和巴克夏猪[6]血统。苏紫猪全身被毛黑色,生产性能优异,除了含有人体生理活动所需的优质蛋白质和脂肪主成分以外,还富含维生素、肌苷酸、氨基酸和其他风味物质,加工后肉质鲜、香、嫩、口感好,在市场上深受消费者的青睐[7]。所以,屠宰性状的选育是其一个重要选育方向。
另外,在种猪选育中,生长性状(料质量比、日增质量)也是当前非常重要的育种性状,此性状属于中等遗传力性状[8]。及时筛选到具有优良生长性状的种猪,能快速提高整个生猪体系的生产效率,实现更高的生猪养殖效益[9]。随着人民生活水平的提高,消费者对肉质的需求也要不断增加[10]。因此,有必要针对优质猪种猪[11]开展上述生长育肥性状的相关研究,为猪场的引种、生猪改良工作提供理论依据。
趋化因子C-C配体4(C-C motif chemokine 4,CCL4)属于炎症性CC 类趋化因子亚家族的成员,又称巨噬细胞炎症蛋白1β(macrophage inflammatory protein-1β,MIP-1β)[12],是多种类型细胞,包括巨噬细胞、自然杀伤细胞、单核细胞、未成熟树突状细胞和冠状动脉内皮细胞等的趋化剂[13]。分子质量一般为8~12 ku,为细胞因子蛋白样物质,是体内促炎趋化因子,参与细胞分化、迁移和组织定位等过程[14]。对于CCL4的作用,在人类疾病中的研究较多[15]。大鳞副泥鳅(Paramisgurnus dabryanus) CCL4在上颌触須发育的晚期高度表达,表明CCL4可能作为调节基因参与上颌触须的发育[16]。
猪白细胞介素6(IL-6)在1980年被发现,主要由活化的T细胞、成纤维细胞、脂肪细胞分泌和合成,是一种功能广泛的、具有多种生物学效应的炎症因子[17]。肥胖(体质量过高)会导致炎症因子TNF-α、IL-6表达水平上升[18],血液中大约1/3的循环IL-6来自脂肪组织,IL-6水平升高与肥胖,葡萄糖耐受不良,胰岛素抵抗和T2DM呈正相关[19]。人孕期外周血IL-6水平与子代出生体质量无明显相关,原因可能是研究对象经济水平较好,炎性因子平均水平较低所致[20]。IL-6基因的遗传变异与民猪、长白猪哺乳仔猪腹泻存在不同程度的相关[21]。
成纤维细胞生长因子2(fibroblast growth factor 2,FGF-2)由多种细胞类型产生,是一种重要的促血管生成因子[22]和肌肉因子[23],并通过其受体与各种硫酸乙酰肝素结合和组成调节其活性的蛋白聚糖[24]。FGF-2可引起内皮细胞的迁移和生长,又能够促进肿瘤血管生成,参与猪胚胎附植过程[25],还能够通过NDY1/KDM2B-miR-101-EZH2途径来调控细胞增殖等过程[26]。肥胖小鼠皮下脂肪组织中FGF-2转录水平表达量升高,且FGF-2剂量依赖性抑制早期脂肪细胞分化[27]。
1 材料与方法
1.1 试验动物
试验地点在江苏省农业科学院合作单位(江苏融港良种繁育有限公司)猪场,试验动物包括:苏紫猪35头。按性别、血统分成5栏饲养,饲养在种猪测定站上。试验开始日期:2022年7月6日,结束日期:2023年12月31日。2022年11月14日,对18头猪进行屠宰测定,采血后分析血清细胞因子含量。
1.2 试剂仪器
主要试剂为3种试剂盒,分别为:MM-0418O1 猪白细胞介素6(IL-6)ELISA试剂盒 96T、MM-77683O1 猪趋化因子C-C-基元配体4(CCL4)ELISA试剂盒 96T、MM-78107O1猪成纤维细胞生长因子2(FGF-2)ELISA试剂盒96T,均为酶免(MEIMIAN)品牌,来自江苏酶免实业有限公司(Jiangsu Meimian industrial Co.,Ltd)。
主要仪器包括:酶标仪(芬兰,Labsystems Multiskan MS,352型)、洗板机(芬兰,Thermo Labsystems,AC8型)、微量高速离心机(中国,湘仪,TG16W型)、隔水式恒温培养箱(中国,江东,GNP-9080型)和全自动生化分析仪(美国,贝克曼库尔特,AU480型)。
1.3 细胞因子测定方法
使用ELISA方法进行测定。首先进行标准品的稀释,1、2、3、4、5号标准品的浓度分别稀释至50、100、200、400、800 ng/L,即取150 μL各号标准品,加入150 μL标准品稀释液。其次进行以下操作:(1)加样,分别设空白孔(空白对照孔不加样品及酶标试剂,其余各步操作相同)、标准孔、待测样品孔。在酶标包被板上标准品准确加样50 μL,待测样品孔中先加样品稀释液40 μL,然后再加待测样品 10 μL(样品最终稀释度为5倍)。将样品加于酶标板孔底部,尽量不触及孔壁,轻轻晃动混匀。(2)温育:用封板膜封板后置于37 ℃温育30 min。(3)配液:将30 倍浓缩洗涤液用蒸馏水30倍稀释后备用。(4)洗涤:小心揭掉封板膜,弃去液体,甩干,每孔加满洗涤液,静置30 s后弃去,如此重复5 次,拍干。(5)加酶:每孔加入酶标试剂50 μL,空白孔除外。(6)再重复进行1次温育和洗涤。(7)显色:每孔先加入显色剂A 50 μL,再加入显色剂B 50 μL,轻轻振荡混匀,37 ℃避光显色10 min。(8)终止:每孔加终止液 50 μL,终止反应(此时蓝色立转黄色)。最后进行测定,以空白孔调零,450 nm 波长依序测量各孔的吸光度(D值),测定应在加终止液后15 min以内进行。
1.4 猪育肥性状测定方法
采用种猪自动测定站进行测定育肥性状。先将试验猪打上电子耳猪,统一赶入测定舍,分成5栏饲喂,每个饲养栏内设置1台测定站,每天利用测定站自动记录和上传苏紫猪在测定日龄内的采食量数据、增质量数据、生产性能数据。其中,每一条采食量数据包括:栏位、测定站号、电子耳牌号、开始日期、结束日期、测定天数、采食量、采食次数、采食时间和平均日采食量;每一条增重数据包括:栏位、测定站号、电子耳牌号、开始日期、结束日期、开始体质量、结束体质量、增质量、测定天数、平均日增质量、每个测定日体质量和日增质量;每一条生产性能数据包括:栏位、测定站号、电子耳牌号、采食量、起始体质量、增质量、平均日采食量、平均日增质量和饲料报酬(料质量比)。
瘦肉率和皮下脂肪率是在采血当天对试验猪进行屠宰后现场测定,具体为左半胴体分割成前、中、后3段,每段进行皮、皮下脂肪、瘦肉和骨头4个部分的手工剥离,依次称质量记录,4个部分相加为100%(不计算分割过程中的损耗,不包括板油、肾),最后分别采用瘦肉和皮下脂肪除以4个部分总质量,获得各部分所占的比例。
1.5 数据统计
数量储存、筛选、分类汇总等整理是通过Excel和Access软件分析。不同组别间测定数值的差异性显著水平通过SSPS 9.1统计软件包进行GLM分析,结果以“最小二乘均值±标准误”表示。
细胞因子含量是通过标准曲线方法计算出来的,即用各自的5种标准物(浓度已知)和空白对照,采用酶标仪测定出各标准物的吸光度(D值)。然后以D值为横坐标,以标准物浓度为纵坐标,绘制出各细胞因子的标准曲线。最后,待测样品根据测定的D值,在标准曲线上找到对应的浓度。
2 结果与分析
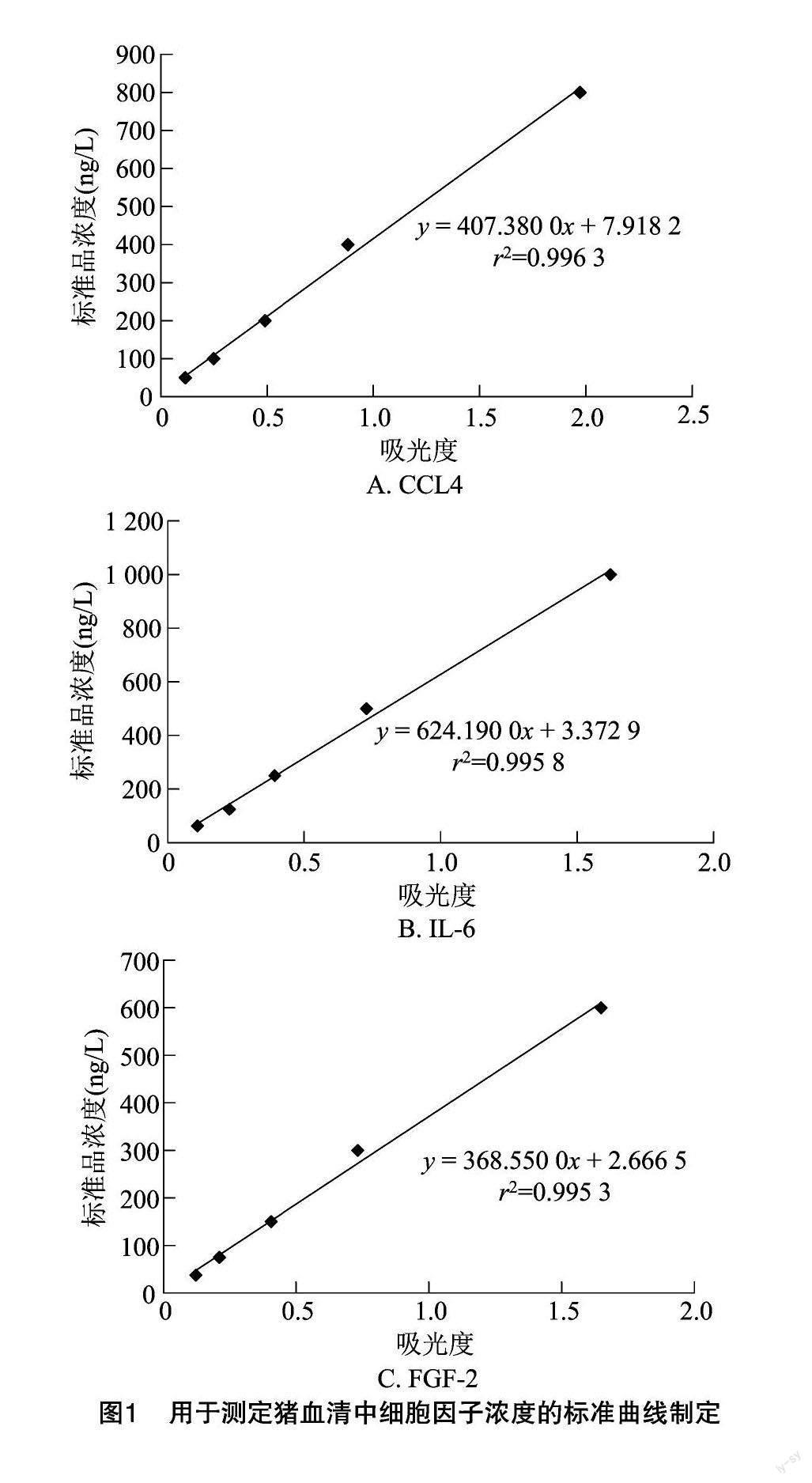
2.1 标准曲线制定结果
3种细胞因子CCL4、IL-6和FGF-2,分别对应3条标准曲线,同时获得了标准曲线的线性拟合回归方程式和线性拟合度(r2)。结果表明,CCL4的标准曲线拟合的回归方程为y=407.380 0x+7.918 2,拟合度为r2=0.996 3。IL-6标准曲线拟合的回归方程为y=624.190 0x+3.372 9,拟合度为 r2=0.995 8,斜率(624.19)>CCL4(407.38),拟合度略低于CCL4。FGF-2標准曲线拟合的回归方程为 y=368.550 0x+2.666 5,拟合度为r2=0.995 3,斜率(368.55)最低,小于CCL4和IL-6,拟合度也最低,小于CCL4和IL-6。由图1可知,3条标准曲线拟合度均非常接近于1,说明拟合效果均非常理想,故根据各自线性拟合回归方程式计算出的待测样品浓度准确性均非常高。
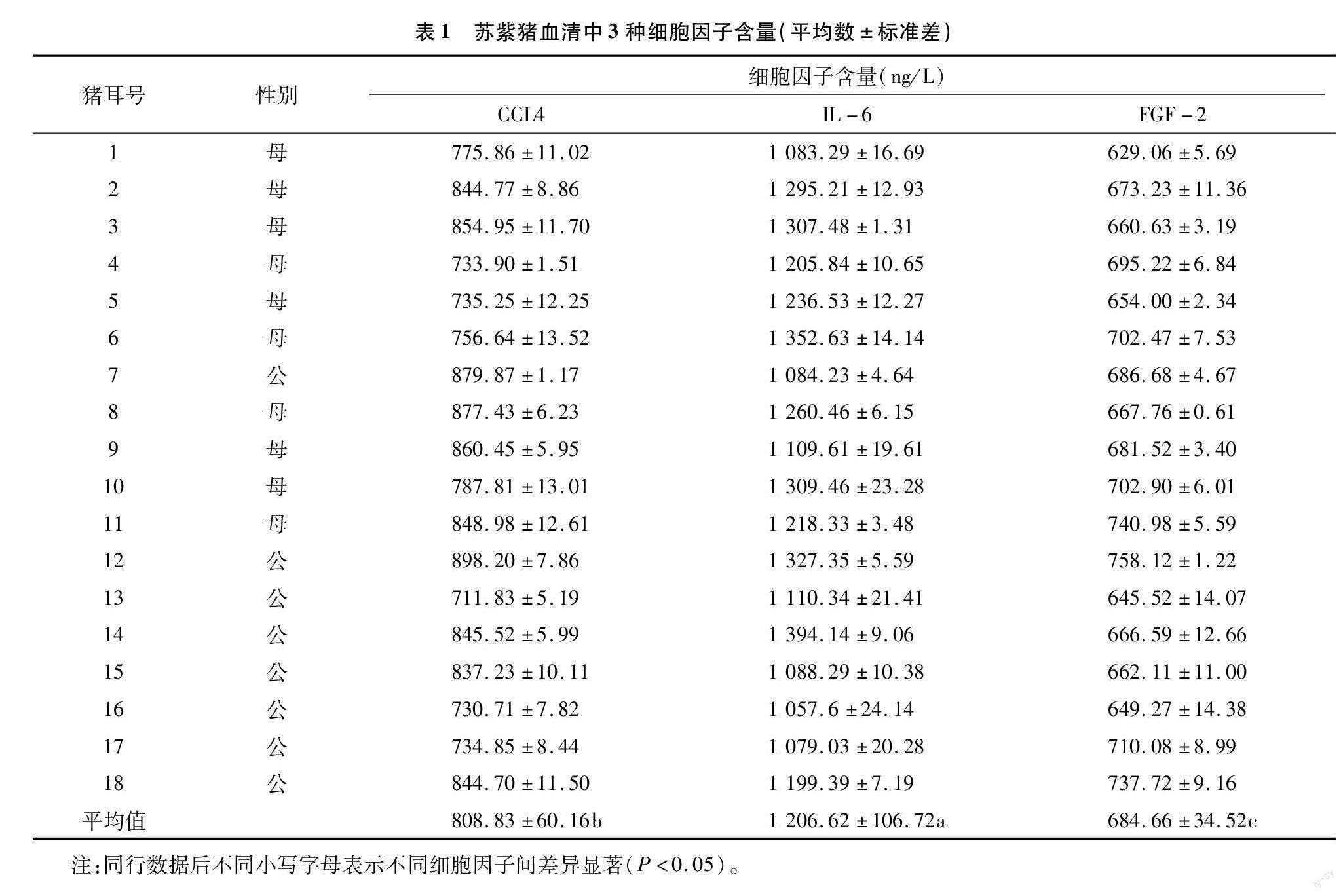
2.2 细胞因子测定结果
由表1可知,细胞因子的检测有3次重复,取其平均值。每头猪根据上述标准曲线计算出的试验猪同一时间点的CCL4、IL-6和FGF-2平均含量分别为808.83、1 206.62、684.66 ng/L,且3种细胞因子的平均含量两两差异显著(P<0.05),其中,IL-6含量最高,其次为CCL4,最低的为FGF-2。3种细胞因子含量最高值均出现在不同的猪上,最低值也均出现在不同的猪上。其中,CCL4最高值为898.2 ng/L,最低值为711.83 ng/L;IL-6最高值为 1 394.14 ng/L 最低值为1 057.6 ng/L;FGF-2最高值为737.72 ng/L,最低值为629.06 ng/L。
2.3 不同育肥性状间的细胞因子差异性分析
对试验猪不同性别、体质量、日龄间细胞因子进行差异性比较,由表2可知:(1)性别间差异,IL-6 含量母猪显著高于公猪(P<0.05),CCL4和FGF-2含量公母猪间无显著差异。(2)体质量间差异,CCL4含量在90 kg猪中显著高于80、100 kg猪中(P<0.05),80、100 kg猪间差异不显著;IL-6含量在90 kg猪中最高,其次为80 kg猪和100 kg猪,其中,90、100 kg猪间差异显著(P<0.05)。(3)日龄间差异,CCL4含量在220 d猪中显著高于190、200、210 d猪中(P<0.05),其中190 d猪中的CCL4含量最低;IL-6含量在220 d猪中显著低于190、200 d猪中,其中,190 d猪中的IL-6含量最高。(4)
日增质量间差异,IL-6含量在500 g日增质量猪中显著高于700 g猪中(P<0.05);FGF-2在800 g日增质量猪中显著高于500、600、700 g日增质量猪中(P<0.05),其他组间差异不显著。(5)瘦肉率间差异,CCL4在50%和55%瘦肉率猪中的含量显著高于60%和65%的猪中(P<0.05);IL-6在50%瘦肉率猪中的含量最高,在65%瘦肉率猪中的含量最低,且这个最低值显著低于50%、60%瘦肉率的猪(P<0.05);FGF-2在50%瘦肉率猪中的含量最高,在55%瘦肉率猪中的含量最低,且这个最低值显著低于50%瘦肉率的猪(P<0.05)。(6)皮下脂肪率间差异,只有IL-6含量在不同皮下脂肪率间有显著差异,IL-6在30%皮下脂肪率猪中的含量最高,在15%和25%皮下脂肪率猪中的含量最低,且二者间差异显著(P<0.05)。
2.4 育肥性状和细胞因子关联性分析
对猪细胞因子含量和育肥性状进行关联性分析,结果(表3)表明,3种细胞因子含量间均呈正相关,相关系数分别为0.30、0.36、0.31;6个育肥性状间有8个正相关(最高值0.62)、6个负相关(绝对值最高值-0.69)、1个不相关(0)(不含自身);3种细胞因子含量与6个育肥性状间有9个正相关(最高值0.33)、9个负相关(绝对值最高值-0.44)。其中,细胞因子含量与育肥性状间的相关系数中,CCL4与瘦肉率呈负相关,且相关系数的绝对值最高(-0.44),与日增质量、皮下脂肪率均呈正相关;IL-6 与日增质量呈负相关,且相关系数的绝对值最高(-0.41),与瘦肉率也呈负相关,与皮下脂肪率呈正相关;FGF-2与日增质量、瘦肉率、皮下脂肪率均呈正相关,但相关系数均不高(≤0.1)。
3 讨论与结论
本研究中,3种细胞因子为趋化因子C-C-基元配体4(CCL4)[12]、猪白细胞介素6(IL-6)[21]和猪成纤维细胞生长因子2(FGF-2)[26],猪育肥性状主要包含日增质量、瘦肉率和皮下脂肪率[28]。研究结果表明,同一批猪屠宰采血后,测定的3种细胞因子含量对比,IL-6显著高于CCL4,CCL4又显著高于FGF-2。IL-6含量最高可能是分泌IL-6的细胞较多且进行血液循环的也较多有关,IL-6由活化的 T 细胞、成纤维细胞、脂肪细胞分泌和合成[17];FGF-2含量最低可能与分泌的细胞较少有关,FGF-2 主要由血管内的内皮细胞、平滑肌细胞、巨噬细胞分泌,且主要作用是促血管生成[29]。
细胞因子含量对猪育肥性状中的生长速度(日增质量)有一定影响,本研究发现,IL-6含量最高的猪,日增质量最慢,且随着IL-6含量降低,日增质量变快,提示IL-6含量与日增质量呈负相关,原因可能是炎症因子IL-6含量高的猪,会需要更高的能量用于保持健康[19],导致生长速度变慢。FGF-2 含量最高的猪中,生长速度最快,原因可能是生长速度快的猪,同样时间内会产生更多的肌肉,故肌肉因子FGF-2含量也较高[23]。
细胞因子含量对猪育肥性状中的瘦肉率也有一定影响,表现为CCL4、IL-6和FGF-2 3 种细胞因子含量最高的猪中,瘦肉率最低;反之,CCL4和IL-6含量最低的猪中,瘦肉率最高,说明CCL4和IL-6含量与瘦肉率呈负相关。CCL4能在促炎因子的刺激下通过吸引白细胞等免疫细胞定向趋化到炎症部位发挥作用[30],且CCL4注射配合高脂日粮的饲喂能加速小鼠的肥胖和脂肪肝形成[31],说明CCL4能促进脂肪形成,降低瘦肉率,与本研究结果一致。IL-6与瘦肉率呈负相关,可能与其功能有关,有研究表明,肥胖会导致炎症因子TNF-α、IL-6表达水平上升[18],脂肪增加后,瘦肉和瘦肉率就会相应下降。
细胞因子含量对猪育肥性状中的皮下脂肪率影响如下:皮下脂肪率和瘦肉率在一定程度上是相反的;所以,IL-6含量最高的猪,皮下脂肪率也最高;反之,IL-6含量最低的猪,皮下脂肪率也最低,说明IL-6细胞因子含量与皮下脂肪率呈正相关。研究表明,人血液中大约1/3的循环 IL-6 来自脂肪组织,IL-6 含量升高与肥胖呈正相关[19],这与本研究结果类似。
综上所述,育肥期苏紫猪血清中,IL-6含量最高,其次为CCL4含量,FGF-2含量最低(P<0.05)。IL-6含量与生长速度(日增质量)、瘦肉率呈负相关,与皮下脂肪率呈正相关;CCL4含量与瘦肉率呈负相关;FGF-2含量最高的猪生长速度最快。
参考文献:
[1]农业农村部种业管理司,全国畜牧总站. 中国畜禽种业发展报告2022[R]. 北京:中国农业科学技术出版社,2022.
[2]王学敏,涂 枫,任守文,等. 苏紫黑猪1~5世代繁殖与生长性能分析[J]. 江苏农业科学,2019,47(21):247-248.
[3]任守文,王学敏,葛云山,等. 苏钟猪在云南省的引种、扩繁和推广情况[J]. 江苏农业科学,2011,39(5):281-282.
[4]付言峰,李碧侠,李 兰,等. 苏钟猪脂蛋白脂肪酶的组织表达谱及其生物信息学分析[J]. 畜牧兽医学报,2012,43(12):1871-1878.
[5]吴云鹤. 淮猪若干福利饲养技术研究[D]. 南京:南京农业大学,2020.
[6]李玉莲,吴买生,王建伟,等. 大约克、杜洛克、巴克夏猪肥育和胴体性状比较分析[J]. 家畜生态学报,2018,39(3):44-47.
[7]付言峰,王泽平,廖 超,等. 杂交导入巴克夏血统苏紫猪生长发育性能分析[J]. 江苏农业科学,2022,50(17):169-173.
[8]赵云翔,邝伟键,高 宁,等. 杜洛克公猪背膘厚度、日增重、日采食量和饲料效率相关性状的遗传参数估计[J]. 家畜生态学报,2019,40(11):18-21.
[9]徐 忠,肖 倩,张 哲,等. 金华猪杂交组合繁殖、育肥、胴体与肉质性能的研究[J]. 畜牧与兽医,2018,50(3):6-9.
[10]李碧侠,赵为民,付言峰,等. 苜蓿草粉对苏山猪屠宰性能、胴体品质和肉质性状的影响[J]. 动物营养学报,2020,32(3):1090-1098.
[11]任守文,李碧侠,葛云山,等. 苏山猪选育研究[J]. 中国畜牧杂志,2020,56(11):47-51.
[12]丁祝進,崔虎军,谷昭天. 鱼类趋化因子家族的研究进展[J]. 中国水产科学,2021,28(9):1227-1237.
[13]Maurer M,von Stebut E. Macrophage inflammatory protein-1[J]. The International Journal of Biochemistry & Cell Biology,2004,36(10):1882-1886.
[14]Nomiyama H,Osada N,Yoshie O. The evolution of mammalian chemokine genes[J]. Cytokine & Growth Factor Reviews,2010,21(4):253-262.
[15]王秋霞,王 芳,楚富茗,等. 禽源趋化因子CCL4基因的表达及多克隆抗体的制备[J]. 中国兽医科学,2020,50(1):93-98.
[16]Tan K,Geng R J,Wang Z Q,et al. Anatomical structure,and expression of CCL4 and CCL13-like during the development of maxillary barbel in Paramisgurnus dabryanus[J]. Organogenesis,2019,15(1):13-23.
[17]Weissenbach M,Clahsen T,Weber C,et al. Interleukin-6 is a direct mediator of T cell migration[J]. European Journal of Immunology,2004,34(10):2895-2906.
[18]王丽萍. 低氧运动对食源性肥胖大鼠体重及血清炎症因子TNF-α、IL-6的影响[D]. 南昌:江西师范大学,2019.
[19]Hunter C A,Jones S A. IL-6 as a keystone cytokine in health and disease[J]. Nature Immunology,2015,16(5):448-457.
[20]李宇思,刘慧慧,沈松英,等. 母体外周血TNF-α、IL-6水平与子代出生体重的关系[J]. 中国生育健康杂志,2021,32(4):306-310.
[21]查安东,邢桂玲,高晓雯,等. IL6基因内含子3多态性与仔猪腹泻、生长和公猪繁殖性状的关联分析[J]. 畜牧兽医学报,2017,48(9):1674-1682.
[22]何 岩,刘 沛,韩广业,等. 成纤维细胞生长因子2通过AKT和ERK信号促进肾癌细胞增殖[J]. 现代泌尿外科杂志,2019,24(3):227-232.
[23]方 幸. 运动介导肌肉因子IGF-1、FGF-2对小鼠骨的影响[D]. 上海:华东师范大学,2018.
[24]Sanderson R D,Yang Y,Kelly T,et al. Enzymatic remodeling of heparan sulfate proteoglycans within the tumor microenvironment:growth regulation and the prospect of new cancer therapies[J]. Journal of Cellular Biochemistry,2005,96(5):897-905.
[25]Meyer A E,Pfeiffer C A,Brooks K E,et al. New perspective on conceptus estrogens in maternal recognition and pregnancy establishment in the pig[J]. Biology of Reproduction,2019,101(1):148-161.
[26]Kottakis F,Polytarchou C,Foltopoulou P,et al. FGF-2 regulates cell proliferation,migration,and angiogenesis through an NDY1/KDM2B-miR-101-EZH2 pathway[J]. Molecular Cell,201 3(2):285-298.
[27]王 睿. FGF9、miR-122在肥胖發生及预测中的作用[D]. 上海:上海交通大学,2016.
[28]陈 鑫,公红斌,李清春,等. 不同品系杜洛克后代商品猪育肥性能和屠宰性能的比较分析[J]. 石河子大学学报(自然科学版),2022,40(6):735-740.
[29]Sahni A,Altland O D,Francis C W. FGF-2 but not FGF-1 binds fibrin and supports prolonged endothelial cell growth[J]. Journal of Thrombosis and Haemostasis,2003,1(6):1304-1310.
[30]陈东平,罗 茜,黄 佩,等. 趋化因子CCL3、CCL4在儿童免疫性血小板减少症中的表达及临床意义[J]. 临床儿科杂志,2022,40(2):95-100.
[31]郑琳琳. 透穴埋线对肥胖脂肪肝大鼠血清TC、TG、LDL-C、HDL-C及肝细胞的影响[D]. 郑州:河南中医学院,2012.
